 Chapitre 3 Conductimétrie
Chapitre 3 Conductimétrie
Terminale STL – SPCL Chimie et développement durable. Fiche de synthèse – Chapitre 3 - Conductimétrie. 1. Chapitre 3. Conductimétrie. 1. Conductance.
 Chapitre 4 : Quest-ce que la conductimétrie ?
Chapitre 4 : Quest-ce que la conductimétrie ?
II Qu'est-ce que la conductance d'une solution ionique ? 1) « L'appareil » de mesure : la cellule conductimétrique : l. S. C'
 Chapitre 5 : Dosage par titrage
Chapitre 5 : Dosage par titrage
Elle s'exprime en siemens (S). La figure 5.1 présente le schéma d'une cellule conductimétrique. Conductance d'une solution. La conductance G
 Chimie Chapitre 2 Terminale S
Chimie Chapitre 2 Terminale S
Mais la réaction étant arrêtée les ions hydroxyde ajoutés ne sont plus consommés : la conductivité ? augmente alors fortement. b) Titrage par pH-métrie. ?
 LA CONDUCTIMÉTRIE
LA CONDUCTIMÉTRIE
La conductimétrie permet de mesurer les propriétés conductrices des >>La conductance électrique G (siemens S) d'une solution conductrice est une ...
 Terminale S
Terminale S
présents de leur concentration et de la température. Conductivité molaire ionique d'un ion. Chaque ion en solution est caractérisé par une conductivité molaire
 Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
On envisage d'effectuer le titrage conductimétrique d'une solution S' d'acide ascorbique dont la concentration molaire est de l'ordre de 6 × 10-3 mol.L-1 par
 SUIVI CONDUCTIMÉTRIQUE DUNE TRANSFORMATION CHIMIQUE
SUIVI CONDUCTIMÉTRIQUE DUNE TRANSFORMATION CHIMIQUE
4 juil. 2002 3. La conductance de la solution est mesurée au cours du temps. Les résultats sont rassemblés dans le tableau ci-dessous : t (s).
 Cours de soutien Conductance et conductivité 1BAC Fr. Bac
Cours de soutien Conductance et conductivité 1BAC Fr. Bac
Calculer l'aire S de chaque électrode. 3) a) Calculer la conductivité ? de la première solution. b) La conductivité molaire ionique de l'ion sodium
 Chapitre XIV: Les techniques de la chimie
Chapitre XIV: Les techniques de la chimie
Pour s'entraîner : « TS dosage conductimétrique par étalonnage » Au cours de ce titrage on repère l'équivalence par une brusque.
 [PDF] Chapitre 3 Conductimétrie
[PDF] Chapitre 3 Conductimétrie
Terminale STL – SPCL Chimie et développement durable Fiche de synthèse – Chapitre 3 - Conductimétrie 1 Chapitre 3 Conductimétrie 1 Conductance
 [PDF] 08conductimetriepdf
[PDF] 08conductimetriepdf
Terminale STL SPCL Partie 1/ Chimie minérale Fiche 8 : Conductimétrie ? La conductimétrie permet de mesurer les propriétés conductrices des solutions
 [PDF] Chapitre 4 : Quest-ce que la conductimétrie ? - Physagreg
[PDF] Chapitre 4 : Quest-ce que la conductimétrie ? - Physagreg
conductimétrique : l S C'est un ensemble de deux plaques (en cuivre ou en platine) qui trempe dans une solution ionique S est leur surface immergée dans
 [PDF] Chimie Chapitre 2 Terminale S
[PDF] Chimie Chapitre 2 Terminale S
Terminale S FICHE : CONDUCTIMETRIE Conductivité d'une solution électrolytique Une solution électrolytique est une solution qui contient des ions
 [PDF] Chimie Chapitre 2 Terminale S
[PDF] Chimie Chapitre 2 Terminale S
Terminale S CONTROLER LA QUALITE PAR Dosage par étalonnage utilisant la conductimétrie cours duquel le phénomène de dilution est négligeable
 [PDF] Conductance et conductivité - AlloSchool
[PDF] Conductance et conductivité - AlloSchool
1- Calculer la résistance de la portion d'électrolyte comprise entre les électrodes 2- Calculer la conductance en S 3- La conductivité de cette solution
 [PDF] Conductimétrie - AlloSchool
[PDF] Conductimétrie - AlloSchool
Conductimétrie ???? ???????? Première Partie : La mesure en chimie Unité 5 5 H I – Conductance d'une solution électrolytique :
 [PDF] Chapitre 5 : Dosage par titrage - Lycée dAdultes
[PDF] Chapitre 5 : Dosage par titrage - Lycée dAdultes
Pour mesurer la capacité d'une solution à conduire l'électricité on utilise un conductimètre ou cellule conductimétrique Il s'agit d'un appareil constitué
 [PDF] TP : Dosage par étalonnage conductimétrique - Physique - Chimie
[PDF] TP : Dosage par étalonnage conductimétrique - Physique - Chimie
Niveau Terminale - Physique-Chimie Compétences pouvant être évaluées au cours de l'activité Document 3 : Dosage par étalonnage conductimétrique
 Dosage conductimétrique - Maxicours
Dosage conductimétrique - Maxicours
Faire un dosage conductimétrique consiste à étudier l'évolution de la conductance d'une solution lorsqu'une réaction chimique faisant intervenir des ions s'y
Comment calculer la conductimétrie ?
La conductance G se mesure à l'aide d'un conductimètre, elle est proportionnelle à la conductivité ? : G = k' × C. La loi de Kohlrausch indique que la conductivité ? est proportionnelle à la concentration en quantité de matière C de la solution ? = k × C.Quel est le principe de la conductimétrie ?
Un titrage conductimétrique utilise la capacité des ions à conduire le courant électrique dans un milieu aqueux, on mesure alors la conductance de la solution gr? à une électrode. Comme chaque ion conduit le courant différemment, la conductance varie pendant le dosage.Quel est le but de la conductimétrie ?
Quel est le but de la conductimétrie ? Le but de la conductimétrie est de déterminer la concentration d'un acide, d'une base ou d'une solution saline au moyen de la conductance électrique G de la solution.- Un titrage (ou dosage) est une manipulation qui permet de déterminer la concentration d'une esp? en solution. Un titrage avec suivi conductimétrique (ou titrage conductimétrique) a lieu au cours d'une réaction qui fait intervenir au moins une esp? ionique.
AGIR Page 1 sur 8
Chimie, Chapitre 2 Terminale S
CONTROLER LA QUALITE PAR DOSAGE
Dans le domaine de la santé, de l'environnement ou de l'agroalimentaire, le contrôle de la qualité des produits
est effectué par des chimistes qui déterminent les concentrations de différentes espèces chimiques par dosage.
I DOSAGE PAR ETALONNAGE
1) Définition
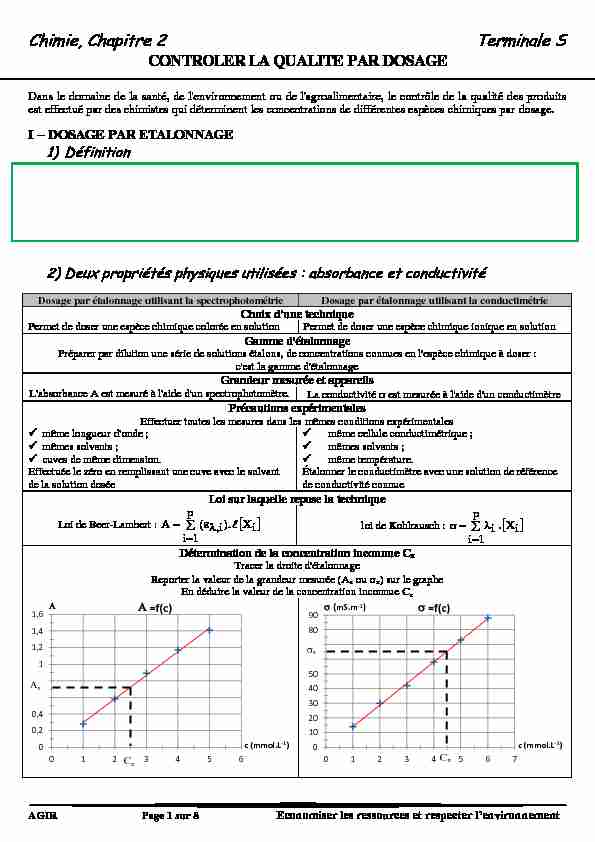
2) Deux propriétés physiques utilisées : absorbance et conductivité
Dosage par étalonnage utilisant la spectrophotométrie Dosage par étalonnage utilisant la conductimétrie
Choix d'une technique
Permet de doser une espèce chimique colorée en solution Permet de doser une espèce chimique ionique en solution
Gamme d'étalonnage
Préparer par dilution une série de solutions étalons, de concentrations connues en l'espèce chimique à doser :
c'est la gamme d'étalonnageGrandeur mesurée et appareils
L'absorbance A est mesuré à l'aide d'un spectrophotomètre. La conductivité est mesurée à l'aide d'un conductimètre
Précautions expérimentales
Effectuer toutes les mesures dans les mêmes conditions expérimentales9 même longueur d'onde ;
9 mêmes solvants ;
9 cuves de même dimension.
Effectuée le zéro en remplissant une cuve avec le solvant de la solution dosée9 même cellule conductimétrique ;
9 mêmes solvants ;
9 même température.
Étalonner le conductimètre avec une solution de référence de conductivité connueLoi sur laquelle repose la technique
Loi de Beer-Lambert :
OH p1iiX ).i,(A"
loi de Kohlrausch : Vp1iiX . iȜ
Détermination de la concentration inconnue Cx
Tracer la droite d'étalonnage
Reporter la valeur de la grandeur mesurée (Ax ou x) sur le graphe En déduire la valeur de la concentration inconnue Cx 0 0,2 0,4 0,6 0,8 1 1,2 1,4 1,60 1 2 3 4 5 6
c (mmol.L-1) =f(c) 0 10 20 3040
50
60
70
80
90
0 1 2 3 4 5 6 7
(mS.m-1) c (mmol.L-1) =f(c) Ax Cx x Cx Chimie Chapitre 2 : Contrôler la qualité par dosageAGIR Page 2 sur 8 Economiser
II DOSAGE PAR TITRAGE DIRECT
1) Définition
2) 0LVH HQ ±XYUH H[SpULPHQPMOH
9 espèce titrée. La solution dans laquelle cette espèce est présente est appelée solution titrée.9 espèce
titrante. La solution dans laquelle cette espèce est présente est appelée solution titrante.9 La solution titrante, dont on connaît avec précision la
concentration, est placée dans une burette graduée (de 25 mL en général) afin de mesurer à la goutte près le volume versé.9 La solution titrée, dont le volume a été mesuré avec précision à
pipette graduée (ou mieux, jaugée) est placée dans un bécher (ou mieux, dans un erlenmeyer afin9 Le récipient accueillant la solution titrée et un barreau
aimanté, est placé sur un agitateur magnétique3) Réaction de titrage
4) Equivalence d'un titrage
a) Définition b) 6XLYL TXMOLPMPLI G·XQ PLPUMJH ) Considérons un titrage pour lequel le mélange réactionnel contient : Une quantité nA de réactif titré A (initialement placé dans le bécher) ; Une quantité nB de réactif titrant B (initialement placé dans la burette) ; réaction de titrage est nul : xi = 0 mol. prend alors une valeur x.Solution titrante
Bécher
Solution titrée
Barreau aimanté
Agitateur magnétique
Burette graduée
Chimie Chapitre 2 : Contrôler la qualité par dosageAGIR Page 3 sur 8 Economiser
) A chaque fois, le réactif titrant ajouté réagit entièrement avec le réactif titré encore disponible. Ainsi, la
quantité de matière de réactif titré décroît à chaque ajout ) E de la solution de réactif titrant ajouté pour lequel le réactif titré a entièrement disparu. ) A delà detotalement consommée, donc la quantité de matière de réactif titrant augmente à chaque ajout.
c) 8PLOLVHU O·pTXLYMOHQŃH SRXU GpPHUPLQHU OM ŃRQŃHQPUMPLRQ LQŃRQnue Supposons que nous cherchons toujours à déterminer la concentration de l'espèce chimique A.Équation chimique a A + b B AE c C + d D
État Avancement (mol) Quantités de matière (mol)Initial 0 n°A n°B 0 0
Intermédiaire x n°A a.x n°B b.x c.x d.xFinal xE n°A a.xE n°B b.xE c.xE d.xE
E soit
On peut alors déterminer la concentration de l'espèce chimique B :5) Comment repérer l'équivalence d'un titrage direct ?
-être repérée par :) : généralement, on suit la variation de la conductivité ou du pH, grandeur liée à la
concentration de la solution. (§a) et b) suivants) ) Un changement de couleur du milieu réactionnel (§c) suivant). a) Titrage par conductimétrieExpérience 1
cours duquel le phénomène de dilution est négligeable. La réaction entre les deux solutions a pour équation :Solution titrante
chlorhydrique de concentration CA sodium de concentration CB inconnue Chimie Chapitre 2 : Contrôler la qualité par dosageAGIR Page 4 sur 8 Economiser
G (en S)
(en S.m-1) Description de la courbe de titrage = f(Vb)Le graphe possède trois parties distinctes :
Une première partie rectiligne au cours
de laquelle la conductivité diminue lorsque la quantité de réactif titrant ajoutée augmente ;Une deuxième partie curviligne dont le
du titrage ;Une troisième partie rectiligne au cours
de laquelle la conductivité augmente lorsque la quantité de réactif titrant ajoutée augmente ;Interprétation de la courbe de titrage
Données :
Avant , les ions oxonium constituent le réactif limitant ; la solution contient des ions sodium,hydroxyde et chlorure. Mais au fur et à mesure de la réaction, les ions hydroxyde consommés sont
remplacés, en quantités égales, par des ions chlorure moins conducteurs : la conductivité baisse alors
progressivement.A , tous les ions oxonium introduits ont réagi avec la totalité des ions hydroxyde initialement
présents dans la solution titrée ; la solution contient des ions sodium et chlorure : la conductivité
possède alors sa plus faible valeur. ; la solutioncontient des ions sodium, oxonium et chlorure. Mais la réaction étant arrêtée, les ions oxonium ajoutés ne
sont plus consommés : la conductivité augmente alors progressivement.Comment repérer O·pTXLYMOHQŃH
c Relier les points expérimentaux de la première phase par un segment de droite prolongé au- ;T Relier les points expérimentaux de la
troisième phase par un segment de droite prolongé en- ; e deux segments de droite correspond au volume de réactif titrant versé à uivalence. : VE Chimie Chapitre 2 : Contrôler la qualité par dosageAGIR Page 5 sur 8 Economiser
TMNOHMX G·MYMQŃHPHQP
Équation chimique H3O+ + HO-(aq) AE 2 H2O(ы)État Avancement
(mol)Quantités de matière
(mol) Compte-tenu des équations de dissolution des solutés, nous avons :¾ Expérience 2 :
éthanoïque par une solution de soude au cours duquel le phénomène de dilution est négligeable : Données : (HO-) = 19,92 ; (Na+) = 5,01 ; , les ions hydroxyde constituent le réactif limitant ; la solution contient des ions sodium et éthanoate. Mais au fur et à mesure de la réaction, les ions : la conductivité augmente alors légèrement.Aprè
épuisées ; la solution contient des ions sodium, hydroxyde et éthanoate. Mais la réaction étant arrêtée, les
ions hydroxyde ajoutés ne sont plus consommés : la conductivité augmente alors fortement. b) Titrage par pH-métrie¾ Experience 1 :
3O+ et Cl-(aq) ;
La solution de soude contient les ions Na+(aq) et HO-(aq) ; La réaction entre les deux solutions a pour équation :H3O+ + HO-(aq) = 2 H2O(l)
Solution titrante
Sonde pH-métrique
Bécher
Solution titrée
Barreau aimanté
Agitateur magnétique
pH-mètreBurette graduée
Chimie Chapitre 2 : Contrôler la qualité par dosageAGIR Page 6 sur 8 Economiser
Description de la courbe de titrage pH = f(Vb)
La courbe pH = f(vb) comporte trois parties :
Une partie pratiquement rectiligne, où le pH varie peu lors de l'addition de la base forte. La partie correspondant au saut de pH important, et comportant un point d'inflexion, c'est-à-dire un changement de concavité. Une partie où le pH varie de nouveau peu lors de l'ajout de la base forte, et tendant vers une asymptote parallèle à l'axe des abscisses.FRPPHQP UHSpUHU O·pTXLYMOHQŃH ?
Au niveau du saut de pH, la courbe possède un point singulier, le qui correspond à
TMNOHMX G·MYMQŃHPHQP
État Avancement (mol) Quantités de matière (mol)Initial 0
OH3n HOn 0Intermédiaire x
OH3n x HOn x 2.xFinal xE
OH3n xE HOn xE 2.xELe volume
EBVS+ j O·pTXLYMOHQŃH
et hydroxyde ont été entièrement consommés. De plus, la réaction conduità la formation d'eau : à l'équivalence, le pH de la solution est alors égal à 7 (à 25 °C).
Chimie Chapitre 2 : Contrôler la qualité par dosageAGIR Page 7 sur 8 Economiser
¾ Autres type de titrage :
Titrage réaction Courbe de titrage Description de la courbeBase forte par acide fort
H 3O + + HO -(aq)AE 2 H
2OLe pH est une fonction décroissante du
Cette courbe possède les mêmes fort par
une base forte le saut de pH est important.égal à 7
(à 25 °C)Acide faible par base forte
CH 3COOH (aq) + HO -(aq) AE CH 3COO -(aq) + H 2OA éthanoïque et les ions hydroxyde ont été entièrement consommés. Comme la réaction supérieur à 7 (à 25 °C). Ce pH correspond à l
Le saut de pH est moins important que lors
base forte.Base faible par acide fort
NH 3(aq) + H 3O + AE NH4+(aq)
+ H 2O A ions oxonium ont été entièrement consommés.Le saut de pH est aussi moins important que lors
base forte. Chimie Chapitre 2 : Contrôler la qualité par dosageAGIR Page 8 sur 8 Economiser
c) Titrages colorimétriques E : la coloration ou la -basique ou rédox) qui réagit une fois le réactif limitant épuisé : le changement iser doit , pour avoir la plus grande précision dans laExemple :
ence est 7 donc le Bleu deBromoThymol convient :
Indicateur coloré Couleur acide Zone de virage Couleur basiqueBleu de BromoThymol Jaune 6,0 7,6 Bleu
III - LES INCERTITUDES SUR LES TITRAGES
et variées :9 Utilisation de la verrerie :
Les incertitudes des pipettes et des fioles jaugées sont indiquées sur le verre. A défaut, prendre 0,5 % comme
incertitude relative. -division pour la lecture du " 0 pour la lecture du volume équivalent, soit 1 division au total (soit 0,1 mL) 9Avec une " belle
99 Précision sur la concentration de la solution titrante
La concentration de la solution titrante
quotesdbs_dbs29.pdfusesText_35[PDF] conductimétrie exercices corrigés
[PDF] conductimétrie tp
[PDF] conductimétrie formule
[PDF] conductimétrie pdf
[PDF] conductivité de l'eau potable
[PDF] facteur de correction température conductivité
[PDF] influence de la température sur la conductivité de l'eau
[PDF] conversion conductivité salinité
[PDF] conversion ms/cm en g/l
[PDF] conductivité en fonction de la température
[PDF] la conductivité d'une solution
[PDF] mesure de conductivité d'une solution
[PDF] relation conductivité température
[PDF] facteur de correction conductivité
