 Détermination de la conductivité : méthode électrométrique
Détermination de la conductivité : méthode électrométrique
La conductivité d'une solution est la mesure de la capacité des ions à transporter le courant électrique. Ce passage du courant électrique s'effectue par la
 Conductivité dune solution
Conductivité dune solution
La conductivité (sous-entendu électrique) d'une solution rend compte de sa capacité à conduire un courant électrique. En chimie on la note souvent σ (sigma)
 Chapitre 4 : Propriétés électriques des solutions
Chapitre 4 : Propriétés électriques des solutions
La présence d'ions dans une solution lui confère des propriétés de conduction électrique. Sa conductivité σ est facteur de la mobilité des ions et la mesure de
 CONDUCTIVITE DES SOLUTIONS 1. Electrolytes et conductivité 1.1
CONDUCTIVITE DES SOLUTIONS 1. Electrolytes et conductivité 1.1
C'est une conductivité de type ionique. Les porteurs de charge sont les ions (anions cations) présents dans la solution. 1.2 Conductance d'une solution. La
 Chapitre 3: SOLUTIONS ELECROLYTIQUES
Chapitre 3: SOLUTIONS ELECROLYTIQUES
où ɣ représente la conductivité (inverse de la résistivité) de la solution. Déterminons ɣi pour un type d'ion i de valence Zi de concentration molaire CI et
 Fiche méthode : Mesurer la conductivité dune solution aqueuse
Fiche méthode : Mesurer la conductivité dune solution aqueuse
Mesure de la conductivité d'une solution : Avant et entre deux mesures réalisées dans des solutions différentes il faut immerger la sonde dans un bécher d'eau.
 Guide des mesures de conductivité
Guide des mesures de conductivité
Les principales applications d'une cellule à 2 pôles sont la mesure de la conductivité de l'eau pure de solutions aqueuses très diluées et de solutions non.
 Chapitre 3 Conductimétrie
Chapitre 3 Conductimétrie
Pour une solution suffisamment diluée (c ≤ 10.10-2 mol/L)
 MA. 303 – pH-con-tur : Détermination du pH de la conductivité et de
MA. 303 – pH-con-tur : Détermination du pH de la conductivité et de
Sep 18 2023 Le pH sert à déterminer la concentration des ions d'hydrogène qui se retrouve dans une solution. Plus communément
 Les solutions
Les solutions
9. CONDUCTIVITE DES ELECTROLYTES. 9.1 Mesure de la résistance d'un électrolyte. La cuve dans laquelle se trouve la solution occupe
 Conductivité Théorie et Pratique
Conductivité Théorie et Pratique
Le thème abordé est la mesure de la conductivité c'est-à-dire la capacité d'une solution à transporter un courant électrique. Des mesures fiables et exactes
 Conductivité dune solution
Conductivité dune solution
La conductivité (sous-entendu électrique) d'une solution rend compte de sa capacité à conduire un courant électrique. En chimie on la note souvent ? (sigma)
 CONDUCTIVITE DES SOLUTIONS 1. Electrolytes et conductivité 1.1
CONDUCTIVITE DES SOLUTIONS 1. Electrolytes et conductivité 1.1
1.1 Définition. Un électrolyte est une solution permettant le passage du courant. C'est une conductivité de type ionique. Les porteurs de charge sont les ions (
 Fiche méthode : Mesurer la conductivité dune solution aqueuse
Fiche méthode : Mesurer la conductivité dune solution aqueuse
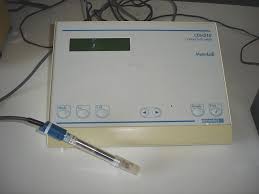
Un conductimètre est un appareil électronique permettant de mesurer la conductivité d'une solution c'est-à- dire sa capacité à conduire le courant.
 Détermination de la conductivité : méthode électrométrique
Détermination de la conductivité : méthode électrométrique
La conductivité d'une solution est la mesure de la capacité des ions à transporter le courant électrique. Ce passage du courant électrique s'effectue par la
 Relation entre la concentration en NaCl dune solution et sa
Relation entre la concentration en NaCl dune solution et sa
Cette solution est étiquetée « solution mère ». TP Relation concentration et conductivité dans une solution aqueuse NaCl. Page 1 / 6. Page 2
 INFLUENCE DE LA CONDUCTIVITÉ ÉLECTRIQUE DE LA
INFLUENCE DE LA CONDUCTIVITÉ ÉLECTRIQUE DE LA
INFLUENCE DE LA CONDUCTIVITE ELECTRIQUE DE LA SOLUTION. NUTRITIVE SUR LA CROISSANCE ET LE DEVELOPPEMENT DE LA TOMATE. DE sERRE cuLTrvEE AvEC ou sANS Ecr
 Chapitre 3 Conductimétrie
Chapitre 3 Conductimétrie
On mesure la valeur de la conductivité de la solution ? pour chaque volume V de solution titrante versée (tous les 1 mL) puis on trace la courbe de dosage ? =
 pH et CONDUCTIVITÉ
pH et CONDUCTIVITÉ
Le pH et la conductivité d'une solution de fontaine sont d'une importance majeure pour l'humidification des plaques. Page 2. QU'EST-CE QUE LE pH ? • Mesure l'
 Conductance et conductivité
Conductance et conductivité
Exercice 1 : La mesure de la conductivité d'une solution de chlorure de potassium + + ? de concentration C.
 [PDF] Conductance et conductivité - AlloSchool
[PDF] Conductance et conductivité - AlloSchool
Exercice 1 : La mesure de la conductivité d'une solution de chlorure de potassium + + ? de concentration C
 [PDF] Conductivité Théorie et Pratique - IGZ Instruments
[PDF] Conductivité Théorie et Pratique - IGZ Instruments
Le thème abordé est la mesure de la conductivité c'est-à-dire la capacité d'une solution à transporter un courant électrique Des mesures fiables et exactes
 [PDF] Conductivité en solution aqueuse
[PDF] Conductivité en solution aqueuse
La conductivité d'une solution est une fonction croissante de la concentration des ions qu'elle contient Considérons un électrolyte fort comme KCl et notons c
 [PDF] Travaux dirigés : Conductance et Conductivité
[PDF] Travaux dirigés : Conductance et Conductivité
3) Exprimer et calculer la conductivité de la solution en unité S I G =?x S/? ;?= ?/S x G = kxG = 075x102x 58x10-3 = 0435 S m-1
 [PDF] Chapitre 3 Conductimétrie
[PDF] Chapitre 3 Conductimétrie
La conductivité d'une solution électrolytique dépend : ? de la nature des ions présents dans la solution ; ? de leurs concentrations ; ? de la
 [PDF] CONDUCTIVITE DES SOLUTIONS 1 Electrolytes et conductivité 11
[PDF] CONDUCTIVITE DES SOLUTIONS 1 Electrolytes et conductivité 11
1 1 Définition Un électrolyte est une solution permettant le passage du courant C'est une conductivité de type ionique Les porteurs de charge sont les ions (
 [PDF] Fiche méthode : Mesurer la conductivité dune solution aqueuse
[PDF] Fiche méthode : Mesurer la conductivité dune solution aqueuse
Un conductimètre est un appareil électronique permettant de mesurer la conductivité d'une solution c'est-à- dire sa capacité à conduire le courant
 [PDF] Conductivité dune solution - mmelzani
[PDF] Conductivité dune solution - mmelzani
La constante de proportionnalité est notée ?o et rend compte du fait que chaque espèce d'ion se déplace plus ou moins facilement dans la solution (cf loi de
 [PDF] solution-de-exercices-de-la-conductance-et-la-conductivitc3a9pdf
[PDF] solution-de-exercices-de-la-conductance-et-la-conductivitc3a9pdf
1 2) La conductivité d'une partie d'une solution électrolytique dépend de la tension appliquée aux électrodes et au courant électrique qui passe dans le
 [PDF] La conductivité des solutions délectrolytes forts et faibles - CPH405
[PDF] La conductivité des solutions délectrolytes forts et faibles - CPH405
Sous sa forme pure l'eau est un très mauvais conducteur mais sa conductivité augmente rapidement lorsqu'on introduit des ions en solution En effet en

Terminale STL ʹ SPCL Chimie et développement durable Fiche de synthèse ʹ Chapitre 3 - Conductimétrie
11. Conductance
1.1. Solution électrolytique
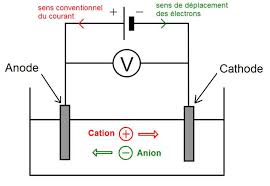
Une solution électrolytique est une solution qui conduit le courant électrique. Les porteurs de charges sont des ions
présents dans la solution : les cations se déplacent dans le sens conventionnel du courant et les anions dans le sens inverse.
1.2. Conductance
appelé cellule conductimétrique alimenté par un courant alternatif. Le volume V de la cellule conductimétrique est
compris entre les parties immergées des plaques : V = S.LG : conductance en Siemens (S)
U: tension efficace en Volt (V)
I : intensité efficace du courant en Ampère (A) électrolytique conduit le courant électrique.G : conductance en Siemens (S)
2. Conductivité
2.1. Définition
La conductance G est proportionnelle au rapport ௌ appelé facteur géométrique de la cellule conductimétrique :G = ௌ
G : conductance en S
S : surface de la cellule en m2
L : largeur entre les plaques en m
conductivité en S.m-1Terminale STL ʹ SPCL Chimie et développement durable Fiche de synthèse ʹ Chapitre 3 - Conductimétrie
2 La conductivité d'une solution électrolytique dépend :Contrairement à la conductance G, la conductivité ne dépend pas de la cellule conductimétrique utilisée.
2.3. Loi de Kohlrausch
présents : iiXi : conductivité en S.m-1 Exemple : solution aqueuse de chlorure de potassium de concentration c kClClkCl cPour une solution suffisamment diluée (c ч 1,0.10-2 mol/L) , la conductivité d'un électrolyte est proportionnelle à sa
concentration.3. Dosages :
3.1. Dosage par étalonnage
Un dosage par étalonnage consiste à déterminer la concentration molaire Cx d'une espèce chimique en solution Sx en
comparant une grandeur physique de la solution avec la même grandeur physique mesurée pour des solutions étalons Si
de concentrations molaires Ci connues.Loi de Kohlrausch
Terminale STL ʹ SPCL Chimie et développement durable Fiche de synthèse ʹ Chapitre 3 - Conductimétrie
33.1.1 Principe du dosage conductimétrique
plusieurs solutions contenant ce même soluté de concentrations Ci puis on trace la courbe i = f (Ci). On obtient une
3.1.2 Remarques
qui est en accord avec la loi de Kohlrausch pour des solutions diluées. Les solutions étalons utilisées respecteront ce critère
cherchée.3.2 Dosage par titrage direct
3.2.1 Principe
connue et le réactif titré dont on cherche à déterminer la concentration. La réaction chimique support du titrage doit être
rapide, totale et unique. Dispositif pour un titrage avec suivi par conductimétrieBurette graduée contenant la
solution titrante de concentration connue c2Cellule
conductimétriqueConductimètre
Agitateur
magnétiqueBécher contenant un
volume V1 de la solution titréeTerminale STL ʹ SPCL Chimie et développement durable Fiche de synthèse ʹ Chapitre 3 - Conductimétrie
4Définition :
Où A est le réactif titré et B le réactif titrant. valeur de CA, concentration de la solution titrée.3.2.3 Suivi par conductimétrie
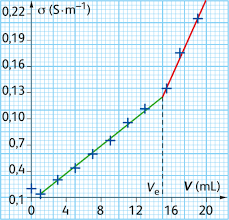
Détermination du volume équivalent, VE :
Lorsque des ions interviennent dans la réaction de titrage, un suivi conductimétrique est possible.
puis on trace la courbe de dosage ʍсĨ;Ϳ͘équivalent E.
Courbe de titrage conductimérique ʍ= f(V)
b Bn a AnTerminale STL ʹ SPCL Chimie et développement durable Fiche de synthèse ʹ Chapitre 3 - Conductimétrie
5V (mL)
Évolution de la conductivité en fonction
La réaction de précipitation est : Ag +(aq)+ Cl ʹ(aq)ͿїŐů(s) Ions présents dans le bécher H3O+ HO - Na+ Cl - NO3- H3O+ HO - Na+ Ag+ Cl - NO3-Evolution des quantités de
matièreEvolution de la conductivité
de la solutionOr (Cl- ) > (NO3-) donc la
conductivité diminue La conductivité augmente(HOʹ) = 19,9 mS.m2.mol-1 ; ( H3O+) = 35,0 mS.m2.mol-1 ; (Clʹ) = 7,63 mS.m2.mol-1 ; (NO3ʹ) = 7,14 mS.m2.mol-1 ;
Na+) = 5,01 mS.m2.mol-1 ; (Ag +) = 6,19 mS.m2.mol-1Burette graduée contenant
la solution de nitrate (Ag+ + NO3- )Bécher contenant un
volume V1 de chlorure de sodium (Na+ + Cl-) + 200mLCourbe du titrage ʍсf (V)
Dispositif du titrage
quotesdbs_dbs31.pdfusesText_37[PDF] relation conductivité température
[PDF] facteur de correction conductivité
[PDF] conductivité eaux usées domestiques
[PDF] cours conductivité électrique pdf
[PDF] résistivité cuivre ohm mm2 m
[PDF] résistivité cable aluminium
[PDF] résistivité du sol
[PDF] conductivité de l'eau déminéralisée
[PDF] conductivité électrique du sol définition
[PDF] la conductivité électrique pdf
[PDF] tp mesure de la conductivité électrique du sol
[PDF] tp determination du ph du sol
[PDF] conductivité électrique salinité des sols
[PDF] conductivité électrique définition
