REGLES DE REMPLISSAGE (2016-2017) a- Règle de
REGLES DE REMPLISSAGE (2016-2017) a- Règle de
REGLES DE REMPLISSAGE. (2016-2017) a- Règle de KLECHKOWSKI : - L'ordre croissant des sous niveaux d'énergie est celui de ( n + l ) croissant. - Lorsque deux
 Règles de remplissage pour les atomes polyélectroniques
Règles de remplissage pour les atomes polyélectroniques
La règle de Klechkowski indique le classement énergétique des différentes sous-couches Cette approche simple par les nombres quantiques souffre néanmoins d ...
 Architecture de la matière
Architecture de la matière
Définition. 16. 2. Règles et principes à respecter. 16 a. Le principe d'exclusion de Pauli (1925). 16 b. La règle (empirique) de Klechkowski. 17 c. La règle de
 Diapositive 1
Diapositive 1
Si la règle de Klechkowski n'est pas respectée on obtient aussi un état simple) on note autour du symbole de l'élément chimique les électrons de valence ...
 wikipedia : tableau périodique des éléments
wikipedia : tableau périodique des éléments
Règle de Klechkowski : Sous-couche 1s 1 case quantique → 2 électrons. → 2 éléments sur la 1re période. Sous-couche (*) Exceptions à la règle de Klechkowski.
 remplissage des électrons
remplissage des électrons
Dans un atome poly-électroniques les électrons remplissent les couches et sous-couches dans l'ordre donné par la règle de Klechkowski (schéma ci-contre) :.
 Corrigé
Corrigé
Il faut citer la règle de Klechkowski : « L'énergie des orbitales atomiques mol-1. Le corps simple. Dans le premier extrait des propriétés citées du ...
 REGLES DE REMPLISSAGES
REGLES DE REMPLISSAGES
REGLES DE REMPLISSAGE a- Règle de KLECHKOWSKI : - L'ordre croissant des sous niveaux d'énergie est celui de (n + l) croissant. - Lorsque deux sous niveaux
 Cours Atomistique(1).pdf
Cours Atomistique(1).pdf
5.4 Règle de KLECHKOWSKI centres des deux atomes liés par une liaison simple. • Sur une période : si Z augmente alors ra diminue. • Sur une colonne : si Z ...
 REGLES DE REMPLISSAGE (2016-2017) a- Règle de
REGLES DE REMPLISSAGE (2016-2017) a- Règle de
a- Règle de KLECHKOWSKI : - L'ordre croissant des sous niveaux d'énergie est celui de ( n + l ) croissant. - Lorsque deux
 Règles de remplissage pour les atomes polyélectroniques
Règles de remplissage pour les atomes polyélectroniques
La règle de Klechkowski indique le classement énergétique des différentes sous- Cette approche simple par les nombres quantiques souffre néanmoins d'un ...
 La règle de Klechkowski indique le classement énergétique des
La règle de Klechkowski indique le classement énergétique des
Cette approche simple par les nombres quantiques souffre néanmoins d'un certain nombre d'exceptions en particulier parmi les métaux de transition et les
 RÈGLE DE KLECHKOWSKI ET LANOMALIE DU CUIVRE
RÈGLE DE KLECHKOWSKI ET LANOMALIE DU CUIVRE
L'ordre de remplissage des orbitales atomiques se fait suivant la règle de Klechkowski : L'ordre est par ordre croissant d'énergie. Quand on arrive au bout d'
 Architecture de la matière
Architecture de la matière
Définition d'une orbitale La règle (empirique) de Klechkowski ... Si dans le corps simple
 Corrigé
Corrigé
Il faut citer la règle de Klechkowski : « L'énergie des orbitales atomiques est une Le corps simple ... 9) Rappeler la définition de la ductilité.
 Cours CH1 Structure des atomes
Cours CH1 Structure des atomes
Niveaux d'énergie rangé par ordre croissant selon la règle de Klechkowski . Utiliser un vocabulaire précis : élément atome
 wikipedia : tableau périodique des éléments
wikipedia : tableau périodique des éléments
Règle de Klechkowski : Sous-couche 1s 1 case quantique ? 2 électrons. ? 2 éléments sur la 1re période. Sous-couche 2s 1 case quantique ? 2 électrons.
 Atomistique
Atomistique
29 janv. 2019 Donner la configuration électronique de l'uranium prévue d'après la règle empirique de Klechkowski. Allons-y c'est parti !
 Chapitre 3 :Structure électronique des atomes
Chapitre 3 :Structure électronique des atomes
C) Règle de Klechkowski (empirique). Le remplissage des orbitales se fait suivant les valeurs croissantes de ln+ . A égalité on remplit les orbitales du n
 [PDF] La règle de Klechkowski
[PDF] La règle de Klechkowski
La règle de Klechkowski indique le classement énergétique des différentes sous-couches électroniques d'un atome D'après cette règle l'énergie des
 [PDF] Règles de remplissage pour les atomes polyélectroniques
[PDF] Règles de remplissage pour les atomes polyélectroniques
La règle de Klechkowski indique le classement énergétique des différentes sous-couches électroniques d'un atome D'après cette règle l'énergie des
 [PDF] Règle de KLECHKOWSKI : - Lordre croissant des sous niveaux d
[PDF] Règle de KLECHKOWSKI : - Lordre croissant des sous niveaux d
a- Règle de KLECHKOWSKI : - L'ordre croissant des sous niveaux d'énergie est celui de ( n + l ) croissant - Lorsque deux sous niveaux ont la même valeur de
 Règle de Klechkowski - Wikipédia
Règle de Klechkowski - Wikipédia
La règle de Klechkowski ne s'applique qu'aux atomes électriquement neutres à leur état fondamental : la configuration électronique des ions et des atomes
 [PDF] Architecture de la matière - Chimie en PCSI
[PDF] Architecture de la matière - Chimie en PCSI
Définition d'une orbitale La règle (empirique) de Klechkowski Si dans le corps simple les atomes de l'élément chimique sont réunis en molécules
 Exception à la règle de Klechkowski - Les éléments chimiques
Exception à la règle de Klechkowski - Les éléments chimiques
Il existe des exceptions à la règle de remplissage des orbitales appelée règle de Klechkowski certains métaux de transition ainsi que certains lanthanides
 Règle de Klechkowski - Physique quantique
Règle de Klechkowski - Physique quantique
La règle de Klechkowski est une méthode empirique qui décrit l'ordre de remplissage des électrons dans les orbitales d'un atome Catégories : Chimie quantique -
 [PDF] Chapitre 1 - Configuration électronique
[PDF] Chapitre 1 - Configuration électronique
Le diagramme de Klechkowski est un moyen mnémotechnique permettant de retrouver l'ordre de remplissage des couches électroniques d'un élément chimique
 25- exception de la règle de Klechkowski Configuration électronique
25- exception de la règle de Klechkowski Configuration électronique
13 jan 2021 · Playlist du cours complet d'atomistique : https://youtube com/playlist?list Durée : 11:19Postée : 13 jan 2021
Comment appliquer la règle de Klechkowski ?
Exceptions. Certains atomes ne respectent pas le principe de Klechkowski, surtout le cuivre, l'argent, l'or le chrome, le molybdène ou encore le palladium. En effet, dans ces atomes, on observe une couche d demi ou remplie, et une couche s dégarnie, tandis qu'elle devrait être totalement remplie.Quels sont les atomes qui font exception à la règle de Klechkowski ?
Pour déterminer la configuration électronique des éléments, on utilise un critère énergétique simple : l'état fondamental (de plus basse énergie) est obtenu en peuplant les orbitales de plus basse énergie. On remplit donc les sous-couches par le bas du spectre énergétique des orbitales.Quelles sont les règles de remplissage des couches électronique ?
La règle de Klechkowski implique donc que les électrons occupent successivement les sous-couches d'un atome dans l'ordre suivant : 1s ? 2s ? 2p ? 3s ? 3p ? 4s ? 3d ? 4p ? 5s ? 4d ? 5p ? 6s ? 4f ? 5d ? 6p ? 7s ? 5f ? 6d ? 7p.

RÈGLEDEKLECHKOWSKI
ETL'ANOMALIEDUCUIVRE
1L'ordre
L'ordre
l'orbitale3dauneéner l'orbitale 3 etladeuxièmeauniveau4. bͲLastructureduferest:1s2 2s 2 2p 63s2 3p 6 3d 6 4s 2 .CommentsefaitͲilquel'ionF e2+ aiela structure 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 0 etnonpaslastructure1s 2 2s 2 2p 6 3s 23p
6 3d 4 4s 2 ,étant cetteorbitalequipartentenpremier. 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 aulieude1s 2 2s 2 2p 6 3s 2 3p 6 3d 4 4s 2 ;demême,leCuivre:Cude29
électronsalastructure1s2
2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 aulieude1s 2 2s 2 2p 6 3s 2 3p 6 3d 9 4s 2 pourquoiunesoélectronsquiseterminepar4f
14 5d 4 6s 2 aulieude4f 14 5d 5 6s 1 inférieur 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 0 On jacente,le droite.N'oublio
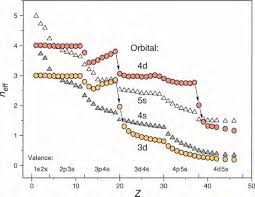
dro ite potentie coup droite.Ducoup,l'orbitale3dauneplusgrande contributionquel'orbitale 4sàunefaible violet.L'énergiedel'orbitale3drepasse en dessousdel'énergiedel'orbitale 4s. Toutceci est résumédansl'imageciͲdessous: 3 ͲExemplesde constructionsdelastructureélectronique d'atomes Prenonstoutd'abordl'exempleduScandiumScqui contient21 électrons.FabriquonsͲlepar (totalement ionisé).Oncommenceparremplir 1s2 2s 2 2p 6 3s 2 3p 6 .Ensuiteonajouteun électron supplémentaire.Onestdanslazoneleplusàdroiteoùl'orbitale3dadenouveau uneénergiepluspetitequel'orbitale4s.L'électronseplacedans l'orbitale3d.Onarriveà1s2 2s 2 2p 6 3s 2 3p 6 3d 1 .Ilreste deux électronsàplacer.Onpourraitpenserlogiquement,vuque lesorbitales3dontunniveaud'énergieplus petitquel'orbitale 4s,que ces deux électrons vontseplacerdansuneorbitale3d.Maislesorbitales3dsonttrès compactes,et l'électron a peude placededanspour circuler,par rapportàl'orbitale4squiesttrèsdiffuse,commeonle voitsurlesimagesciͲdessous.Orbitales 3d4/8
Orbitale4s
1s 2 2s 2 2p 6 3s 2 3p 6 3d 1 4s 24ͲLesanomaliesduChromeetduCuivre
On des etonapourleChrome:1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 ,plusfavorableénergétiquementque1s 2 2s 2 2p 6 3s 2 3p 6 3d 4 4s 2 onadenouveau1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2 etnonpas...3d 6 4s 1 ,carsionarrivaità3d 6 ,ily l'autre (cequin'étaitjamaislecasjusqu'àd 5 puisqu'ilya5orbitalesdpouvantcontenir5 entre lesorbitalCuivre,
queleSoleil.Ilesttouj5ͲConfirmationdupurhasard
On encoreassezléger celaplusendétail. LeZirconium(40électrons)seterminepar4d
2 5s 2 etl'élémentsuivantleNiobiumpar4d 4 5s 1 remplie !IdemTechnétium(43)...4d 5 5s 2 suiviparleRuthénium(44)...4d 7 5s 1 .Pourle ...4d 8 5s 1 ;Palladium(46)...4d 10 5s 0 .LeTungstène(74)à5d 4 6s 2 gardedeuxélectrons6ssans 7 6s 2 auPlatine(78)5d 9 6s 16ͲConclusion
ressortfinalementdupur hasard. ectronsavaientunedensitédeIln'enrestepas
forte,àdifférenced'énergie augmente4s nécessitelapriseen comptede lavariation d'énergie avec Zentrelesorbitales 3d et 4spar
écrantage électrostatique,larépulsiondesélectronsdanslesorbitalesdquidépendduspin,etl'interactionspinͲorbite.À causedecettecomplexité,cetterépartitionne peutêtrejustifiée
qu'aprèscoup auvudesrésultats expérimentaux, etaucunerèglesimple dustylemeilleure stabilité d'uneorbitalesemiͲremplien'est vraie.Iln'yaqu'unerègleadhoclocale uniquement utilepour lamémoire. 7ͲConfirmation parlaméthodedeHartreeͲFock
DanslaméthodedeHartree, on calculel'étatquantiquedechaqueélectrondansl'atome en considérantqu'ilestsoumisauchamp électriquedunoyaupluslechampélectrique moyen créé partous lesautres électrons.Onpartd'unesituationinitialeoù onplacetousles unélectron.Maisainsi,lesorbitales électroniquessontmodifiées parrapportàcellesde l'hydrogène,puisque maintenantunélectrondonnéest soumisà unchamp électriquetotal différentdeceluidel'hydrogène.Onrepartdecesnouvelles orbitales pourcalculerde nouveaulechampmoyen,etainsidesuitepar une méthode itérativequiconverge jusqu'àce qued'uneitérationàl'autre,iln'yait pasdemodificationdesorbitales,doncde larépartition desélectronsautourdunoyau. DanslaméthodedeHartreeͲFock,en plus,ontientcompteduspindesélectrons,par lefait que lafonctiond'onde totaledetouslesélectronsdoitêtreantisymétrique.On prendbien ainsi en compteleprinciped'exclusiondePaulietlefaitquedeuxélectronsdemêmespin sontenmoyenne,toutes choseségales parailleurs, plusloinlesunsdesautresquedeux électronsdespinsopposés,donconprendbienencomptelafameuseénergied'échange à laquelleonfaitappelpourjustifierles anomaliesduChrome etduCuivre. Surlesiteinternet:http://nlte.nist.gov/MCHF/,onpeutcalculerpourleCuivre par exemple, ladifférenced'énergie entrelesconfigurations3d10 4s 1 et3d 9 4s 2 .Lecalculnonrelativiste,en unitésdeHartree(1Hartree = 4,3597 X 10Ͳ18J)donnepourlesénergiesde3d10
4s 1 et 3d 9 4s 2 E(3d 10 4s 1 )=Ͳ1638,96;etE(3d 9 4s 2 )=Ͳ1638,95.Onretrouve bienla bonneconfiguration,mais ladifférencerelatived'énergie estde0,01/1639 =610Ͳ6 !Maissiontientcomptedela relativité,lecalcul relativistedonne:E(3d10 4s 1 )=Ͳ1652,669;et E(3d 9 4s 2 )=Ͳ1652,671,cequi donneraitpour étatleplus stable:3d9 4s 2 ! Ladifférenced'énergieest insignifiante.Onvoit que ladifférenced'énergieentrelesdeux états estdetoutefaçontellementfaiblequ'ils'agit biend'unhasard. Une orbitaledpleineà10électronsn'adoncriendemagiquepourEricScerri:
http://ericscerri.com/JimClark2012:
8/8quotesdbs_dbs29.pdfusesText_35[PDF] les nombres quantiques exercices corrigés pdf
[PDF] exercices sur configuration électronique d un atome
[PDF] représentation de lewis exercices pdf
[PDF] règle de klechkowski exception
[PDF] configuration electronique ion
[PDF] reséau informatique ppt
[PDF] reséau informatique cours complet pdf
[PDF] reséau informatique cours ppt
[PDF] projet maintenance informatique pdf
[PDF] les droites ab et cd sont elles parallèles vecteurs
[PDF] exercice calculer les coordonnées du milieu d un segment
[PDF] exercices corrigés de stéréoisomérie
[PDF] exercices corrigés en stéreochimie
[PDF] projection de newman exercices corrigés