 REGLES DE REMPLISSAGE (2016-2017) a- Règle de
REGLES DE REMPLISSAGE (2016-2017) a- Règle de
REGLES DE REMPLISSAGE. (2016-2017) a- Règle de KLECHKOWSKI : - L'ordre croissant des sous niveaux d'énergie est celui de ( n + l ) croissant. - Lorsque deux
 Règles de remplissage pour les atomes polyélectroniques
Règles de remplissage pour les atomes polyélectroniques
La règle de Klechkowski indique le classement énergétique des différentes sous-couches Cette approche simple par les nombres quantiques souffre néanmoins d ...
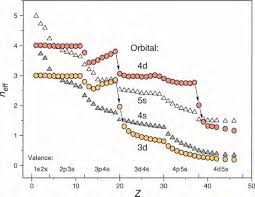 RÈGLE DE KLECHKOWSKI ET LANOMALIE DU CUIVRE
RÈGLE DE KLECHKOWSKI ET LANOMALIE DU CUIVRE
règle simple du style meilleure stabilité d'une orbitale semi-remplie n'est vraie. Il n'y a qu'une règle ad hoc locale uniquement utile pour la mémoire. 7 ...
 Architecture de la matière
Architecture de la matière
Définition. 16. 2. Règles et principes à respecter. 16 a. Le principe d'exclusion de Pauli (1925). 16 b. La règle (empirique) de Klechkowski. 17 c. La règle de
 Diapositive 1
Diapositive 1
Si la règle de Klechkowski n'est pas respectée on obtient aussi un état simple) on note autour du symbole de l'élément chimique les électrons de valence ...
 wikipedia : tableau périodique des éléments
wikipedia : tableau périodique des éléments
Règle de Klechkowski : Sous-couche 1s 1 case quantique → 2 électrons. → 2 éléments sur la 1re période. Sous-couche (*) Exceptions à la règle de Klechkowski.
 remplissage des électrons
remplissage des électrons
Dans un atome poly-électroniques les électrons remplissent les couches et sous-couches dans l'ordre donné par la règle de Klechkowski (schéma ci-contre) :.
 Corrigé
Corrigé
Il faut citer la règle de Klechkowski : « L'énergie des orbitales atomiques mol-1. Le corps simple. Dans le premier extrait des propriétés citées du ...
 REGLES DE REMPLISSAGES
REGLES DE REMPLISSAGES
REGLES DE REMPLISSAGE a- Règle de KLECHKOWSKI : - L'ordre croissant des sous niveaux d'énergie est celui de (n + l) croissant. - Lorsque deux sous niveaux
 Cours Atomistique(1).pdf
Cours Atomistique(1).pdf
5.4 Règle de KLECHKOWSKI centres des deux atomes liés par une liaison simple. • Sur une période : si Z augmente alors ra diminue. • Sur une colonne : si Z ...
 REGLES DE REMPLISSAGE (2016-2017) a- Règle de
REGLES DE REMPLISSAGE (2016-2017) a- Règle de
a- Règle de KLECHKOWSKI : - L'ordre croissant des sous niveaux d'énergie est celui de ( n + l ) croissant. - Lorsque deux
 Règles de remplissage pour les atomes polyélectroniques
Règles de remplissage pour les atomes polyélectroniques
La règle de Klechkowski indique le classement énergétique des différentes sous- Cette approche simple par les nombres quantiques souffre néanmoins d'un ...
 La règle de Klechkowski indique le classement énergétique des
La règle de Klechkowski indique le classement énergétique des
Cette approche simple par les nombres quantiques souffre néanmoins d'un certain nombre d'exceptions en particulier parmi les métaux de transition et les
 RÈGLE DE KLECHKOWSKI ET LANOMALIE DU CUIVRE
RÈGLE DE KLECHKOWSKI ET LANOMALIE DU CUIVRE
L'ordre de remplissage des orbitales atomiques se fait suivant la règle de Klechkowski : L'ordre est par ordre croissant d'énergie. Quand on arrive au bout d'
 Architecture de la matière
Architecture de la matière
Définition d'une orbitale La règle (empirique) de Klechkowski ... Si dans le corps simple
 Corrigé
Corrigé
Il faut citer la règle de Klechkowski : « L'énergie des orbitales atomiques est une Le corps simple ... 9) Rappeler la définition de la ductilité.
 Cours CH1 Structure des atomes
Cours CH1 Structure des atomes
Niveaux d'énergie rangé par ordre croissant selon la règle de Klechkowski . Utiliser un vocabulaire précis : élément atome
 wikipedia : tableau périodique des éléments
wikipedia : tableau périodique des éléments
Règle de Klechkowski : Sous-couche 1s 1 case quantique ? 2 électrons. ? 2 éléments sur la 1re période. Sous-couche 2s 1 case quantique ? 2 électrons.
 Atomistique
Atomistique
29 janv. 2019 Donner la configuration électronique de l'uranium prévue d'après la règle empirique de Klechkowski. Allons-y c'est parti !
 Chapitre 3 :Structure électronique des atomes
Chapitre 3 :Structure électronique des atomes
C) Règle de Klechkowski (empirique). Le remplissage des orbitales se fait suivant les valeurs croissantes de ln+ . A égalité on remplit les orbitales du n
 [PDF] La règle de Klechkowski
[PDF] La règle de Klechkowski
La règle de Klechkowski indique le classement énergétique des différentes sous-couches électroniques d'un atome D'après cette règle l'énergie des
 [PDF] Règles de remplissage pour les atomes polyélectroniques
[PDF] Règles de remplissage pour les atomes polyélectroniques
La règle de Klechkowski indique le classement énergétique des différentes sous-couches électroniques d'un atome D'après cette règle l'énergie des
 [PDF] Règle de KLECHKOWSKI : - Lordre croissant des sous niveaux d
[PDF] Règle de KLECHKOWSKI : - Lordre croissant des sous niveaux d
a- Règle de KLECHKOWSKI : - L'ordre croissant des sous niveaux d'énergie est celui de ( n + l ) croissant - Lorsque deux sous niveaux ont la même valeur de
 Règle de Klechkowski - Wikipédia
Règle de Klechkowski - Wikipédia
La règle de Klechkowski ne s'applique qu'aux atomes électriquement neutres à leur état fondamental : la configuration électronique des ions et des atomes
 [PDF] Architecture de la matière - Chimie en PCSI
[PDF] Architecture de la matière - Chimie en PCSI
Définition d'une orbitale La règle (empirique) de Klechkowski Si dans le corps simple les atomes de l'élément chimique sont réunis en molécules
 Exception à la règle de Klechkowski - Les éléments chimiques
Exception à la règle de Klechkowski - Les éléments chimiques
Il existe des exceptions à la règle de remplissage des orbitales appelée règle de Klechkowski certains métaux de transition ainsi que certains lanthanides
 Règle de Klechkowski - Physique quantique
Règle de Klechkowski - Physique quantique
La règle de Klechkowski est une méthode empirique qui décrit l'ordre de remplissage des électrons dans les orbitales d'un atome Catégories : Chimie quantique -
 [PDF] Chapitre 1 - Configuration électronique
[PDF] Chapitre 1 - Configuration électronique
Le diagramme de Klechkowski est un moyen mnémotechnique permettant de retrouver l'ordre de remplissage des couches électroniques d'un élément chimique
 25- exception de la règle de Klechkowski Configuration électronique
25- exception de la règle de Klechkowski Configuration électronique
13 jan 2021 · Playlist du cours complet d'atomistique : https://youtube com/playlist?list Durée : 11:19Postée : 13 jan 2021
Comment appliquer la règle de Klechkowski ?
Exceptions. Certains atomes ne respectent pas le principe de Klechkowski, surtout le cuivre, l'argent, l'or le chrome, le molybdène ou encore le palladium. En effet, dans ces atomes, on observe une couche d demi ou remplie, et une couche s dégarnie, tandis qu'elle devrait être totalement remplie.Quels sont les atomes qui font exception à la règle de Klechkowski ?
Pour déterminer la configuration électronique des éléments, on utilise un critère énergétique simple : l'état fondamental (de plus basse énergie) est obtenu en peuplant les orbitales de plus basse énergie. On remplit donc les sous-couches par le bas du spectre énergétique des orbitales.Quelles sont les règles de remplissage des couches électronique ?
La règle de Klechkowski implique donc que les électrons occupent successivement les sous-couches d'un atome dans l'ordre suivant : 1s ? 2s ? 2p ? 3s ? 3p ? 4s ? 3d ? 4p ? 5s ? 4d ? 5p ? 6s ? 4f ? 5d ? 6p ? 7s ? 5f ? 6d ? 7p.

Chapitre 5.1 - Elément et atome - Page 1 DL ArchitecturedelamatièreChapitre5.1:élémentetatomeChapitre5.2:laclassificationpériodiquedesélémentsChapitre5.3:moléculesetsolvantsCours de chimie de première période de PCSI
Chapitre 5.1 - Elément et atome - Page 2 DL L'élémentc m que:l'atomeàlaclassificationpériodiquedesé é entsObjetsetobjectifsdecechapitreDécrirecomplètementl'ét atd'unélectrondansunatome,puis décrirel'atomeluimême,endistinguantsesélectronsdecoeuretsesélectronsdevalence.Avant
ansl schapitr ssuivants:Etudierl'outilessentielqu'est laclassificationpériodiquedeséléments:bienenconnaîtr elacons tructionetêtrecapabled'en extrai retouteslesinformations.Queloutilmerveilleux!!Discuterdel'évolutiond' unenotio nfondamentaleenchimie:l'électronégativité.Préparerlechapitresuiva ntrelati fauxmolécules,etautresédifices polyatomiques.
Chapitre 5.1 - Elément et atome - Page 3 DL IElémentchimiqueetatome41.L'élém ntchimiqu 42.L' ntitéchimiqu tl' spèc chimiqu 43.D l'atom aucorpssimpl 5a-Compositiondel'atome5b-Isotopie6c-Moleetmassemolaire-d-Corpssimple94.Cation tAnion
'unélém ntchimiqu 10IIDescriptiondel'étatd'unélectrondansunatome101.Quantification l'én rgi l'él ctron:l suxnombr squantiqu sn tl11a-Atomeàplusieursélectrons:touslesatomessaufH11b-Casdel'hydrogène;extensionauxsystèmeshydrogénoïdes.112.L 3èm nombr quantiqu ounombr quantiqu magnétiqu ml.Définition
'un orbital atomiqu .12a.Lenombrequantiquemagnétique,notéml12b.Letriplet(n,l,ml):couche,sous-coucheetorbitaleatomique(OA)12c.Lediagrammedesniveauxd'énergied'unatomedonné143.L 4èm nombr quantiqu ounombr quantiqu magnétiqu
spinms15IIIConfigurationélectroniqued'unatome.Règlesàrespecter161.Définition162.Règl s tprincip sàr sp ct r16a.Leprinciped'exclusiondePauli(1925)16b.Larègle(empirique)deKlechkowski17c.LarègledeHund1-3.Configurationél ctroniqu
'unatom .Princip 'Aufbau,ou construction:"Aufbauprinzip».184.El ctrons coeur tél ctronsval nc 18a.Définition1-b.Casdesions19c.Exemples19d.Prévisiondelaformuledesionsmonoatomiquesd'unélémentdonné19IVInteractionsmatière-rayonnement201.Absorption témission212.Sp ctr
'émission l'atom 'hy rogèn :l'atom stémasqué!22 LePlanducours
Chapitre 5.1 - Elément et atome - Page 4 DL IElémentchimiqueetatome1.L'élémentchimiqueD'aprèsleLivred'ordel'IUPAC,visiter http://goldbook.iupac.org"Unélémen tchimiquedésignel'ensem bledesentitéschimiquesquisontcaractérisésparunnombredéfini deprotonsd ansleur noyauatomique.Cenombre,notéZ,estlenuméroatomiquedel'élémentchimique».Ex:• HClO,Cl2etCl-sontdesespèceschimiquesquicontiennentl'élémentchimiqueChlore.• DioxygèneO2,ozoneO3,ionoxyde O2-sontdesentité schimiques contenantl'élémentoxygène.2.L'entitéchimiqueetl'espècechimiqueEmployonsunvocabulaireprécisendistin guantuneespècechimiqueetuneen titéchimique:"Entitéchimique»désignetoutatome,molécule,ion,paired'ions,radical,diradical,ionradical,complexe,conformère,etc.,biendéfinichimiquementouisotopiquementetquipeutêtreidentifiéindividuellement."Espècechimique»dé signeunensembled' entitésc himiques(atomes,molécules,...)structuralementetchimiquementidentiques.Ex:"l cuivr »
ésign un spèc chimiqu tl'onpourraétu
i rlaformation 'unatom cuivr , onc 'un ntité,àun catho lors 'un él ctrolys par x mpl .Chapitre 5.1 - Elément et atome - Page 5 DL 3.Del'atomeaucorpssimplea-Compositiondel'atomePourlesbesoin sduchimist e,onpeutconsidérerq uel'atome estconstituédetroisparticules: Lenoyaudel'atomecomporteZprotons,etNneutrons.Lenombredemassedel'atomeestA=Z+N UncortègedeZélectronsautourdunoyauIlfautsurtoutbienretenirlesordresdegrandeursdeladimensiondunoyauetcelledel'atome:lediamètredel'atomeestenviron100000foisplusgrandqueceluidunoyau.(Silenoyauavaitundiamètrede1mm,l'atomeaundiamètrede100m).Delamêmefaçon,lamassed'unprotonestenviron1-36foisplusgrandequecelledel'électron.R m:l protonn' stpasun particul élém ntair caril stcomposé
troisquarks, til oitson xist nc àun int ractionfort quimainti ntl squarksliés.Mé iat urs laforc fort ,maissansmass :l sgluons.Zélectrons
NoyauAtomeZ
protons N neutrons diamètre : 1.10 -10 m = 100 pmdiamètre : 1.10 -15 m masse : m e = 9,1094.10 -31 kg charge : q e = - 1,602.10 -19 C masse du proton : m P = 1,6726.10 -27 kg charge du proton : q P = + 1,602.10 -19 C masse du neutron : m N = 1,6749.10 -27 kg charge : q N = 0Chapitre 5.1 - Elément et atome - Page 6 DL Zestlenuméroatomique:Zcaractérisechaqueélémentchimique.LenombredemasseAdonnelenombretotaldenucléons,sommedunombreZetdunombreN.b-Isotopieα-DéfinitionDeuxatomesqui ontmêmenuméroa tomiqueZm aisunnombre demasseAdifférentsontdesisotopes.(isotop :motinventéparSirFreddySoddyen1913:iso-topos:"mêmeplacedanslaclassificationpériodique).Notation
'unatom :X A Z 666C C C
:cesonttroisatomesdel'élémentcarbonecartouslestro ispossède nt6protons.Lesabondancesdesisotope ssontparfoistr èsdifférentes,parfoissensiblementégales:12C 12.000 000 0(0)* 98.93 (8) 0 0 13C 13.003 354 8378(10) 1.07 (8) 1/2 0.702411 IsotopeMasseatomique(ma/u)Abondanceatomiquenaturelle(%)12C12,0000000(0)9-,93(-)13C13,003354-37-(10)1,07(-)Autreexemple,nousrelevonspourlechlore:IsotopeMasseatomique(ma/u)Abondanceatomiquenaturelle(%)35Cl34,96--52721(69)75,2-(4)37Cl36,96590262(11)24,22(4)
Chapitre 5.1 - Elément et atome - Page 7 DL Soddyautilisélapremièrefoislemot"isotope»dansunarticlede1913:"Th sam al g braicsumof positiv an
n gativ charg sinth nucl us,wh nth arithm tic sumis iff r nt ,giv swha tIcall"isotopes»orisotopic l m nts,b caus th yoccupyth sam plac inth p rioictabl ».β-AbondanceisotopiqueL'abondanceisotopiqueindiquelepourcentaged'unisotopedonnédanslafamilledesdifférentsisotopesd'unélémentchimique.Régulièrement,lesmassesmolairesdesélémentschimiquessontactualiséesparcequel'onconnaîtavecdeplusenplusdeprécisionl'abondancedesdifférentsisotopesd'unélémentdonné.Lamassemolaired'unélémentchimiqueestobtenueenfaisantlasommedesmassesmolairesdesdifférentsisotopesmultipliésparleurabondancerelative.γ-StabilitédesisotopesTouslesisotop esd'unélé mentchimiquenesontpasst ables.Onpeut retrouverlesstabilitésrelativesdesdifférentsisotopesd'unélémentàl'aidedudiagrammedeSegré.Certainsisotopessonttrèsstables,d'autresnelesontpasetdanscecas,leurduréedeviepeutvar ierdequelque sannées,jours,heu resàque lquesfractionsinfimesde seconde.Par exemple, dans notre organisme, le potassium-40, se désintègre et sa demi-vie est égale à 1,3 milliard d'années. Il se désintègre en donnant un atome de calcium-40.
Chapitre 5.1 - Elément et atome - Page 8 DL Surcediagramme,ontrouve:• Enabscisse:lenombreNdeneutrons• Enordonnée:lenuméroatomiqueZAutrediagramme,interactifenvousrendantsurlesiteindiqué:visiter http://www.nndc.bnl.gov/chart/Rem:EmilioGinoSegréSegréaobtenul ePrix NobeldePhysiqueen1959,encom pagniede Chamberlainpourleurdécouvertedel'antiproton.Enchimi e,Segréadécouvert letechnicium(Tc),avecPerrier,premierélémentartificiel,en1937,l'astate(At),avecCorsonetMacKenzie.c-Moleetmassemolaire
Chapitre 5.1 - Elément et atome - Page 9 DL Suivantlespropositionsentr'autresdel'IUPAC,ladéfinitiondelamolefutfinalementadoptéeparla14èmeCGPM(ConférenceGénéraledesPoidsetMesures1971,Résolution3;CR,7-etMetrologia,1972,-,36):1. Lamoleestlaquantitédematièred'unsystèmecontenantautantd'entitésélémentairesqu'ilyad'atomesdans0,012kilogrammedecarbone12;sonsymboleest"mol».2. Lorsqu'onemploielamole,lesentitésélémentairesdoiventêtrespécifiéesetpeuven têtredesatomes,desmo lécules,desi ons,deséle ctrons,d'autresparticulesoudesgroupementsspécifiésdetellesparticules.Ilenrésultequelamassemolaireducarbone12estégaleà0,012kilogrammeparmoleexactement,M(12C)=12g/mol.Lamolee stdéfiniec ommelenombre d'atomesdecarbonepré sentsdans1 2gdecarboneC-12.Cenombreestlenombred'Avogadro,oulaconstanted'Avogadro:NA=6,0221023mol-1Cettevaleurdunombred'AvogadroaétédéterminéeparPerrinparplusd'unedizainedeméthodesaudébutduXXèmesiècle.Pourcalculerlamassemolaired'unélémentchimique,l'ontientcomptebienentendudesonabondanceisotopique.d-Corpssimpleα-DéfinitionUncorpssimpleestuneespècechimiquenecomportantqu'unélémentchimique.Si,danslecorpssimple,lesatomesdel'élémentchimiquesontréunisenmolécules,onparlealorsdecorpssimplemoléculairecommedanslecasdudihydrogène(H2),dudiazote(N2),dudiiode(I2),del'ozone(O3).Danslecascontraire,parexemple,celuidesmétauxoudesgazmonoatomiques,ils'agitdecorpssimplesélémentaires:argent(Ag),cuivre(Cu),hélium(He),Krypton(Ar),etc...β-AllotropieL'allotropie(dugrecallosautreettroposmanière)estlafacultédecertainscorpssimplesd'existersousplusieursformescristallinesoumoléculairesdifférentes.Ainsi,parexemple,legraphite,lediamant,lesfullerènesou,découvertplusrécemmentlegraphène,sontlesvariétésallotropiquesducarboneausensoùcesontdifférentesformescris tallinesducorpssimplecorrespondant àl'éléme ntchimiquecarbon e.Le
Chapitre 5.1 - Elément et atome - Page 10 DL dioxygèneetletrioxygène(o uozone) sontéga lementdesvariétésallotropiques ducorpssimplecorrespondantàl'élémentchimiqueoxygène,maiscettefoisausensoùcesontdifférentesformesmoléculaires.Notonsquec'estBer zélliusquia introduitcette notiond'allotropie,etqu'ellefaitl'objetd'unlivreduchimisteNacquetdès1860:Chimiste,ethommepolitiquefrançais,néàCarpent rasen 1-34etmortàParisen1916.4.CationetAniond'unélémentchimique UnatomeX estélectriqu ementn eutre:sonnoya up ossèdeZprotons etlecortègeélectroniquepossèdedoncZélectrons. UnionXa+(respectivementXb-)estconstituéd'unnoyaupossédanttoujoursZprotonsetd'uncortègeélectroniquede(Z-a)électrons(respectivement:(Z+b)).IIDescriptiondel'étatd'unélectrondansunatomePourdécrirel'étatd'unélectrondansunatomedonné,lamécaniquequantiquemontrequelaconnaissancede4nombresappelésnombresquantiquesestnécessaire(chaquenombreétantliéàlaquantificationd'unegrandeurphysiqueprécise).Remarques:La quantique a vu le jour au début du vingtième siècle lorsque les physiciens durent s'avouer l'impossibilité de comprendre certains phénomènes, tel l'effet photoélectri que ou le rayonnement des atomes et leur consti tution, à l'aide des concept s de la m écanique dite depuis " classique ». Si cette mécanique, classique, forgée depuis le 17ème siècle, avait obtenu des succès considérables (mouvements des astres ou encore théorie électromagnétique), il n'était pas possible par e xemple de re ndre compte des observations e xpériment ales qui découlaient des investigations du domaine atomique. Alors, tout ceci va conduire les physiciens des années 1920 à d'abord abandonner quelques concepts, puis établir les bases d'une nouvelle théorie pour décrire les particules élémentaires, la mécanique quantique, ou, plus simplement, la quantique, qui va permettre une description cohérente des phénomènes à l'échelle atomique. La phase d'établissement de cette nouvelle théorie s'achèvera vers la fin des années 1920. Commence alors la phase de déploiement de
Chapitre 5.1 - Elément et atome - Page 11 DL cette théorie. Les anné es 1925 à 1928 sont les pl us riches de l'hi stoire de la mécanique quantique. A ce jour, aucun phénomène physique n'a pu ébranler ou remettre en cause les conceptions quantiques essentielles. 1.Quantificationdel'énergiedel'électron:lesdeuxnombresquantiquesnetlCettequantificationdel'énergiedel'électrondansl'atomerésultedel'observationdeplusieursfaitsexpérimentauxdudébutXXèmesiècle):travauxdePlancketEinsteinsurlerayonnementducorpsnoiretl'effetphotovoltaïque;observationsdespectresderaiesdesatomes,...a-Atomeàplusieursélectrons:touslesatomessaufHL'énergied'unélectrondans unatomenepeu tprendrequecertainesva leursprécises,encoreditediscrètes:cetteénergieestquantifiée,etcettedémonstrationdelaquantificationdel'énergiedel'électronapermisd'interpréterlesspectresderaiesdesatomes.Danstoutatomeautrequeceluid'hydrogène,l'énergiedel'électrondépenddedeuxnombresquantiques: n,nombrequantiqueprincipal:n∈N*:n=1,2,3,... l,nombrequantiquesecondaireouazimutal,entiertelque:0!l Chapitre 5.1 - Elément et atome - Page 12 DL nombrequantiquep rincipaletprendlaformedecelledel'atomeH,aufacteurZ2multiplicatifprès.Atomed'hydrogèneIonhydrogénoïdeChargedunoyau1.eZ.eEnergieEnduniveaun2 .Z2Exemplesdesystèmeshydrogénoïdes.C'estlecasdessystèmessuivants:!L'ionhydrogénoïdeHe+:noyaudecharge2.e(Z=2protons),etunseulélectron.!L'ionhydrogénoïdeLi2+:noyaudecharge3.e(Z=3protons)etunseulélectron.Danstoutautresystèmeàplusd'unélectron,onconsidèrequ'unélectrondonnéneperçoitpaslachargeZdunoyau,maisunechargeaffaiblieparlaprésencedesautresélectronsetquiestnot éeZeff.Zeffestappeléel achargenucléaireeffective ,etelle dépenddesdeuxnombresquantiquesnetl.2.Le3èmenombrequantiqueou nombrequantiquemagnétiqueml.Défini tiond'uneorbitaleatomique.Les2nombresprécédentsnesuffisentpaspourdécrirel'étatd'unélectrondansl'atome.a.Lenombrequantiquemagnétique,notémlIldécritlecomportementd'unélectrondansunchampmagnétique,c'estlenombrequantiquemagnétique,notéml,telque:Pourunevaleurdeldonnée,-l!ml!+lparpasde1b.Letriplet(n,l,ml):couche,sous-coucheetorbitaleatomique(OA)Chaquenombrencaractériseunecoucheélectroniqu e,repér éeparunelettremajuscule:n12345...DésignationdecoucheKLMNO...Chaquedoublet(n,l) caractériseunesous-coucheélectroniqu e,associéeàunniveaud'énergieE(n,l ).La valeurdelestainsi codifiée(codehéritédes spectroscopistes): Chapitre 5.1 - Elément et atome - Page 13 DL l01234...Désignationdelasous-couchessharppprincipald Chapitre 5.1 - Elément et atome - Page 14 DL Figure 2 : 1+3+5 = 9 = 3x3 OA N'ont PAS la même énergie dans tout autre atome que HPourconnaître l'étatd'unél ectronoccupantuneorbitale atomique,3nombresquantiquessontdoncnécessaires:• n∈N*,nombrequantiqueprincipal• l,nombrequantiquesecondaireouazimutal,entiertelque:0!l Chapitre 5.1 - Elément et atome - Page 15 DL Atomed'hydrogèneAutreatome3.Le4èmenombrequantiqueounombrequantiquemagnétiquedespinmsL'étatdel'électronesttotalementconnuenintroduisantlespindel'électron.Acespinélectronique,sontassociés2nouveauxnombresquantiques:• Lenombrequantiquedespin,notésetquivautpourtouslesélectronsdel'universs=+1/2.• Lenombrequantiquemagnétiquedespin,notéms,etquivautsoit+1/2,soit-1/2.Cesdeuxétatspossiblesdespinsontdésignésparleslettresαetβ,ouencoreparlesflèchesopposées"(spinup)et#(spin own).Cesontdoncautotal4nombresquantiquesquidécriventunélectrondansunatome(le5ème,s,estlemêmepouttouslesélectrons):Les4nomb resqua ntiquesn,l,mletmspermettentdeconn aîtrel'étatd'un électrondansunatome.1s2s3s4s2p3p4p3d4d4fEnergien=1n=2n=3n=4n=5n=61s2s3s4s2p3p4p3dEnergie Chapitre 5.1 - Elément et atome - Page 16 DL IIIConfigurationélectroniqued'unatome.Règlesàrespecter1.DéfinitionEcrirelaconfiguratio nélectroniqued'unatome,c'estpr éciserquel estleremplissagedesdifférentescouchesetsous-couches.Ceremplissageobéitàquelquesrèglesetprincipesénoncésci-dessous.2.Règlesetprincipesàrespectera.Leprinciped'exclusiondePauli(1925)"Dansunatome polyélectronique,deuxélectronsnepeuventpasavoirleurs4nom bresquantiquesidentiques».WolfgangPauli(1900-195-),physici ensuissed'origineautrichi enne,professeuràl'Ins titutFédéraldeTechnologie(ETH)deZurichetàl'InstitutofAdvancedStudyPrinceton.Ilénonceleprinciped'exclusionqui portesonnom,émetl'hypothèse duneutrino, quiapparaîtdans ladésintégrationβ.PrixNobeldephysiqueen1945.Conséquencesdeceprincipe: Uneorbitaleatomiquenepeutcontenirauplusquedeuxélectrons,quidiffèrentalorsparleurnombredespin. Sideuxélectronsontlemêmenombredespin,ilsnepeuventpasoccuperunemêmeorbitaleatomique. Lacouchenestremplieavec2n2autotal. Chapitre 5.1 - Elément et atome - Page 17 DL b.Larègle(empirique)deKlechkowskiDansunatomedonné,l'énergied'uneorbitaleatomiqueestunefonctioncroissantedelasomme(n+l);à(n+l)donné,l'énergieestunefonctioncroissanteden.Attention,cetterèglesoufredenombreusesexceptions,deplusenplusnombreuseslorsqueZcroît.Iln'estpasnécessairedeconnaîtrecesexceptions,maisilpeutparfoisêtrepossibledelesinterpréter"assezfacilement».QuelquesexceptionsàlarègledeKlechkowskiàconnaître,commepourlesatomesCr,Cu,AgouencoreAu.Onpeutretrouverl'ordrederemplissagedessous-couchesparénergiecroissanteavecunpetitdiagrammecommeceluiquisuit:ln0123477s7p7d7f7g66s6p6d6f6g55s5p5d5f5g44s4p4d4f33s3p3d22s2p11sAinsi,l'ordrederemplissagedesdifférentesOAestlesuivant:1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f6d7pn+l=12345678 Chapitre 5.1 - Elément et atome - Page 18 DL c.LarègledeHundLorsquelesélectronsp euplentles orbitalesatomiquesd'unniveaud'énergiedégénéré,lastabilitémaximaleestatteinteenplaçantlemaximumd'électronsseulsdanschaqueorbitaleetdanslemêmeétatdespin Multiplicitédespinmaximale "Lesélectronstendentàrestercélibataires.» "mêmeétatdespin»=mêmevaleurdems.Ex mpl :occupation uf r(Z=26)3.Configurationélectroniqued'unatome.Principed'Aufbau,oudeconstruction:"Aufbauprinzip».Laconfi gurationélectroniquefondamentaled'unat omeestcellequiminimisesonénergie.ElleestobtenueenrespectantlesrèglesprécédentesetenremplissantlesOAparvaleurd'énergiecroissante.L'étatfondamentaldel'atomeestceluid'énergieminimale:touslesautresétatsoùl'électronsrestenttousliésaunoyausontdesétatsexcités.Rem:siunatomeperdunélectron,ilestdansunétationiséLeprin ciped'écritured'unecon figurationélectroniquerep osesurlesrèglesprécédentes,etporteaussilenomde"principed'Aufbau».Att ntion,carilyaplusi ursanomali s t sconfigurationss mblantanormal s.4.Electronsdecoeuretélectronsdevalencea.DéfinitionLesélectron squisontmisenjeudansles réactions chimiquesquiimp liquent unélémentchimiquesont lesélectronsdevalenc e.Ilestdonc importantde savoirlesrepérerdanslaconfigurationélectroniqued'unatomedonné.l"="2 Chapitre 5.1 - Elément et atome - Page 19 DL Lesélectronsdevalenced'unatomesontlesplusexternes.Cesontlesélectronsdenombrequantiqueprincipalnleplusélevéetceuxdessous-couches(n-1)dou(n-2)fencoursderemplissage.Cesontcesseulsélectronsdevalencequisontresponsablesdepropriétéschimiquesdel'élémentetcesonteuxqu isontd oncmisen jeudansl'ét ablissementd esliaisons chimiques.Lesautresélectrons,fortementliésaunoyausonteuxappelés"électronsdecoeur».b.CasdesionsSoitXl'élémentdenuméroatomiqueZ.CationXp+:onremplitlesOAenrespectantlesmêmesrèglespouryplacer(Z-p)électrons.AnionXq-:onremplitlesOAenrespectantlesmêmesrèglespouryplacer(Z+q)électrons.c.ExemplesLaconfig urationélectroniquefondamentaled'unat omeestcellequiminimisesonénergie.ElleestobtenueenrespectantlesrèglesprécédentesetenremplissantlesOA.d.Prévisiondelaformuledesionsmonoatomiquesd'unélémentdonnéNousreverronsunp eup lusloinl econceptd'électronéga tivitéétudiéenclassedepremière.Utilisons-letelquevousl'avezvujusqu'àaujourd'hui.Dansl'atomeAd'unélémentdonné,lesélectronsquisontmisenjeudanslesréactionssontlesélectronsdevalence.Supposonsqu'ilenaitp.Alors,ilyadeuxsituations:• SoitAestliéàun atomeBplu sélec tronégati fquelui :al orsilcèdesesp électronsdevalence.ApassesoussaformecationiqueAp+.• SoitAes tliéàun atomeBmoins électr onégatif quelui :al orsilcaptel esélectronssuffisantspourqu'il réaliseunoctetd'él ectronsde valence.OnretrouveraAsouslaformeanioniqueA(--p)-. Chapitre 5.1 - Elément et atome - Page 20 DL IVInteractionsmatière-rayonnementL'analysedelalumièrequies tabsorbé eouémise paruncorpss'appe llela"spectroscopie».La spectroscopieajoué,etjoue toujours,unrôle centraldansl'analysedesélémentsmicroscopiquesquiconstituentunobjet.caractèreondulatoiredelalumièreLesdifférentesrégionsduspectreélectromagnétique.Isoléendessous:domainedelalumièrevisible.Lalumièreestunrayonnementélectromagnétiquequipeutêtredécritparuneondelongueurd'ondeλetunefréquenceν,tellesqueλ=c/νoùcestlavitessedelalumièredanslevide.Lalumièrepeutêtreaussidécritepardesphotonsquitransportechacununecertainequantitéd'énergie,onparledequantumd'énergie,etcetteénergieEest proportionnelleàlaf réquenceνdelalumi ère:E =h.ν.hest uneconstantefondamentale,c'estlaconstantedePlanck.Dansnotreviequotidienne,noussommesrégulièrementconfrontésauxinteractionsentrematièreetrayonnement:• Onparlede"ferchaufféaurouge»ou"chaufféàblanc»• Oneffectuedesradiographies.Danschaquecas,lerayonnementpeutêtresoitémis,soitabsorbé.Enchimie, "réalis runsp ctr »cons isteàmesurerl'absorption oul' émissiond'unrayonnementdelongueurd'ondedonnéparuncorps. Chapitre 5.1 - Elément et atome - Page 21 DL Ilexistedeuxgra ndstypesdespectres :les spectrescontinusetlesspectresdiscontinus:• Surunspectrecontinu,lecorpsémetunrayonnementcontinudanslazonedelongueurd'ondeconsidérée(commeparexemplelalumièrenaturelle).• Surunspectrediscontinu,onobserveradesraiesindiquantqueseulescertaineslongueursd'ondesontémisesparlecorps étudié. Parexemple,leso diumvaémettredanslejaune-orangélorsdeladésexcitationd'undesesélectrons.Cettelumièreestcelleémise parlesla mpesécla irantlesruesetles tunnels parexemple,ouencoreparlalampeàvapeurdesodiumdupolarimètredeLaurent.Danslasuitedenotrecours,nousrestreindronsnotreétudeàlalumièreforméedephotonsdefaible énergie,c'estàd ireàl'étudedurayonnementradio-fréquencejusqu'auprocheUV.Danscechapitreprécisément,iln'yaquelesradiationsdudomainevisibleetUVquisontmisesenjeu.Noustraiterons lamatièreetlalumièreaunive audesph énomènesmicroscopique sdoncquantiques.1.AbsorptionetémissionNoussavonsdéjàque:• Danstoutatome,l'énergiedesélectronsestquantifiée.Ellenepeutprendrequecertainesvaleurs,quisontparailleursnégatives.• L'électron"nerayonne pas»lorsqu'ilestdansunétatst ationnaire, maisuniquementlorsqu'ilsauted'unétatstationnaireàunautredontl'énergieestplusfaible.Ilémetalorsunrayonnementdontlafréquenceestcaractéristiquedel'atome.L'électronnepeuts'éloignerindéfinimentdunoyaudel'atome:onditquelesétatsstationnairesdel'électronsontdesétatsliés.L'absorptiond'unphotond'énergieΔΕ=h.ν=h.c/λcorrespondaupassagedel'atomedesonétatfondamentalàundesesétatsexcités.L'étatfondamentald'unatomeestl'étatstable:c'estceluid'énergieminimale.Sousl'actiond'uneperturbation,l'atomepeutquittercetétatstablepourêtreportéàunétatexcité.Ilyresteratrèspeudetempsavantderetourne rspontan émentàl'étatfondamental.On appelle"transition" cetteévolutionaucoursdelaquellel'atomepassed'unétatàunautreétat(étatfondamentaletétatsexcités).• Unetransitionélectroniquecorrespondaupassaged'unétat,ouconfigurationélectroniqueparticulièreàunnouvelétat,ounouvelleconfigurationélectronique.C'estaucoursd'unetransitionqu'unphotonestémisouabsorbé.• Dansunspectre d'émissi on,ono bservele passagedel'atomed'un niveau d'énergieEpversunniveaud'énergieEnplusfaible;unphotond'énergieεestémisaucoursdecettedésexcitation: • Dansunspectred'absorption,c'estlepassaged'unétatd'énergieinférieureversunétatd'énergiesupérieurequisetraduiraparuneraieàlalongueurd'ondeλtelleque:np Chapitre 5.1 - Elément et atome - Page 23 DL Spe tre 'émission el'hy rogènegazeuxobtenu anslarégion uvisibleet el'UVpro heSpe tre 'émission el'hy rogènegazeuxobtenu anslarégion uvisibleWollastonetFraunhofe rontbe aucouptravaillésurcesspectrescar actéris tiquesdechaqueatome(Fraunho feraétudiéle spectred'émissionduso leildès1-14).Lesspectressontgénéralementcompliqués,maislesuisseBalmeretlesuédoisRydbergontdécouvert"uncodemystérieux" quirégissa itl'allurede cesspectres.Unesériearithmétiquepermetd'engendrer,fréq uenceaprèsfréquence,l 'ensembleduspectred'unélément.En1--5(annéedenaissancedeBohr,le7octobre),Balmer(1-25-1-9-),instituteurbâloisférudenuméro logie,étudial esraies duspectred'émissiondel'atomed'hydrogènesituéesdanslevisible,etremarqua,ennotanttoujoursνlesfréquences,quel'onavait:] σestappelé" nombred'onde":ils 'exprimee nm-1danslesystème S.I;RHestlaconstantedeproportionnalitédéterminéealorsexpérimentalement,appeléeconstantedeRydberg,etquivaut:RH=1,0967757.107m-1soit109677cm-1.JohannesRYDBERG1 Chapitre 5.1 - Elément et atome - Page 24 DL lesraiesduspectredel'atomed'hydrogèneengénéralisantlaformuledeBalmer.Ensuite,en190-,Ritzgénéralisalaformuleprécédenteàtouslesatomes,souslaforme:p,n Danscesdeuxexpressions,netp∈N*etn3p3dniveau"d'énergie"de"la"
sous"couche"3s l"="0 3sniveau"d'énergie"de"la"
sous"couche"3p niveau"d'énergie"de"la" sous"couche"3d E h. h E - E ν
En EMISSION : elle
correspond ‡ la dÈsexcitation de l'atome photonÈmis Ep En E E Ep En ABSORPTION :
elle correspo nd ‡ l'exc itation de l'atome E Ep En E Èlectron
photonabsorbÈ 2.Spectred'émissiondel'atomed'hydrogène:l'atomeestdémasqué!Reprenonslecasdenotreatomed'hydrogène:Lespectred'émissiondel'atomed'hydrogèneestobtenuensoumettantduhydrogène,gazeux,sousfaiblepression,àunedéchargeélectrique,dansuntubedeGeissler.Lesmoléculesdedihydrogèneso ntdisso ciéesenhydrogèneatomique.Enanal ysantlerayonnementémisparcethydrogèneatomique,onobserveunspectreconstituéde4raiesdansledomaineduvisible.Lespectrenecomportantquequelquesraiesestun"spectrediscontinu",ou"spectrederaies".Pourlesoleil parexemp le,desraiescorres pondantcette foisàl'abs orptionfurentobservéesdès1-14parFraunhofer.L'atomed'hydrogène,leplusléger,alespectreleplussimple.
/ 109 680[ - ] 4 p
Atome 111
R[ - ]
n p ésormaisl'atom , tc quip rm t
écrir sonétat.Décrivonsmaint nantlacl assificationpério iqu sélém nts ns basan tsurl sconfigurationsél ctroniqu s satom s... Lyman 1906-1014 n=1
n = infini n =1 n = 2 n = 3 n = 4 n = 5 Energie
Nom de différentes séries Balmer
1885 n=2
Paschen
1908 n=3
Brakett
1922 n=4
Pfund 1924 n=5
n = 6 Humphreys
1953 n=6
Les autres séries nont pas de nom
quotesdbs_dbs31.pdfusesText_37
[PDF] les nombres quantiques exercices corrigés pdf
[PDF] exercices sur configuration électronique d un atome
[PDF] représentation de lewis exercices pdf
[PDF] règle de klechkowski exception
[PDF] configuration electronique ion
[PDF] reséau informatique ppt
[PDF] reséau informatique cours complet pdf
[PDF] reséau informatique cours ppt
[PDF] projet maintenance informatique pdf
[PDF] les droites ab et cd sont elles parallèles vecteurs
[PDF] exercice calculer les coordonnées du milieu d un segment
[PDF] exercices corrigés de stéréoisomérie
[PDF] exercices corrigés en stéreochimie
[PDF] projection de newman exercices corrigés
