 Règles de remplissage pour les atomes polyélectroniques
Règles de remplissage pour les atomes polyélectroniques
La règle de Klechkowski indique le classement énergétique des différentes sous-couches Il s'agit d'une règle rigoureuse sans exception aucune. Règle de Hund ...
 RÈGLE DE KLECHKOWSKI ET LANOMALIE DU CUIVRE
RÈGLE DE KLECHKOWSKI ET LANOMALIE DU CUIVRE
L'ordre de remplissage des orbitales atomiques se fait suivant la règle de Klechkowski : aussi le problème des exceptions à cette nouvelle règle ad hoc comme ...
 CHAPITRE IV : MODELE QUANTIQUE DE LATOME
CHAPITRE IV : MODELE QUANTIQUE DE LATOME
Pour établir une configuration électronique il faut respecter trois règles : la règle de. Klechkowski
 Diapositive 1
Diapositive 1
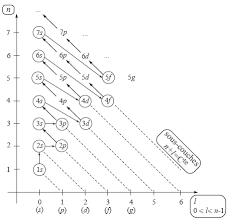
Si la règle de Klechkowski n'est pas respectée on obtient aussi un état Exceptions de Klechkowski. 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d ...
 CHIMIE GENERALE ET ORGANIQUE
CHIMIE GENERALE ET ORGANIQUE
Principe d'exclusion de Pauli (Cases quantiques). 9. 1.5. Règle de Hund. 11. 1.6. Limites de la règle de Klechkowski et exceptions aux règles de remplissage. 12.
 Untitled
Untitled
Exceptions à la règle de Klechkowski. Exemples: - le chrome: 24Cr: 1s2 2s2
 REGLES DE REMPLISSAGES
REGLES DE REMPLISSAGES
REGLES DE REMPLISSAGE a- Règle de KLECHKOWSKI : - L'ordre croissant des sous niveaux d'énergie est celui de (n + l) croissant. - Lorsque deux sous niveaux
 Chapitre 1:
Chapitre 1:
5.4 Règle de KLECHKOWSKI On note deux exceptions à la règle de Klechkowski
 Cours Atomistique(1).pdf
Cours Atomistique(1).pdf
5.4 Règle de KLECHKOWSKI On note deux exceptions à la règle de Klechkowski
 Chimie Générale
Chimie Générale
%20II%20ET%20III%20Chimie%20G%C3%A9n%C3%A9rale.%20COURS%20M%C3%A9deine%20.pdf
 La règle de Klechkowski indique le classement énergétique des
La règle de Klechkowski indique le classement énergétique des
même état quantique (ie se voir attribuer les cinq mêmes nombres quantiques). Il s'agit d'une règle rigoureuse sans exception aucune. Règle de Hund : pour une
 Règles de remplissage pour les atomes polyélectroniques
Règles de remplissage pour les atomes polyélectroniques
La règle de Klechkowski indique le classement énergétique des différentes Principe d'exclusion de Pauli : deux électrons d'un même atome ne peuvent être ...
 Atomistique
Atomistique
29 janv. 2019 En supposant que la règle de Klechkowski soit suivie cela conduit à la ... S'il n'y avait pas d'exception à la règle de Klechkowski
 Cours de chimie Générale
Cours de chimie Générale
Dans la très grande majorité des cas il suffit de suivre la règle de Klechkowski pour obtenir cette configuration. Il existe toutefois des exceptions.
 RÈGLE DE KLECHKOWSKI ET LANOMALIE DU CUIVRE
RÈGLE DE KLECHKOWSKI ET LANOMALIE DU CUIVRE
1- Règle de Klechkowski et ses difficultés c- Cette règle présente des exceptions ainsi le Chrome : Cr de 24 électrons a la structure 1s.
 Architecture de la matière
Architecture de la matière
Quelques exceptions à la règle de Klechkowski à connaître comme pour les atomes Cr
 wikipedia : tableau périodique des éléments
wikipedia : tableau périodique des éléments
Règle de Klechkowski : Sous-couche 1s 1 case quantique ? 2 électrons Gaz rare. 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6. (*) Exceptions à la règle de Klechkowski.
 ch.ci.1:structure de latome et configurations electroniques
ch.ci.1:structure de latome et configurations electroniques
Règles de Klechkowski Hund et principe d'exclusion de Pauli * ou ** [C2] 1) Selon la règle de Klechkowsky
 Corrigé
Corrigé
Il faut citer la règle de Klechkowski : C'est la règle de Hund qui précise que : ... Le principe d'exclusion de Pauli indique que :.
 CHAPITRE III : MODELE QUANTIQUE DE LATOME
CHAPITRE III : MODELE QUANTIQUE DE LATOME
Pour établir une configuration électronique il faut respecter trois règles : la règle de. Klechkowski
 [PDF] La règle de Klechkowski
[PDF] La règle de Klechkowski
La règle de Klechkowski indique le classement énergétique des différentes sous-couches électroniques d'un atome D'après cette règle l'énergie des
 Exception à la règle de Klechkowski - Les éléments chimiques
Exception à la règle de Klechkowski - Les éléments chimiques
Il existe des exceptions à la règle de remplissage des orbitales appelée règle de Klechkowski certains métaux de transition ainsi que certains lanthanides
 [PDF] Règles de remplissage pour les atomes polyélectroniques
[PDF] Règles de remplissage pour les atomes polyélectroniques
La règle de Klechkowski indique le classement énergétique des différentes sous-couches électroniques d'un atome D'après cette règle l'énergie des
 [PDF] Règle de KLECHKOWSKI : - Lordre croissant des sous niveaux d
[PDF] Règle de KLECHKOWSKI : - Lordre croissant des sous niveaux d
a- Règle de KLECHKOWSKI : - L'ordre croissant des sous niveaux d'énergie est celui de ( n + l ) croissant - Lorsque deux sous niveaux ont la même valeur de
 25- exception de la règle de Klechkowski Configuration électronique
25- exception de la règle de Klechkowski Configuration électronique
13 jan 2021 · Playlist du cours complet d'atomistique : https://youtube com/playlist?list Durée : 11:19Postée : 13 jan 2021
 Règle de Klechkowski - Wikipédia
Règle de Klechkowski - Wikipédia
La règle de Klechkowski du nom du chimiste russe Vsevolod Kletchkovski également appelée règle de Madelung (notamment dans les pays anglo-saxons)
 [PDF] RÈGLE DE KLECHKOWSKI ET LANOMALIE DU CUIVRE
[PDF] RÈGLE DE KLECHKOWSKI ET LANOMALIE DU CUIVRE
1- Règle de Klechkowski et ses difficultés c- Cette règle présente des exceptions ainsi le Chrome : Cr de 24 électrons a la structure 1s
 [PDF] Architecture de la matière - Chimie en PCSI
[PDF] Architecture de la matière - Chimie en PCSI
Règles et principes à respecter La règle (empirique) de Klechkowski Quelques exceptions à la règle de Klechkowski à connaître comme pour les atomes
 [PDF] CHAPITRE IV : MODELE QUANTIQUE DE LATOME
[PDF] CHAPITRE IV : MODELE QUANTIQUE DE LATOME
La règle de Klechkowski fonctionne selon un principe de stabilité: Les Les exceptions aux règles de remplissage sont peu nombreuses dans le haut de la
 [PDF] LA CONFIGURATION ELECTRONIQUE DES ATOMES
[PDF] LA CONFIGURATION ELECTRONIQUE DES ATOMES
LES REGLES POUR ETABLIR LA CONFIGURATION ELECTRONIQUE D'UN ATOME A L'ETAT FONDAMENTAL: Exceptions à la règle de Klechkowski Exemples:
Quelles sont les exceptions à la règle de Klechkowski ?
Exceptions. Certains atomes ne respectent pas le principe de Klechkowski, surtout le cuivre, l'argent, l'or le chrome, le molybdène ou encore le palladium. En effet, dans ces atomes, on observe une couche d demi ou remplie, et une couche s dégarnie, tandis qu'elle devrait être totalement remplie.Comment appliquer la règle de Klechkowski ?
Le diagramme de Klechkowski permet de retrouver cette séquence au moyen d'une construction simple :
1toutes les sous-couches s sont disposées en diagonale ;2les sous-couches p, d, f, etc. suivantes sont ajoutées à la suite sur la même ligne ;3la lecture se fait colonne par colonne.Quelles sont les règles de remplissage des couches électronique ?
Pour déterminer la configuration électronique des éléments, on utilise un critère énergétique simple : l'état fondamental (de plus basse énergie) est obtenu en peuplant les orbitales de plus basse énergie. On remplit donc les sous-couches par le bas du spectre énergétique des orbitales.- Le principe de Pauli établit que deux électrons doivent différer par au moins un de leurs nombres quantiques. Ceci est donc vrai pour chacune des particules à semi-spin, également appelées fermions. Ceux-ci incluent également des électrons, des protons et même des neutrons.
Chapitre 5.1 - Elément et atome - Page 1 DL ArchitecturedelamatièreChapitre5.1:élémentetatomeChapitre5.2:laclassificationpériodiquedesélémentsChapitre5.3:moléculesetsolvantsCours de chimie de première période de PCSI
Chapitre 5.1 - Elément et atome - Page 2 DL L'élémentc m que:l'atomeàlaclassificationpériodiquedesé é entsObjetsetobjectifsdecechapitreDécrirecomplètementl'ét atd'unélectrondansunatome,puis décrirel'atomeluimême,endistinguantsesélectronsdecoeuretsesélectronsdevalence.Avant
ansl schapitr ssuivants:Etudierl'outilessentielqu'est laclassificationpériodiquedeséléments:bienenconnaîtr elacons tructionetêtrecapabled'en extrai retouteslesinformations.Queloutilmerveilleux!!Discuterdel'évolutiond' unenotio nfondamentaleenchimie:l'électronégativité.Préparerlechapitresuiva ntrelati fauxmolécules,etautresédifices polyatomiques.
Chapitre 5.1 - Elément et atome - Page 3 DL IElémentchimiqueetatome41.L'élém ntchimiqu 42.L' ntitéchimiqu tl' spèc chimiqu 43.D l'atom aucorpssimpl 5a-Compositiondel'atome5b-Isotopie6c-Moleetmassemolaire-d-Corpssimple94.Cation tAnion
'unélém ntchimiqu 10IIDescriptiondel'étatd'unélectrondansunatome101.Quantification l'én rgi l'él ctron:l suxnombr squantiqu sn tl11a-Atomeàplusieursélectrons:touslesatomessaufH11b-Casdel'hydrogène;extensionauxsystèmeshydrogénoïdes.112.L 3èm nombr quantiqu ounombr quantiqu magnétiqu ml.Définition
'un orbital atomiqu .12a.Lenombrequantiquemagnétique,notéml12b.Letriplet(n,l,ml):couche,sous-coucheetorbitaleatomique(OA)12c.Lediagrammedesniveauxd'énergied'unatomedonné143.L 4èm nombr quantiqu ounombr quantiqu magnétiqu
spinms15IIIConfigurationélectroniqued'unatome.Règlesàrespecter161.Définition162.Règl s tprincip sàr sp ct r16a.Leprinciped'exclusiondePauli(1925)16b.Larègle(empirique)deKlechkowski17c.LarègledeHund1-3.Configurationél ctroniqu
'unatom .Princip 'Aufbau,ou construction:"Aufbauprinzip».184.El ctrons coeur tél ctronsval nc 18a.Définition1-b.Casdesions19c.Exemples19d.Prévisiondelaformuledesionsmonoatomiquesd'unélémentdonné19IVInteractionsmatière-rayonnement201.Absorption témission212.Sp ctr
'émission l'atom 'hy rogèn :l'atom stémasqué!22 LePlanducours
Chapitre 5.1 - Elément et atome - Page 4 DL IElémentchimiqueetatome1.L'élémentchimiqueD'aprèsleLivred'ordel'IUPAC,visiter http://goldbook.iupac.org"Unélémen tchimiquedésignel'ensem bledesentitéschimiquesquisontcaractérisésparunnombredéfini deprotonsd ansleur noyauatomique.Cenombre,notéZ,estlenuméroatomiquedel'élémentchimique».Ex:• HClO,Cl2etCl-sontdesespèceschimiquesquicontiennentl'élémentchimiqueChlore.• DioxygèneO2,ozoneO3,ionoxyde O2-sontdesentité schimiques contenantl'élémentoxygène.2.L'entitéchimiqueetl'espècechimiqueEmployonsunvocabulaireprécisendistin guantuneespècechimiqueetuneen titéchimique:"Entitéchimique»désignetoutatome,molécule,ion,paired'ions,radical,diradical,ionradical,complexe,conformère,etc.,biendéfinichimiquementouisotopiquementetquipeutêtreidentifiéindividuellement."Espècechimique»dé signeunensembled' entitésc himiques(atomes,molécules,...)structuralementetchimiquementidentiques.Ex:"l cuivr »
ésign un spèc chimiqu tl'onpourraétu
i rlaformation 'unatom cuivr , onc 'un ntité,àun catho lors 'un él ctrolys par x mpl .Chapitre 5.1 - Elément et atome - Page 5 DL 3.Del'atomeaucorpssimplea-Compositiondel'atomePourlesbesoin sduchimist e,onpeutconsidérerq uel'atome estconstituédetroisparticules: Lenoyaudel'atomecomporteZprotons,etNneutrons.Lenombredemassedel'atomeestA=Z+N UncortègedeZélectronsautourdunoyauIlfautsurtoutbienretenirlesordresdegrandeursdeladimensiondunoyauetcelledel'atome:lediamètredel'atomeestenviron100000foisplusgrandqueceluidunoyau.(Silenoyauavaitundiamètrede1mm,l'atomeaundiamètrede100m).Delamêmefaçon,lamassed'unprotonestenviron1-36foisplusgrandequecelledel'électron.R m:l protonn' stpasun particul élém ntair caril stcomposé
troisquarks, til oitson xist nc àun int ractionfort quimainti ntl squarksliés.Mé iat urs laforc fort ,maissansmass :l sgluons.Zélectrons
NoyauAtomeZ
protons N neutrons diamètre : 1.10 -10 m = 100 pmdiamètre : 1.10 -15 m masse : m e = 9,1094.10 -31 kg charge : q e = - 1,602.10 -19 C masse du proton : m P = 1,6726.10 -27 kg charge du proton : q P = + 1,602.10 -19 C masse du neutron : m N = 1,6749.10 -27 kg charge : q N = 0Chapitre 5.1 - Elément et atome - Page 6 DL Zestlenuméroatomique:Zcaractérisechaqueélémentchimique.LenombredemasseAdonnelenombretotaldenucléons,sommedunombreZetdunombreN.b-Isotopieα-DéfinitionDeuxatomesqui ontmêmenuméroa tomiqueZm aisunnombre demasseAdifférentsontdesisotopes.(isotop :motinventéparSirFreddySoddyen1913:iso-topos:"mêmeplacedanslaclassificationpériodique).Notation
'unatom :X A Z Xestlesymboledel'élémentchimiqueEx:isotopeducarbone:121314 666C C C
:cesonttroisatomesdel'élémentcarbonecartouslestro ispossède nt6protons.Lesabondancesdesisotope ssontparfoistr èsdifférentes,parfoissensiblementégales:12C 12.000 000 0(0)* 98.93 (8) 0 0 13C 13.003 354 8378(10) 1.07 (8) 1/2 0.702411 IsotopeMasseatomique(ma/u)Abondanceatomiquenaturelle(%)12C12,0000000(0)9-,93(-)13C13,003354-37-(10)1,07(-)Autreexemple,nousrelevonspourlechlore:IsotopeMasseatomique(ma/u)Abondanceatomiquenaturelle(%)35Cl34,96--52721(69)75,2-(4)37Cl36,96590262(11)24,22(4)
Chapitre 5.1 - Elément et atome - Page 7 DL Soddyautilisélapremièrefoislemot"isotope»dansunarticlede1913:"Th sam al g braicsumof positiv an
n gativ charg sinth nucl us,wh nth arithm tic sumis iff r nt ,giv swha tIcall"isotopes»orisotopic l m nts,b caus th yoccupyth sam plac inth p rioictabl ».β-AbondanceisotopiqueL'abondanceisotopiqueindiquelepourcentaged'unisotopedonnédanslafamilledesdifférentsisotopesd'unélémentchimique.Régulièrement,lesmassesmolairesdesélémentschimiquessontactualiséesparcequel'onconnaîtavecdeplusenplusdeprécisionl'abondancedesdifférentsisotopesd'unélémentdonné.Lamassemolaired'unélémentchimiqueestobtenueenfaisantlasommedesmassesmolairesdesdifférentsisotopesmultipliésparleurabondancerelative.γ-StabilitédesisotopesTouslesisotop esd'unélé mentchimiquenesontpasst ables.Onpeut retrouverlesstabilitésrelativesdesdifférentsisotopesd'unélémentàl'aidedudiagrammedeSegré.Certainsisotopessonttrèsstables,d'autresnelesontpasetdanscecas,leurduréedeviepeutvar ierdequelque sannées,jours,heu resàque lquesfractionsinfimesde seconde.Par exemple, dans notre organisme, le potassium-40, se désintègre et sa demi-vie est égale à 1,3 milliard d'années. Il se désintègre en donnant un atome de calcium-40.
Chapitre 5.1 - Elément et atome - Page 8 DL Surcediagramme,ontrouve:• Enabscisse:lenombreNdeneutrons• Enordonnée:lenuméroatomiqueZAutrediagramme,interactifenvousrendantsurlesiteindiqué:visiter http://www.nndc.bnl.gov/chart/Rem:EmilioGinoSegréSegréaobtenul ePrix NobeldePhysiqueen1959,encom pagniede Chamberlainpourleurdécouvertedel'antiproton.Enchimi e,Segréadécouvert letechnicium(Tc),avecPerrier,premierélémentartificiel,en1937,l'astate(At),avecCorsonetMacKenzie.c-Moleetmassemolaire
Chapitre 5.1 - Elément et atome - Page 9 DL Suivantlespropositionsentr'autresdel'IUPAC,ladéfinitiondelamolefutfinalementadoptéeparla14èmeCGPM(ConférenceGénéraledesPoidsetMesures1971,Résolution3;CR,7-etMetrologia,1972,-,36):1. Lamoleestlaquantitédematièred'unsystèmecontenantautantd'entitésélémentairesqu'ilyad'atomesdans0,012kilogrammedecarbone12;sonsymboleest"mol».2. Lorsqu'onemploielamole,lesentitésélémentairesdoiventêtrespécifiéesetpeuven têtredesatomes,desmo lécules,desi ons,deséle ctrons,d'autresparticulesoudesgroupementsspécifiésdetellesparticules.Ilenrésultequelamassemolaireducarbone12estégaleà0,012kilogrammeparmoleexactement,M(12C)=12g/mol.Lamolee stdéfiniec ommelenombre d'atomesdecarbonepré sentsdans1 2gdecarboneC-12.Cenombreestlenombred'Avogadro,oulaconstanted'Avogadro:NA=6,0221023mol-1Cettevaleurdunombred'AvogadroaétédéterminéeparPerrinparplusd'unedizainedeméthodesaudébutduXXèmesiècle.Pourcalculerlamassemolaired'unélémentchimique,l'ontientcomptebienentendudesonabondanceisotopique.d-Corpssimpleα-DéfinitionUncorpssimpleestuneespècechimiquenecomportantqu'unélémentchimique.Si,danslecorpssimple,lesatomesdel'élémentchimiquesontréunisenmolécules,onparlealorsdecorpssimplemoléculairecommedanslecasdudihydrogène(H2),dudiazote(N2),dudiiode(I2),del'ozone(O3).Danslecascontraire,parexemple,celuidesmétauxoudesgazmonoatomiques,ils'agitdecorpssimplesélémentaires:argent(Ag),cuivre(Cu),hélium(He),Krypton(Ar),etc...β-AllotropieL'allotropie(dugrecallosautreettroposmanière)estlafacultédecertainscorpssimplesd'existersousplusieursformescristallinesoumoléculairesdifférentes.Ainsi,parexemple,legraphite,lediamant,lesfullerènesou,découvertplusrécemmentlegraphène,sontlesvariétésallotropiquesducarboneausensoùcesontdifférentesformescris tallinesducorpssimplecorrespondant àl'éléme ntchimiquecarbon e.Le
Chapitre 5.1 - Elément et atome - Page 10 DL dioxygèneetletrioxygène(o uozone) sontéga lementdesvariétésallotropiques ducorpssimplecorrespondantàl'élémentchimiqueoxygène,maiscettefoisausensoùcesontdifférentesformesmoléculaires.Notonsquec'estBer zélliusquia introduitcette notiond'allotropie,etqu'ellefaitl'objetd'unlivreduchimisteNacquetdès1860:Chimiste,ethommepolitiquefrançais,néàCarpent rasen 1-34etmortàParisen1916.4.CationetAniond'unélémentchimique UnatomeX estélectriqu ementn eutre:sonnoya up ossèdeZprotons etlecortègeélectroniquepossèdedoncZélectrons. UnionXa+(respectivementXb-)estconstituéd'unnoyaupossédanttoujoursZprotonsetd'uncortègeélectroniquede(Z-a)électrons(respectivement:(Z+b)).IIDescriptiondel'étatd'unélectrondansunatomePourdécrirel'étatd'unélectrondansunatomedonné,lamécaniquequantiquemontrequelaconnaissancede4nombresappelésnombresquantiquesestnécessaire(chaquenombreétantliéàlaquantificationd'unegrandeurphysiqueprécise).Remarques:La quantique a vu le jour au début du vingtième siècle lorsque les physiciens durent s'avouer l'impossibilité de comprendre certains phénomènes, tel l'effet photoélectri que ou le rayonnement des atomes et leur consti tution, à l'aide des concept s de la m écanique dite depuis " classique ». Si cette mécanique, classique, forgée depuis le 17ème siècle, avait obtenu des succès considérables (mouvements des astres ou encore théorie électromagnétique), il n'était pas possible par e xemple de re ndre compte des observations e xpériment ales qui découlaient des investigations du domaine atomique. Alors, tout ceci va conduire les physiciens des années 1920 à d'abord abandonner quelques concepts, puis établir les bases d'une nouvelle théorie pour décrire les particules élémentaires, la mécanique quantique, ou, plus simplement, la quantique, qui va permettre une description cohérente des phénomènes à l'échelle atomique. La phase d'établissement de cette nouvelle théorie s'achèvera vers la fin des années 1920. Commence alors la phase de déploiement de
Chapitre 5.1 - Elément et atome - Page 11 DL cette théorie. Les anné es 1925 à 1928 sont les pl us riches de l'hi stoire de la mécanique quantique. A ce jour, aucun phénomène physique n'a pu ébranler ou remettre en cause les conceptions quantiques essentielles. 1.Quantificationdel'énergiedel'électron:lesdeuxnombresquantiquesnetlCettequantificationdel'énergiedel'électrondansl'atomerésultedel'observationdeplusieursfaitsexpérimentauxdudébutXXèmesiècle):travauxdePlancketEinsteinsurlerayonnementducorpsnoiretl'effetphotovoltaïque;observationsdespectresderaiesdesatomes,...a-Atomeàplusieursélectrons:touslesatomessaufHL'énergied'unélectrondans unatomenepeu tprendrequecertainesva leursprécises,encoreditediscrètes:cetteénergieestquantifiée,etcettedémonstrationdelaquantificationdel'énergiedel'électronapermisd'interpréterlesspectresderaiesdesatomes.Danstoutatomeautrequeceluid'hydrogène,l'énergiedel'électrondépenddedeuxnombresquantiques: n,nombrequantiqueprincipal:n∈N*:n=1,2,3,... l,nombrequantiquesecondaireouazimutal,entiertelque:0!l Chapitre 5.1 - Elément et atome - Page 12 DL nombrequantiquep rincipaletprendlaformedecelledel'atomeH,aufacteurZ2multiplicatifprès.Atomed'hydrogèneIonhydrogénoïdeChargedunoyau1.eZ.eEnergieEnduniveaun2 .Z2Exemplesdesystèmeshydrogénoïdes.C'estlecasdessystèmessuivants:!L'ionhydrogénoïdeHe+:noyaudecharge2.e(Z=2protons),etunseulélectron.!L'ionhydrogénoïdeLi2+:noyaudecharge3.e(Z=3protons)etunseulélectron.Danstoutautresystèmeàplusd'unélectron,onconsidèrequ'unélectrondonnéneperçoitpaslachargeZdunoyau,maisunechargeaffaiblieparlaprésencedesautresélectronsetquiestnot éeZeff.Zeffestappeléel achargenucléaireeffective ,etelle dépenddesdeuxnombresquantiquesnetl.2.Le3èmenombrequantiqueou nombrequantiquemagnétiqueml.Défini tiond'uneorbitaleatomique.Les2nombresprécédentsnesuffisentpaspourdécrirel'étatd'unélectrondansl'atome.a.Lenombrequantiquemagnétique,notémlIldécritlecomportementd'unélectrondansunchampmagnétique,c'estlenombrequantiquemagnétique,notéml,telque:Pourunevaleurdeldonnée,-l!ml!+lparpasde1b.Letriplet(n,l,ml):couche,sous-coucheetorbitaleatomique(OA)Chaquenombrencaractériseunecoucheélectroniqu e,repér éeparunelettremajuscule:n12345...DésignationdecoucheKLMNO...Chaquedoublet(n,l) caractériseunesous-coucheélectroniqu e,associéeàunniveaud'énergieE(n,l ).La valeurdelestainsi codifiée(codehéritédes spectroscopistes): Chapitre 5.1 - Elément et atome - Page 13 DL l01234...Désignationdelasous-couchessharppprincipald Chapitre 5.1 - Elément et atome - Page 14 DL Figure 2 : 1+3+5 = 9 = 3x3 OA N'ont PAS la même énergie dans tout autre atome que HPourconnaître l'étatd'unél ectronoccupantuneorbitale atomique,3nombresquantiquessontdoncnécessaires:• n∈N*,nombrequantiqueprincipal• l,nombrequantiquesecondaireouazimutal,entiertelque:0!l Chapitre 5.1 - Elément et atome - Page 15 DL Atomed'hydrogèneAutreatome3.Le4èmenombrequantiqueounombrequantiquemagnétiquedespinmsL'étatdel'électronesttotalementconnuenintroduisantlespindel'électron.Acespinélectronique,sontassociés2nouveauxnombresquantiques:• Lenombrequantiquedespin,notésetquivautpourtouslesélectronsdel'universs=+1/2.• Lenombrequantiquemagnétiquedespin,notéms,etquivautsoit+1/2,soit-1/2.Cesdeuxétatspossiblesdespinsontdésignésparleslettresαetβ,ouencoreparlesflèchesopposées"(spinup)et#(spin own).Cesontdoncautotal4nombresquantiquesquidécriventunélectrondansunatome(le5ème,s,estlemêmepouttouslesélectrons):Les4nomb resqua ntiquesn,l,mletmspermettentdeconn aîtrel'étatd'un électrondansunatome.1s2s3s4s2p3p4p3d4d4fEnergien=1n=2n=3n=4n=5n=61s2s3s4s2p3p4p3dEnergie Chapitre 5.1 - Elément et atome - Page 16 DL IIIConfigurationélectroniqued'unatome.Règlesàrespecter1.DéfinitionEcrirelaconfiguratio nélectroniqued'unatome,c'estpr éciserquel estleremplissagedesdifférentescouchesetsous-couches.Ceremplissageobéitàquelquesrèglesetprincipesénoncésci-dessous.2.Règlesetprincipesàrespectera.Leprinciped'exclusiondePauli(1925)"Dansunatome polyélectronique,deuxélectronsnepeuventpasavoirleurs4nom bresquantiquesidentiques».WolfgangPauli(1900-195-),physici ensuissed'origineautrichi enne,professeuràl'Ins titutFédéraldeTechnologie(ETH)deZurichetàl'InstitutofAdvancedStudyPrinceton.Ilénonceleprinciped'exclusionqui portesonnom,émetl'hypothèse duneutrino, quiapparaîtdans ladésintégrationβ.PrixNobeldephysiqueen1945.Conséquencesdeceprincipe: Uneorbitaleatomiquenepeutcontenirauplusquedeuxélectrons,quidiffèrentalorsparleurnombredespin. Sideuxélectronsontlemêmenombredespin,ilsnepeuventpasoccuperunemêmeorbitaleatomique. Lacouchenestremplieavec2n2autotal. Chapitre 5.1 - Elément et atome - Page 17 DL b.Larègle(empirique)deKlechkowskiDansunatomedonné,l'énergied'uneorbitaleatomiqueestunefonctioncroissantedelasomme(n+l);à(n+l)donné,l'énergieestunefonctioncroissanteden.Attention,cetterèglesoufredenombreusesexceptions,deplusenplusnombreuseslorsqueZcroît.Iln'estpasnécessairedeconnaîtrecesexceptions,maisilpeutparfoisêtrepossibledelesinterpréter"assezfacilement».QuelquesexceptionsàlarègledeKlechkowskiàconnaître,commepourlesatomesCr,Cu,AgouencoreAu.Onpeutretrouverl'ordrederemplissagedessous-couchesparénergiecroissanteavecunpetitdiagrammecommeceluiquisuit:ln0123477s7p7d7f7g66s6p6d6f6g55s5p5d5f5g44s4p4d4f33s3p3d22s2p11sAinsi,l'ordrederemplissagedesdifférentesOAestlesuivant:1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f6d7pn+l=12345678 Chapitre 5.1 - Elément et atome - Page 18 DL c.LarègledeHundLorsquelesélectronsp euplentles orbitalesatomiquesd'unniveaud'énergiedégénéré,lastabilitémaximaleestatteinteenplaçantlemaximumd'électronsseulsdanschaqueorbitaleetdanslemêmeétatdespin Multiplicitédespinmaximale "Lesélectronstendentàrestercélibataires.» "mêmeétatdespin»=mêmevaleurdems.Ex mpl :occupation uf r(Z=26)3.Configurationélectroniqued'unatome.Principed'Aufbau,oudeconstruction:"Aufbauprinzip».Laconfi gurationélectroniquefondamentaled'unat omeestcellequiminimisesonénergie.ElleestobtenueenrespectantlesrèglesprécédentesetenremplissantlesOAparvaleurd'énergiecroissante.L'étatfondamentaldel'atomeestceluid'énergieminimale:touslesautresétatsoùl'électronsrestenttousliésaunoyausontdesétatsexcités.Rem:siunatomeperdunélectron,ilestdansunétationiséLeprin ciped'écritured'unecon figurationélectroniquerep osesurlesrèglesprécédentes,etporteaussilenomde"principed'Aufbau».Att ntion,carilyaplusi ursanomali s t sconfigurationss mblantanormal s.4.Electronsdecoeuretélectronsdevalencea.DéfinitionLesélectron squisontmisenjeudansles réactions chimiquesquiimp liquent unélémentchimiquesont lesélectronsdevalenc e.Ilestdonc importantde savoirlesrepérerdanslaconfigurationélectroniqued'unatomedonné.l"="2 Chapitre 5.1 - Elément et atome - Page 19 DL Lesélectronsdevalenced'unatomesontlesplusexternes.Cesontlesélectronsdenombrequantiqueprincipalnleplusélevéetceuxdessous-couches(n-1)dou(n-2)fencoursderemplissage.Cesontcesseulsélectronsdevalencequisontresponsablesdepropriétéschimiquesdel'élémentetcesonteuxqu isontd oncmisen jeudansl'ét ablissementd esliaisons chimiques.Lesautresélectrons,fortementliésaunoyausonteuxappelés"électronsdecoeur».b.CasdesionsSoitXl'élémentdenuméroatomiqueZ.CationXp+:onremplitlesOAenrespectantlesmêmesrèglespouryplacer(Z-p)électrons.AnionXq-:onremplitlesOAenrespectantlesmêmesrèglespouryplacer(Z+q)électrons.c.ExemplesLaconfig urationélectroniquefondamentaled'unat omeestcellequiminimisesonénergie.ElleestobtenueenrespectantlesrèglesprécédentesetenremplissantlesOA.d.Prévisiondelaformuledesionsmonoatomiquesd'unélémentdonnéNousreverronsunp eup lusloinl econceptd'électronéga tivitéétudiéenclassedepremière.Utilisons-letelquevousl'avezvujusqu'àaujourd'hui.Dansl'atomeAd'unélémentdonné,lesélectronsquisontmisenjeudanslesréactionssontlesélectronsdevalence.Supposonsqu'ilenaitp.Alors,ilyadeuxsituations:• SoitAestliéàun atomeBplu sélec tronégati fquelui :al orsilcèdesesp électronsdevalence.ApassesoussaformecationiqueAp+.• SoitAes tliéàun atomeBmoins électr onégatif quelui :al orsilcaptel esélectronssuffisantspourqu'il réaliseunoctetd'él ectronsde valence.OnretrouveraAsouslaformeanioniqueA(--p)-. Chapitre 5.1 - Elément et atome - Page 20 DL IVInteractionsmatière-rayonnementL'analysedelalumièrequies tabsorbé eouémise paruncorpss'appe llela"spectroscopie».La spectroscopieajoué,etjoue toujours,unrôle centraldansl'analysedesélémentsmicroscopiquesquiconstituentunobjet.caractèreondulatoiredelalumièreLesdifférentesrégionsduspectreélectromagnétique.Isoléendessous:domainedelalumièrevisible.Lalumièreestunrayonnementélectromagnétiquequipeutêtredécritparuneondelongueurd'ondeλetunefréquenceν,tellesqueλ=c/νoùcestlavitessedelalumièredanslevide.Lalumièrepeutêtreaussidécritepardesphotonsquitransportechacununecertainequantitéd'énergie,onparledequantumd'énergie,etcetteénergieEest proportionnelleàlaf réquenceνdelalumi ère:E =h.ν.hest uneconstantefondamentale,c'estlaconstantedePlanck.Dansnotreviequotidienne,noussommesrégulièrementconfrontésauxinteractionsentrematièreetrayonnement:• Onparlede"ferchaufféaurouge»ou"chaufféàblanc»• Oneffectuedesradiographies.Danschaquecas,lerayonnementpeutêtresoitémis,soitabsorbé.Enchimie, "réalis runsp ctr »cons isteàmesurerl'absorption oul' émissiond'unrayonnementdelongueurd'ondedonnéparuncorps. Chapitre 5.1 - Elément et atome - Page 21 DL Ilexistedeuxgra ndstypesdespectres :les spectrescontinusetlesspectresdiscontinus:• Surunspectrecontinu,lecorpsémetunrayonnementcontinudanslazonedelongueurd'ondeconsidérée(commeparexemplelalumièrenaturelle).• Surunspectrediscontinu,onobserveradesraiesindiquantqueseulescertaineslongueursd'ondesontémisesparlecorps étudié. Parexemple,leso diumvaémettredanslejaune-orangélorsdeladésexcitationd'undesesélectrons.Cettelumièreestcelleémise parlesla mpesécla irantlesruesetles tunnels parexemple,ouencoreparlalampeàvapeurdesodiumdupolarimètredeLaurent.Danslasuitedenotrecours,nousrestreindronsnotreétudeàlalumièreforméedephotonsdefaible énergie,c'estàd ireàl'étudedurayonnementradio-fréquencejusqu'auprocheUV.Danscechapitreprécisément,iln'yaquelesradiationsdudomainevisibleetUVquisontmisesenjeu.Noustraiterons lamatièreetlalumièreaunive audesph énomènesmicroscopique sdoncquantiques.1.AbsorptionetémissionNoussavonsdéjàque:• Danstoutatome,l'énergiedesélectronsestquantifiée.Ellenepeutprendrequecertainesvaleurs,quisontparailleursnégatives.• L'électron"nerayonne pas»lorsqu'ilestdansunétatst ationnaire, maisuniquementlorsqu'ilsauted'unétatstationnaireàunautredontl'énergieestplusfaible.Ilémetalorsunrayonnementdontlafréquenceestcaractéristiquedel'atome.L'électronnepeuts'éloignerindéfinimentdunoyaudel'atome:onditquelesétatsstationnairesdel'électronsontdesétatsliés.L'absorptiond'unphotond'énergieΔΕ=h.ν=h.c/λcorrespondaupassagedel'atomedesonétatfondamentalàundesesétatsexcités.L'étatfondamentald'unatomeestl'étatstable:c'estceluid'énergieminimale.Sousl'actiond'uneperturbation,l'atomepeutquittercetétatstablepourêtreportéàunétatexcité.Ilyresteratrèspeudetempsavantderetourne rspontan émentàl'étatfondamental.On appelle"transition" cetteévolutionaucoursdelaquellel'atomepassed'unétatàunautreétat(étatfondamentaletétatsexcités).• Unetransitionélectroniquecorrespondaupassaged'unétat,ouconfigurationélectroniqueparticulièreàunnouvelétat,ounouvelleconfigurationélectronique.C'estaucoursd'unetransitionqu'unphotonestémisouabsorbé.• Dansunspectre d'émissi on,ono bservele passagedel'atomed'un niveau d'énergieEpversunniveaud'énergieEnplusfaible;unphotond'énergieεestémisaucoursdecettedésexcitation: • Dansunspectred'absorption,c'estlepassaged'unétatd'énergieinférieureversunétatd'énergiesupérieurequisetraduiraparuneraieàlalongueurd'ondeλtelleque:np Seulslesphotonsayantuneénergieexactementégaleàladifférenced'énergieentredeuxniveauxdel'atomepourrontêtreabsorbés,ouémis:Ep Chapitre 5.1 - Elément et atome - Page 23 DL Spe tre 'émission el'hy rogènegazeuxobtenu anslarégion uvisibleet el'UVpro heSpe tre 'émission el'hy rogènegazeuxobtenu anslarégion uvisibleWollastonetFraunhofe rontbe aucouptravaillésurcesspectrescar actéris tiquesdechaqueatome(Fraunho feraétudiéle spectred'émissionduso leildès1-14).Lesspectressontgénéralementcompliqués,maislesuisseBalmeretlesuédoisRydbergontdécouvert"uncodemystérieux" quirégissa itl'allurede cesspectres.Unesériearithmétiquepermetd'engendrer,fréq uenceaprèsfréquence,l 'ensembleduspectred'unélément.En1--5(annéedenaissancedeBohr,le7octobre),Balmer(1-25-1-9-),instituteurbâloisférudenuméro logie,étudial esraies duspectred'émissiondel'atomed'hydrogènesituéesdanslevisible,etremarqua,ennotanttoujoursνlesfréquences,quel'onavait:] σestappelé" nombred'onde":ils 'exprimee nm-1danslesystème S.I;RHestlaconstantedeproportionnalitédéterminéealorsexpérimentalement,appeléeconstantedeRydberg,etquivaut:RH=1,0967757.107m-1soit109677cm-1.JohannesRYDBERG1 Chapitre 5.1 - Elément et atome - Page 24 DL lesraiesduspectredel'atomed'hydrogèneengénéralisantlaformuledeBalmer.Ensuite,en190-,Ritzgénéralisalaformuleprécédenteàtouslesatomes,souslaforme:p,n Danscesdeuxexpressions,netp∈N*etn3p3dniveau"d'énergie"n"="3E"="613,6"/"3
2 3p3dniveau"d'énergie"de"la"
sous"couche"3s l"="0 3sniveau"d'énergie"de"la"
sous"couche"3p niveau"d'énergie"de"la" sous"couche"3d E h. h E - E ν
EMISSION : elle
correspond ‡ la dÈsexcitation de l'atome photonÈmis Ep En E E Ep En ABSORPTION :
elle correspo nd ‡ l'exc itation de l'atome E Ep En E Èlectron
photonabsorbÈ 2.Spectred'émissiondel'atomed'hydrogène:l'atomeestdémasqué!Reprenonslecasdenotreatomed'hydrogène:Lespectred'émissiondel'atomed'hydrogèneestobtenuensoumettantduhydrogène,gazeux,sousfaiblepression,àunedéchargeélectrique,dansuntubedeGeissler.Lesmoléculesdedihydrogèneso ntdisso ciéesenhydrogèneatomique.Enanal ysantlerayonnementémisparcethydrogèneatomique,onobserveunspectreconstituéde4raiesdansledomaineduvisible.Lespectrenecomportantquequelquesraiesestun"spectrediscontinu",ou"spectrederaies".Pourlesoleil parexemp le,desraiescorres pondantcette foisàl'abs orptionfurentobservéesdès1-14parFraunhofer.L'atomed'hydrogène,leplusléger,alespectreleplussimple.
/ 109 680[ - ] 4 p LaconstanteportelenomduspectroscopisteJohannesRydbergquiaexpliquétoutes
Atome 111
R[ - ]
n p ésormaisl'atom , tc quip rm t
écrir sonétat.Décrivonsmaint nantlacl assificationpério iqu sélém nts ns basan tsurl sconfigurationsél ctroniqu s satom s... Lyman 1906-1014 n=1
n = infini n =1 n = 2 n = 3 n = 4 n = 5 Energie
Nom de différentes séries Balmer
1885 n=2
Paschen
1908 n=3
Brakett
1922 n=4
Pfund 1924 n=5
n = 6 Humphreys
1953 n=6
Les autres séries nont pas de nom
quotesdbs_dbs12.pdfusesText_18
[PDF] reséau informatique ppt
[PDF] reséau informatique cours complet pdf
[PDF] reséau informatique cours ppt
[PDF] projet maintenance informatique pdf
[PDF] les droites ab et cd sont elles parallèles vecteurs
[PDF] exercice calculer les coordonnées du milieu d un segment
[PDF] exercices corrigés de stéréoisomérie
[PDF] exercices corrigés en stéreochimie
[PDF] projection de newman exercices corrigés
[PDF] cisco 8851 mode d'emploi
[PDF] comment configurer un telephone ip
[PDF] configuration telephone ip cisco pdf
[PDF] configuration telephone ip packet tracer
[PDF] confiture mirabelle
