 BPF PARTIE III : SYSTEME QUALITE PHARMACEUTIQUE (ICH Q10)
BPF PARTIE III : SYSTEME QUALITE PHARMACEUTIQUE (ICH Q10)
Ce document établit une nouvelle ligne directrice tripartite ICH qui décrit un modèle de système de management de la qualité efficace pour l'industrie
 Q3D : Directive concernant les impuretés élémentaires
Q3D : Directive concernant les impuretés élémentaires
29 janv. 2016 ... ICH. Ce processus aboutira à la modification ou si les révisions à ... Getting to the bottom of arsenic standards and guidelines. Environ ...
 PARTIE III : GESTION DU RISQUE QUALITÉ (ICH Q9)
PARTIE III : GESTION DU RISQUE QUALITÉ (ICH Q9)
ICH Q8 Développement pharmaceutique. ISO/IEC Guide 73:2002 – Gestion du Guidelines for Failure Modes and Effects Analysis (FMEA) for Medical Devices ...
 Ladoption pour lICH ligne directrice: Q3A(R2): Présence d
Ladoption pour lICH ligne directrice: Q3A(R2): Présence d
5 juin 2015 also available in English under the following Title: Guidance Document: International ... Human Use (ICH) Impurities in New Drug Substances; ICH ...
 LES ICH ET LA RÉGLEMENTATION PHARMACEUTIQUE LA
LES ICH ET LA RÉGLEMENTATION PHARMACEUTIQUE LA
13 mai 2017 L'application des guidelines ICH pour toutes les évaluations techniques. ... la SFSTP (Société Française des Sciences et des Techniques ...
 ICH Topic Q 6 B Specifications: Test Procedures and Acceptance
ICH Topic Q 6 B Specifications: Test Procedures and Acceptance
TEST PROCEDURES AND ACCEPTANCE CRITERIA FOR. BIOTECHNOLOGICAL/BIOLOGICAL PRODUCTS. ICH Harmonised Tripartite Guideline. Table of Contents. Page.
 GUIDE RELATIF A LA BIOEQUIVALENCE DES MEDICAMENTS A
GUIDE RELATIF A LA BIOEQUIVALENCE DES MEDICAMENTS A
12 janv. 2018 - Les guidelines CPMP : 'Guideline On The Investigation Of Bioequivalence'. - Les guidelines ICH M4 intitulées 'Organisation Of The Common ...
 ICH Topic Q 1 A (R2) Stability Testing of new Drug Substances and
ICH Topic Q 1 A (R2) Stability Testing of new Drug Substances and
The texts on test procedures etc. have been brought in line with the Q6A guideline. Relevant cross-references to other ICH guidelines have been introduced. •
 Guide bonnes pratiques de fabrication
Guide bonnes pratiques de fabrication
6 mai 2019 ... Guidelines for Failure Modes and Effects Analysis (FMEA) for Medical ... ICH Q9. Les outils de gestion du risque de la qualité tels que ceux ...
 BPF PARTIE III : SYSTEME QUALITE PHARMACEUTIQUE (ICH Q10)
BPF PARTIE III : SYSTEME QUALITE PHARMACEUTIQUE (ICH Q10)
Ce document établit une nouvelle ligne directrice tripartite ICH qui décrit un modèle de système de management de la qualité efficace pour l'industrie
 DICH Q8 à Q10: la maîtrise des changements dans un système de
DICH Q8 à Q10: la maîtrise des changements dans un système de
19 jan. 2015 recherche français ou étrangers des laboratoires ... Les GMP Guidelines
 addenda intégré de le6(r1) de lich : ligne directrice pour de bonnes
addenda intégré de le6(r1) de lich : ligne directrice pour de bonnes
Ces lignes directrices devraient être lues en parallèle avec d'autres directives de l'ICH concernant la réalisation d'essais cliniques [par exemple E2A (
 LES ICH ET LA RÉGLEMENTATION PHARMACEUTIQUE LA
LES ICH ET LA RÉGLEMENTATION PHARMACEUTIQUE LA
13 mai 2017 L'application des guidelines ICH pour toutes les évaluations techniques. ... la SFSTP (Société Française des Sciences et des Techniques ...
 ICH Topic Q 1 A (R2) Stability Testing of new Drug Substances and
ICH Topic Q 1 A (R2) Stability Testing of new Drug Substances and
The texts on test procedures etc. have been brought in line with the Q6A guideline. Relevant cross-references to other ICH guidelines have been introduced. •
 PARTIE III : GESTION DU RISQUE QUALITÉ (ICH Q9)
PARTIE III : GESTION DU RISQUE QUALITÉ (ICH Q9)
Guidelines for Failure Modes and Effects Analysis (FMEA) for Medical Devices 2003 Dyadem. Press
 ICH Topic Q 6 B Specifications: Test Procedures and Acceptance
ICH Topic Q 6 B Specifications: Test Procedures and Acceptance
SPECIFICATIONS: TEST PROCEDURES AND ACCEPTANCE CRITERIA FOR. BIOTECHNOLOGICAL/BIOLOGICAL PRODUCTS. ICH Harmonised Tripartite Guideline. Table of Contents.
 Q3C (R8) Step 5 - impurities: guideline for residual solvents
Q3C (R8) Step 5 - impurities: guideline for residual solvents
20 mai 2021 ICH Guideline Residual Solvents. Pharmeuropa. 1997;Suppl 9:57. 2. Tyl RW France KA
 Ladoption pour lICH ligne directrice: Q3A(R2): Présence d
Ladoption pour lICH ligne directrice: Q3A(R2): Présence d
5 jui. 2015 Requirements for the Registration of Pharmaceuticals for. Human Use (l'ICH): Présence d'impuretés dans les nouvelles.
 La réglementation pharmaceutique et les dossiers dautorisation de
La réglementation pharmaceutique et les dossiers dautorisation de
14 mar. 2018 recherche français ou étrangers des laboratoires ... parties ainsi que les références aux guidelines ICH ou ASEAN qui doivent être suivies.
 E6(R2): Addenda intégré de bonnes pratiques cliniques - ICH GCP
E6(R2): Addenda intégré de bonnes pratiques cliniques - ICH GCP
En adoptant cette ligne directrice de l’ICH Santé Canada fait siens les principes et les pratiques qui y sont énoncés Ce document doit être lu en parallèle avec la lettre d’accompagnement et les sections pertinentes des autres lignes directrices applicables à Santé Canada
 PARTIE III : GESTION DU RISQUE QUALITÉ (ICH Q9) - AFMPS
PARTIE III : GESTION DU RISQUE QUALITÉ (ICH Q9) - AFMPS
Il sert de base ou de document ressource indépendamment des autres documents qualité ICH tout en les étayant et complète les pratiques exigences normes et lignes directrices qualité en vigueur dans l’industrie pharmaceutique et dans le domaine réglementaire
 BPF PARTIE III : SYSTEME QUALITE PHARMACEUTIQUE (ICH Q10) - AFMPS
BPF PARTIE III : SYSTEME QUALITE PHARMACEUTIQUE (ICH Q10) - AFMPS
de mettre en œuvre l’ICH Q10 avec succès et de manière efficace Ces facilitateurs favoriseront la réalisation des objectifs décrits en section 1 5 en apportant les moyens nécessaires aux décisions basées sur les risques et les sciences et qui concernent la qualité des produits
 Q12 Annexes - ICH
Q12 Annexes - ICH
ICH HARMONISED GUIDELINE TECHNICAL AND REGULATORY CONSIDERATIONS FOR PHARMACEUTICAL PRODUCT LIFECYCLE MANAGEMENT Q12 Annexes Final version Adopted on 20 November 2019 This document has been developed by the appropriate ICH Expert Working Group and has been subject to consultation by the regulatory parties in accordance with the ICH Process
 IMPURITIES GUIDELINE FOR RESIDUAL S Q3C(R8) - ICH
IMPURITIES GUIDELINE FOR RESIDUAL S Q3C(R8) - ICH
ICH HARMONISED GUIDELINE IMPURITIES: GUIDELINE FORRESIDUAL SOLVENTS Q3C(R8) Current Step 4 version dated 22 April 2021 This Guideline has been developed by the appropriate ICH Expert Working Group and has been subject to consultation by the regulatory parties in accordance with the ICH Process
 E6: Les bonnes pratiques cliniques: Directives consolidées
E6: Les bonnes pratiques cliniques: Directives consolidées
Ligne directrice de l’ICH1 E6: Les bonnes pratiques cliniques: directives consolidées ERRATUM en Anglais et Français Les versions finales anglaise et française de la ligne directrice de l’ ICH adopté par Santé Canada: Les bonnes pratiques cliniques ont été revisées dûs à des corrections éditoriales post-étape 4 par le comité
 Q12 - ICH
Q12 - ICH
The concepts outlined in prior ICH Quality Guidelines (ICH Q8 Q9 Q10 and Q11) provide opportunities for science and risk-based approaches for drug development and risk-based regulatory decisions These guidelines are valuable in the assessment of Chemistry Manufacturing and Controls (CMC) changes across the product lifecycle
 Q8(R2) - ICH
Q8(R2) - ICH
ICH HARMONISED TRIPARTITE GUIDELINE PHARMACEUTICAL DEVELOPMENT Q8(R2) Current Step 4version dated August 2009 This Guideline has been developed by the appropriate ICH Expert Working Group and has been subject to consultation by the regulatory parties in accordance with the ICH Process
 Q1A(R2) - ICH
Q1A(R2) - ICH
This Guideline has been developed by the appropriate ICH Expert Working Group and has been subject to consultation by the regulatory parties in accordance with the ICH Process At Step 4 of the Process the final draft is recommended for adoption to the regulatory bodies of the European Union Japan and USA Q1A(R2) Document History
 Q3D(R1) - ICH
Q3D(R1) - ICH
ICH HARMONISED GUIDELINE GUIDELINE FOR ELEMENTAL IMPURITIES Q3D(R1) Finalversion Adopted on 22 March 2019 This Guideline has been developed by the appropriate ICH Expert Working Group and has been subject to consultation by the regulatory parties in accordance with the ICH Process
 ICH guideline Q2(R2) on validation of analytical procedures
ICH guideline Q2(R2) on validation of analytical procedures
ICH Q2(R2) Guideline 1 1 1 INTRODUCTION 2 This guideline presents a discussion of elements for consideration during the validation of 3 analytical procedures included as part of registration applications submitted within the ICH 4 member regulatory authorities Q2(R2) provides guidance and recommendations on how to 5
 ICH guideline Q9 (R1) on quality risk management
ICH guideline Q9 (R1) on quality risk management
At Step 2 of the ICH Process a consensus draft text or guideline agreed by the appropriate ICH Expert Working Group is transmitted by the ICH Assembly to the regulatory authorities of the ICH regions for internal and external consultation according to national or regional procedures
 Searches related to guidelines ich en français filetype:pdf
Searches related to guidelines ich en français filetype:pdf
Past regular attendance in ICH meetings Past appointment of experts in WGs Application of ICH Guidelines Have implemented at least the following ICH Guidelines (“Tier 1”): Q1: Stability Testing Guidelines Q7: Good Manufacturing Practice Guide for Active Pharmaceutical Ingredients E6: Good Clinical Practice Guideline
34.3ICHQ8"PharmaceuticalDevelopment"......................................................................205ICHQ9:lagestiondurisquequalité............................................................................245.1Définitions.....................................................................................................................245.1.1Lerisque.................................................................................................................245.1.2L'analysederisque.................................................................................................245.2Objectifs........................................................................................................................245.3Lesréférentiels.............................................................................................................255.3.1NormeISO31000:2009" Managementdurisque-Principesetlignesdirectrices"........................................................................................................................255.3.2ICHQ9"QualityRiskManagement".....................................................................265.4Lesoutilsqualitépermettantd'optimiserl'analysederisque......................................285.4.1Brainstorming.........................................................................................................295.4.2QQOQCP.................................................................................................................295.4.3Méthode5M-LeDiagrammed'Ishikawa..............................................................295.4.4LediagrammedePareto........................................................................................305.5LesoutilsdemanagementdurisqueQualité...............................................................325.5.1L'AnalysePréliminairedesRisques:APR...............................................................325.5.2AMDECAnalysedesModesdeDéfaillance,deleurEffetsetdeleurCriticité.Outild'AméliorationContinue....................................................................................................335.5.3Evaluationglobaledesrisquesrésiduels................................................................355.5.4Analysedesrisquesetdel'exploitabilité(HAZOP).................................................355.5.5Analysedesdangersetpointscritiquespourleurmaîtrise(HACCP).....................375.5.6L'arbrededéfaillance(FTA=FaultTreeAnalysis)..................................................395.6ICHQ10"PharmaceuticalQualitySystem"(PQS).......................................................41Partie2:MaîtrisedeschangementsouChangeControl....................................................431Définitions..................................................................................................................43
8IntroductionL'activitéd'unétablissementpharmaceutique,estencadréeparuncontexteréglementairespécifique.Desexigencesstrictesdoiventêtreappliquéestoutaulongducycledeviedumédicamentafindegarantirlaqualitédesmédicamentsmissurlemarchéetlasécuritédespatients.Ilconvientdoncpourlesindustriespharmaceutiquesdemettreenplaceunsystèmegestiondelaqualitéperformantetprécis,permettentdegarantirlamaîtrisedechacunedesesactivités.Maispourassurersapérennité,l'entreprisedoiteffectuerdeschangements,aussibienauniveaudesonorganisationproprequ'auniveaudesprocédésdefabrication(remplacementsd'équipementparexemple)etdumédicamentlui-même(changementd'uneméthodedecontrôleparexemple).Lesactivitésdel'entreprise,enplaceouàentreprendre,comportentunepartderisqueetd'incertitude.Pour quel'entrepris esoitperfo rmanteets'inscrivedansunedémarched'améliorationcontinue,ilestimpératifd'avoiruneconnaissanceparfaitedesprocédésetdemaîtriserlesrisquesassociéspourpouvoirlespréveniretlescorrigeràleursource.Demême,avantdemettreenplaceunchangement,ilestindispensabled'évaluerlesimpactsqueceux-cipeuventavoirsurlaqualitédumédicament.Pourprendreencomptecesmodifications,lesentreprisesmettentenplaceunsystème degestio n,appeléchangecontrol.Ilfait partieintégrantedusystèmed'assurancedelaqualitéetconstitueuneexigenceréglementaire.Dansunpremiertemps,cettethèseaurapourobjectifdedéfinirlanotiondequalitéauseind'uneindustriepharmaceutique,d'établirquelsensontlesenjeuxetd'effectuerunétatdeslieuxdesexig encesréglementairesquis'yappliquent.Aprèsavoirprésen télesdirecti vesadaptéesauxindustriespharmaceutiques,notammentàtraverslesICHQ8,Q9etQ10,lesélémentsindispensablespourassurerlapérennitéd'uneentrepriseserontdétaillés.Parmicesoutils,l'analysederi squeestuncomposantclédusystèmeq ualitéetdel 'améliorationcontinue.Dansunesecondepartie,lesystèmedegestiondesmodifications,inscritdanslesystèmedegestionetdemaîtrisedelaqualité,seraprésenté.L'objectifserad'expliquersondomained'applicationsurunsitedeproductionpharmaceutique.Lesdifférentesétapesetlesacteursparticipantauprocessusseronténumérés,ainsiquelesoutilsdegestionutilisés.Nousverronsenfinl'intérêtd'unsystèmeinformatisédanslagestiondesmodifications.
9Partie1:LagestiondelaQualitéetdelaconformitépharmaceutiquedeslaboratoirespharmaceutiquesL'industriepharmaceutiqueestsoumiseàdescon diti onsrégleme ntairesprécisesquipermettentdegarantirlasécuritédesmédicaments.Depuisdenombreusesannéesetafindes'adapteraumarché,laprofessionpharmaceutiques'estengagéedansunedémarchequalitépermettantdeconcilierexigencesdequalité,productivitéetmaîtrisedescoûts.1 Définition1.1 LaQualitéLaQualitéest"l'aptituded'unensembledecaractéristiquesintrinsèquesàunproduit,unsystèmeouunprocessusàsatisfairedesexigences.(ICHQ9)"OnretrouvecetteapprochedanslacertificationdelanormeISO9000-2000§3.1.1.Ellecorrespondglobalementàl'ensembledesactionsmisesenplaceparuneentreprisepouratteindresesobjectifsafindesatisfaireleclient.Danslapratique,laqualitésedéclinesousdeuxformes: Laqualitéexterne:c'estlorsqu'unproduitouservicerépondparfaitementauxbesoinsetattentesdesclients. Laquali téinterne:C'estl amaîtriseetl'amélioratio nduf onctionnementde l'entreprise.Lesbénéficiairesensontl adirection,leperso nnelde l'entreprise,lesactionnaires...etbiensûrlesclients.[1]Ilestdoncdifficiledefairedelaqualitéexternesansfairedequalitéinterne.1.2 Qu'est-cequ'unclient?Dansledictionnairefrançais,unclientestunepersonnequireçoitd'uneentreprise,contrepaiement,desfourniturescommercialesoudesservices.[2]
10D'unemanièreplus globale,leclie ntestledestinatai red'unproduitproposéparlefournisseur.Ilpeutêtreinterneouexterneàl'entreprise.1.2.1 Clientexterneàl'entrepriseUnorganismepeutfaireappelàunfournisseurpoursatisfairesonclient.Letermeclientestalorsutiliséàla foispourlarelationC lie nt/Organ ismeetpour larelationOrganisme/Fournisseuroùlepremierjouelerôleduclient.Figure1:2typesderelationClient-Fournisseur1.2.2 Clientinterneàl'entrepriseDansl'industriepharmaceutique,lesinteractionssontmultiplesetcomplexes.C'estpourquoiilestconseillédedécomposerl'activitéensous-divisionsplusfacilementcontrôlables.Celapermetégalementdedécloisonnerl'entrepriseetd'améliorerlacommunication.Cessous-divisionssontcommunémentappelées"processus"etrepr ésententl'ensembledesressourcesetdesactivitésliéesquitransformentdesélémentsentrantsenélémentssortants.[3]Lecycledumédicamentenindustriepharmaceutiqueestalorsunesuccessiondeprocessusimbriquéslesunsdanslesautres.Lesdifférentsservicesdel'entreprisedeviennentclientsetfournisseurslesunsetdesautres.Lamaî trisedecetteapp rocheproce ssuspermetdesatisfairelesbesoin sexplicitesetimplicites desclientsdechacun desprocessus.Elleestessentiellepourgarantirlaqualitédumédicamentetlasécuritédupatient.CLIENTORGANISMEFOURNISSEURBesoinàsatisfaireBesoinàsatisfaireFournitured'unproduitouservicerépondantauxbesoinsFournitured'unproduitouservicerépondantauxbesoinsRelationdetype1Relationdetype2
11Afind'assurerlapérennitédelaqualité,ilestimportantdemettreenplaceunsystèmequalitéetrechercherenpermanenceàs'améliorer."C'estréfléchirpourneplussubir.C'estanticiper".[4]1.3 UnsystèmeQualitéD'aprèsl'ISO9001etl'ICHQ10,unsystèmeQualitéestunmodèledesystèmeefficacedemanagementdelaqualitépourl'industriepharmaceutique.Figure2:Modèled'unsystèmedemanagementdelaqualitébasésurdesprocessusUnsystèmedemanagementdelaqualité(SMQ)définitetfixelapolitiqueetlesobjectifsqualitéd'uneorgani sation.Pouratteindrecesobjecti fs,ilestimportan tdesuivreuneméthodedegestiondelaqualité,comm elaméthodePDCAourouedeDeming .Elle sedérouleen4étapesetdoitpermettred'évoluerversunedémarched'améliorationcontinue.1) Plan:Préparer,planifier(cequel'onvaréaliser)2) Do:Développer,réaliser,mettreenoeuvre(leplussouvent,oncommenceparunephasedetest)
123) Check:Contrôler,vérifier4) Act(ouAdjust):Agir,ajuster,réagir(sionatestéàl'étapeDo,ondéploielorsdelaphaseAct)Parsonbonfonctionnement,unSMQassure: L'applicationsansfailledesméthodesétablies, Lamise enoeuvredeprocéduresetd'instructionspertinentesnécessaires pouratteindrelesbutsvisés,impliquantunemaîtrisedusystèmedocumentaire, Lerepéragedesproblèmesetleurrésolution, Laré visionetl'améliorationcontin uedes méthodes,produitsetservicesparl'identification,l'évaluationetlecontrôledesrisquesQualité. UnetraçabilitédesactionseffectuéesLamiseenplaced'unsystèmequalitédansuneentrepriseresteunmoyentrèsefficacepoursedémarqueretrenforcersacompétitivité.2 LesenjeuxdelaQualitéLeslaboratoire spharmaceutiquessontrégispard euxtypesd'exigences:les exigencesréglementaires/pharmaceutiquesquidéfinissentlesconditionsdefabricationsprécisesetlesexigencesattenduesparleclient/patient.L'objectifd'unlaboratoireestdoncdesatisfairelesbesoinsexprimésparleclient,autraversdelaréalisationduproduitouservice,conformeauxspécifications.(Spécification:documentprécisantclairementlescaractéristiquesduproduitauxdifférentesétapesdesonélaboration).Figure3:Adéquationentrelesexigencesclients/entrepriseClientQualitéperçueQualitéattendueEntrepriseQualitéréaliséeQualitéprogrammée
132.1 EnjeuxstratégiquesLaqualitépourleclientdépenddesesattentesetdelaperceptionqu'iladuproduit.Orilpeutarriverpendantlaproductionqu'ilyaitdesaléasquiinterfèrentsurlaqualitédéfinieinitialement.Sil'entrepriseanticipelesattentesduclientetaméliorelaqualitédeconception,laqualitéperçueparleclientnepourraqu'êtresupérieureàsesattentesetleclientserasatisfait.Cettenotiondesatisfactionentraînelanotiondefidélisationduclient.Ainsil'améliorationdelaqualitédeconceptionconduitàl'améliorationdelaqualitéperçue,etdecefait,àunepartdemarchéplusimportante.2.2 EnjeuxéconomiquesLaqualitéestcouteusepourl'entreprisemaisl'absencedequalitéestd'autantplusonéreuse.Eneffet,ils'avèregénéralementpluscoûteuxdecorrigerlesdéfautsouleserreursquedebienfairedupremiercoup.Enoutre,lecoûtdelanon-qualitéestd'autantplusimportantqu'elleestdétectéetardivement[1].L'améliorationdelaqualitédefabricationpermetdeproduireàuncoûtinférieur.Danscesdeux cas,l'améli orationdelaqual itéentr aineunemeilleur erentabilitésoitunretoursurinvestissement(ROI=ReturnOfInvestissement).AméliorationdelaqualitédeconceptionAméliorationdelaqualitéderéalisationQualitéperçueplusélevéeFidélisationetaugmentationdelaconfianceclientProfitsplusimportantsPartdemarchéplusimportanteCoûtsdeproductionplusbasAméliorationdelarentabilitéFigure4:Enjeuxstratégiques
14Deplus,lesexigencesréglementairesobligentlesentreprisesàinvestirdanslaluttecontrelanonconformi té.Laq ualitédel'entrepris esetradu itparsaconformitéauxexigencespharmaceutiquesnotammentaurespectdesBPF.Ainsilaquali téd'unproduit(se rvice)correspo ndàl'adéquationentrel esexigencesclients/entreprise,exigencesréglementairesetAutoritésdetutelle.3 LesexigencespharmaceutiquesEnFrance, lesopérationspharmace utiquestellesquelafabr ication,l'imp ortation etl'exportationainsiqueladistributiondesmédicamentsnepeuvents'effectuerquedansdesétablissementspharmaceutiquesetdoiv entimpérativementrespe cterunenvironnementréglementaireprécisetstrict.3.1 L'autorisationd'ouverturedel'établissementpharmaceutique3.1.1 UneexigenceréglementaireeuropéenneToutétablissementdel'UnionEuropéennefabricantdesmédicamentsdoitobligatoirementêtretitulaired'uneautorisatio nd'ouvertured'établissementpharmaceutique.Sile smédicamentssontexportésendeho rsdel'Unio nEuropéenne,leurfabri cationpeu têtresoumiseàdesexigencessupplémentairesémisesparlepaysdestinataire.AinsipourexporterauxEtats-Unis,l'établissementdoitobtenirunagrémentdelaFoodandDrugAdministration(FDA).EnFrance, l'autorisationd'ouvertu refaitsuiteàuneautorisationdélivr éeparl'AgenceNationaledeSécuritéduMédicamentetdesproduitsdesanté(ANSM).[5]3.1.2 Undossierdedemanded'ouvertured'établissementpharmaceutiqueLedossierestdéposéauprèsdesautoritéscompétentesquidonnentounonl'autorisationd'ouverture.Ilcomprendplusieurstypesd'informationsdontcellesconcernant:- l'entrepriseetletyped'activité- lepharmacienresponsable,intérimaireetdélégué- l'établissementpharmaceutiqueetladescriptiondeslocaux,deséquipements,desformespharmaceutiquesfabriquées...L'établissementdoitexercersonactivitéenconformitéavecl'autorisationd'ouverturequ'ilaobtenue.
153.2 L'autorisationdemisesurlemarché(AMM)3.2.1 Lesréférentielsréglementaires3.2.1.1 Lecodedelasantépublique(CSP)LeCSPestletexteréglementairerégissantlafabricationetladistributiondesmédicamentsconsommables.Ildéterminelesdroits,devoirsetresponsabilitésdechacunsuivantsonrôledanslaSantéPublique.PubliéauJournalOfficieldu22juin2000,parl'Ordonnancen°2000-548du15juin2000,ilestcomposéd'articleslégislatifsetréglementairesquiétablissentlesrèglesàappliquerpourgarantirlamaîtrisedelaqualitéconcernantlesactivitésliéesaumédicament.Ilestsanscessemodifiédufaitduprogrèsdesidéesetdestechniquesetdel'évolutiondudroitcommunautaire.[6]D'aprèsl'articleL.512 1-8du CSP,toutes lesspécialités pharmaceutiqueso utoutautremédicamentfabriquéindustriellementdoivent,avantleurcommercialisation,fairel'objet d'uneAMM.Cetteautorisationapourobjectifdepromouvoirlasantépublique.Ellesebasesuruneévaluationdudossierd'AMMselondescritèresscientifiquesdequalité,sécurité,efficacité,etavecunrapportbénéfice/risqueaumoinséquivalentàceluidéjàcommercialisé.Ilexistedifférentesprocéduresdedemanded'autorisationdemisesurlemarché: Laprocédurecentralisée:déposéeauprèsdel'AgenceEuropéenneduMédicaments(EMA=EuropeanMedicinesAgency).Cetteprocédureestobligatoirepourcertainsmédicamentscommeparexempleceuxissusdesbiotechnologies.Elleestvalablepourtouslesmemb resdel'Un ionEuropéenne.Sil'autor isationestoctroyée,elle estd'embléevalablepourtouslespaysmembresdel'UnionEuropéenne. Laprocéduredécentraliséeoudereconnaissancemutuelle:déposéeauprèsd'unétatmembredel'UnionEuropéenne.Sil'autorisationestaccordée,ellepeutêtreétendueauxautresEtatsmem bresparu neprocéduredereconnai ssancemu tuelle.Cetteprocédurepermetainsid'obteniruneouplusieursAMMnationalessurlabasedelapremièreAMMnationaleaccordéeparlepremierEtatmembreditderéférence. Laprocédurenationale:elleestoctroyéeparl'autoritécompé tentedup aysdanslequellaprocédureestdéposée.Elleestdemoinsenmoinsutiliséecarellen'estapplicablequesurleterritoirenational.Depuis2003leformatdudossierd'AMMaétéréviséavecpourobjectifdes'harmoniseraveclesformatsdesdossiersd'enregistrementdel'Europe,desEtats-UnisetduJapon.CeformatstandardestleCTD(CommonTechnicalDocument).LeCTDestcomposéde5modulesdontleModule2quicorrespondaurésumédesModules3,4et5(donnéesqualité,précliniquesetcliniques).
163.2.1.2 GoodManufacturingPractice(GMP)LesGMPGuidelines,sontétabliesaunive aueuropéenparlad irectiveeuropéenne91/356/EECabrogéeparlesDirectives2003/94/ECet91/412/EEC.EllesontétérédigéesenconformitéaveclaDirectiveEur opéenne2001 /83/CE quiétablitlecodecommunautairerelatifauxmédicamen tsàusageh umain.Ellescorresponden tauxBonnesPratiquesdeFabrications(BPF)françaises.Pours'appliquerenFrance,lesdirectiveseuropéennesdoiventêtrepréalablementtransposéesdansledroitfrançaisdansleCodedelaSantéPublique.Tableau1:ComparaisonducontenudesdossiersAMMetCTDINFORMATIONSAMMCTDADMINISTRATIVESETDEPRESCRIPTIONPartieI:RésumédudossierrenseignementsadministratifsRésumédesCaractéristiquesduProduit(RCP),l'étiquetageetlesrapportsd'expertsModule1:Donnéesadministrativesetpropositionsrelativesàl'informationsurleproduit. INFORMATIONSRELATIVESAUXPROCEDEDEFABRICATIONPartieII:QualitépharmaceutiqueInformationssurlacomposition,laméthodedepréparation,lecontrôledesmatièrespremières,lecontrôledesproduitsintermédiaires,lecontrôleduproduitfinietlastabilitéModule3:QualitéDonnéeschimiques,pharmaceutiquesetbiologiquesrelativesau(x)substance(s)active(s)en3.2.Setauproduitfinien3.2.PModule 2.3 INFORMATIONSRELATIVESAUXESSAISPRECLINIQUESPartieIII:SécuritéSous-partieIIIA:innocuité(donnéestoxicologiques)Sous-partieIIIB:Résidus(pharmacocinétiquedesrésidusetleursméthodesd'analyse)Module4:Rapportdesessaisnoncliniques(précliniques)Informationsrecueillieslorsdel'usagedumédicamentchezl'animalModule 2.4 Module 2.6INFORMATIONSRELATIVESAUXESSAISCLINIQUESPartieIV:EfficacitéEssaisprécliniques(pharmacodynamie,pharmacocinétique,tolérance,résistance),etcliniques.Module5:Rapportd'essaicliniqueInformationsrecueillieslorsdel'usagedumédicamentchezl'hommeModule 2.5 Module 2.7
173.2.1.3 LesBonnesPratiquesdeFabrications(BPF)LeCSPimposeauxindustrielsl'applicationdesBPFpourlaréalisati ondeleurs activitéspharmaceutiques.LesBPFsontédictéesauni veaueu ropéenpuistranspo séesaunive aunationalparl'ANSM,dansunréférentielqualitédumêmenom.Ceréférentielestlégalementopposableparlesautoritésadministrativesfrançaises.Ildéfinitdesréglementati onsàrespecterpourveilleràl'assurancedelaqualitéetàlaréalisationdesmédicamentscommedécritdansl'AMM.L'OrganisationMondialedelaSanté(OMS)définitlesBonnesPratiquesdeFabricationcomme"undes élémentsdel 'assurance delaqualité;ellesgarantissentque lesproduits sontfabriquésetcontrôlésdefaçonuniformeetselondesnormesdequalitéadaptéesàleurutilisationetspécifiéesdansl'autorisationdemisesurlemarché».[7]Ellessontreconnue setappliquéesdansl'ensemble desp aysoùonfabriquedesmédicaments.LamiseenformedesBPFaétéharmoniséeaveclesGMPparl'introductiondansletextefrançaisdeLignesDirectriceseuropéennes.Ellessecomposentde9chapitresetd'annexesquiévoluentaufildesmodificationsdesBOFeuropéennes.Ilsdétaillentlesmesuresàappliquerentermede[8]: Gestiondelaqualité Personnel Locauxetmatériel Documentation Production Contrôledelaqualité Fabricationetanalyseensous-traitance Réclamationsetrappelsdemédicaments Auto-inspectionLesgrandsprincipesdesBPFreposentsur: Latraçabilitédetouteslesactionsentreprises Lavalidationdessystèmesetéquipementsdemanièreformelleetrégulière Lesformationsafindedévelopperetdémontrerlescompétencesauxpostesdetravail Lesrèglesd epropretéetd'hygièn epourp rotégerlesproduitsdeto utescontaminationscroisées Lecontrôleautraversd'analysesetd'auditsrégulièresafind'assurerlaconformitéauxspécifications,BPFLesBPFsont misesàjour lorsquedes nouvellesannexes so ntajoutées.Actue llement,laversionenvigueurestlaN°2011/8bisparueauBulletinofficielenjuillet2011.Cependantunenouvelledécisionaétésignéeparledirecteurgénéraldel'ANSMle4décembre2013,qui,
18aprèspublicationauJournalOfficieldonneralieuàunenouvelleversion.[9]Elleintègreranotammentlaprem ièreversiondelapartieIIIdu guideeuropéenrelative auxattentesréglementairesquiinclutlesdocumentssuivants: Gestiondurisquequ alité(ICHQ 9)quicorrespondàl 'ancienneannexe20 duprécédentguidedesBPF SystèmeQualitéPharmaceutique(ICHQ10) Exigencesinternationalesharmon iséespourlacertificationd'unlotcontenuducertificatdelotpourlesmédicamentsLesBPFconc ernentlesacti vitésdefabricationdel'achatàl' expéditionde sproduits.Lesactivitésliéesàlarechercheetaudéveloppementdu médic amentso ntégalementrèglementéesparlesBonnesPratiquesdeLaboratoire(BPL)pourlaprécliniqueetlesBonnesPratiquesCliniques(BPC)pourlesessaissurl'Homme.LesBonnesPratiquesdeDistribution(BPD)estleréférentielqualitépourladistributiondesmédicaments.3.2.1.4 LesPharmacopéesLaPharm acopéeestunouvrageréglementair e,régulièrementmisàjo ur,etdestinéauxprofessionnelsdesantéetauxlaboratoires.Elleestconstituéededifférentesmonographiesquicor respondentàunensembledespécificationsd éfinissantlescritères depuretédesmatièrespremièresoudespréparationsentrantdanslafabricationdesmédicaments(àusagehumainetvétérinaire)etlesméthodesd'analysesàutiliserpourenassurerleurcontrôle.AinsiLesnormesdeceréférentielscientifiquequipermetd'assurerunequalitéoptimalefontautoritépourtoutesubstanceoumonographiefigurantdanslaPharmacopée. LaPharm acopéeEuropéenne:Lesnormess 'appliquentréglementair ementàl'ensembledesétatsmembressignatairesdelaConventionpourl'élaborationdelaPharmacopéeeuropéenne(36états).LaPharmacopéeeuropéenneactuellementenvigueurestla8eédition.Elleestcomplé tée,pourcertainsétats,pardesPharmacopéesnationales. LaPharmacopéeFrançaiseestainsiconstituéedelaPharmacopéeEuropéenneetdetextesetmonograph iesstr ictementnationaux.LaPharmacopéefrançaise actuellementenvigueurestla11eédition. LaPharm acopéeAméricaine(ouUSPpourUnitedStatesPharmaco poeia)etl aPharmacopéejaponaise(ouJP)son taveclaPharmacopéeeuropé ennelestro isréférentielsintégrésdanslesystèmed'harmonisationinternationaledesnormes.[10][11]
194 UnsystèmeQualitépharmaceutiqueadaptéauxbesoinsdel'AMMets'appuyantsurl'ISO9001:lesICHQ8-Q9-Q10.4.1 InternationalOrganizationforStandardizationL'ISO(Organisation InternationaledeNormalisation)estun eorganisationnongouvernementalesansbutlucratifquis'adresseàtoustypesd'entreprisesfabriquantdesproduitsouproposantdesservices.Sonobjectifprincipalestdefaciliterlacoordinationetl'unificationinternationaledesnormesindustrielles.Cesnormessontélaboréesparungrouped'expertsauseind'uncomitétechniquepou rs'assurerd'uneproduction dequalitédes entreprises.BienquenonobligatoireunecertificationISOtémoigneuneconfiancesurladémonstrationformelledelamaîtrisedelaqualité.[12]L'ISO9000:2005,Systèmesdemanagementdelaqualité-Principesessentielsetvocabulaire,etdansl'ISO9004:2009,Gestiondesperformancesdurablesd'unorganisme-Approchedemanagementparlaqualité,définissentleshuitprincipesdemanagementdelaqualité:1) L'orientationclient2) Leleadership3) L'implicationdupersonnel4) L'approcheprocessus5) Lemanagementparapprochesystème6) L'améliorationcontinue7) L'approchefactuellepourlaprisededécision8) LesrelationsmutuellementbénéficiairesaveclesfournisseursL'ISO9001,intituléeSystèmesdemanagementdelaqualité-Exigences,estlaseulenormeàpouvoirêtreutiliséeàdesfinsdecertification.Elleénoncelescaractéristiquesessentiellesd'unsystèmedemanagementdelaqualitéefficace.4.2 ICH:InternationalConferenceonHarmonizationLaConf érenceinternationalesurl'harmonisati ondesexigencestechniquespour l'enregistrementdesproduitspharmaceutiquesàusagehumain(ICH)aétécréeenen1990.Elleprovientd'unevolontécommunedesautoritéscompétentesetdesreprésentantsdel'industriepharmaceutiquedel'Unioneuropéenne,duJaponetdesEtats-Unisd'harmoniseruncertainnombred'exigencesréglementairespourfaciliterlacommercialisationdesproduitspharmaceutiquesetainsipromouvoirlasantéglobaledanslemondeentier.Lamissionde
20l'ICHestdep arvenirào btenirde smédicamentsàusagehumain en registrés,debonnequalité,àdesniveauxdesécuritéetd'efficacitésatisfaisants,etàdescoûtsraisonnables.Pouryrépondre,l'ICHestdiviséen4grandesthématiques: QualityGuidelines(ExigencesdeQualité) SafetyGuidelines(ExigencesdeSécurité) EfficacyGuidelines(Exigencesd'Efficacité) MultidisciplinaryGuidelines(ExigencesMultidisciplinaires)Audébutdesannées2000,leComitédepilotaged'ICHperçutlanécessitédedéfinirunenouvelleapprochedelaquali téenproductionpharmaceutique.Elledevraitrepo serdavantagesuruneassisescientifiquesolideetlagestiondurisque,ainsiquesurunsystèmedegestiondelaqualitéapproprié.[13]LesnormesIQHQ8,Q9etQ10ontainsiétéélaboréesettendentaujourd'huiàreplacerlesBPFdansunsystèmequalitépluslargeetsurtoutbeaucoupplusréfléchi.4.3 ICHQ8"PharmaceuticalDevelopment"Cettelignedi rectriceestdes tinéeàdéfinirletyped'inform ationsnécessai resaudoss ierd'enregistrement(AMM)(section3.2.P.2(Déve loppementpharmaceutique)duCTD)pourdémontrerlaconnaissancedes facteurs ayantunimpactsurlaqualitéduprod uit.L'annexe"QualitybyDe sign"(QbD)estunedé marchestructuréeetrationnelledudéveloppementpharmaceutiquequiinciteàintégrerlaqualitédèslaconception.Eneffet,ledéveloppementpharmaceutiqueestuneétapeextrêmementlongueetcoûteusedanslecycledevied'unmédicament.Lemanquedeconnaissanceoudemaîtrisedesvariationsobservéessurlesmatièresetlesprocédésinduitdescoûtsdenon-qualitéainsiquedesdemandesdemodificationenréponseàcesvariationsLadémarcheQbDrésidedanslaconnaissancepréalable(Priorknowledge)structurée.Ellepermetd'identifiercommentles"AttributsQualitéProduit"sontinfluencésparlamiseenoeuvreduprocess.Ellereposesurlaculturescientifiqueetlagestionqualitéetnécessiteuneapprochemultidisciplinaire.[14] Uneéquipep luridisciplinaireétabl ittoutd'abordleProfilQualitécibleduproduit(QualityTargetProductP rofile-QTPP)quiestunrésum édescaractéristiques"Qualité"dumédicamentàatteindrepourassurerleniveaudequalitérequis. Les"AttributsQualitéCritiques"duproduit(CriticalQualityAttributes-CQA)sontalorsdéfinis.Cesontleslimitesdespropriétésphysiques,chimiques,biologiquesoumicrobiologiquesàrespecterpourassurerleniveaudequalitérequispourleproduit.Cesattributsdoiventservirdebasepourlesspécifications.
21 Delamêmefaçononidentifieles"AttributsCritiquesdeFormulation"duproduit(CriticalMaterialAttributes-CMA),et Les"ParamètresCritiquesduProcédé"(CriticalProcessParameter-CPP).Lavariabilitéd'unparamètreduprocédéaunimpactdirectsurunattributqualité.C'estpourquoiilestnécess airequ'ilssoientcontrôlésafindes'assu rerque leprocédéconduitbienauniveaudequalitérequisduproduit.QbDpermetd'identifierlafaçondontlesAttributsQualitéProduitsontinfluencésparlamiseenoeuvreduprocess.L'expérienceetlaconnaissancecumuléesàl'aidedediversoutils(Riskassessment,pland'expérience,outilsstatistiques...),peuventainsiêtreutiliséespourélaborerunespacedeconception(DesignSpace)etunestratégiedecontrôle.L'EspacedeConception(Designspace)estunespacemultidimensionnelàl'intérieurduquelchaqueparamètrepeutvariertoutenpréser vantlaqualité,l'efficacitéetla sécuri téduproduit.Toutevariationàl'intérieurdel'espacedeconceptionneserapasconsidéréecommeunemodificationetnenécessiterapasdedépôtde"variation".Cettestratégiedoitpermettreàl'entreprisepharmaceutiquedefabriquerunproduittoujoursconformeetd'optimiserpoten tiellem entsaproductionetlesprocessusdedéci sionsconduisantaufinalàlalibérationdeslots.[15]EtudesprécliniquesetcliniquesDéterminationduProfilqualitécibleQTPPDéterminationdesattributsqualitécritiquesCQACARACTERISATIONDUPRODUITDéterminationdesattributscritiquesdeformulationCFPDéterminationdesparamètrescritiquesduprocédéCPPCARACTERISATIONDUPROCEDEESPACEDECONCEPTION(Compréhensiondel'interactionProduit-Procédé)Figure5:Déterminationd'unespacedeconception
22Figure6:DémarcheQbD(QualitybyDesign)issuedel'ICHQ8[16]LaStratégiedeMaîtrise(ControlStrategy)définitlesmoyensdecontrôlemisenoeuvrepourjustifierlamaîtrisedelaqualitédesproduitsfabriqués.Cesmoyenssont: Pourlesproduits,matièrespremièresetintermédiaires:lesspécifications(Specifications&Materialattributes) Pourlesuividuprocédé:lesIPC(inprocesscontrol),IPT(inprocesstesting),PAT(ProcessAnalyticalTechnology)etlemonitoringdesparamètresetconditionsopératoiresauregarddurisqueidentifiéCelapermetd'assurerlamaîtrisecontinuedesrisques(QualityRiskManagement)etainsid'assurerlavérificationcontinuedelarobustesseduprocédédefabrication.
235 ICHQ9:lagestiondurisquequalitéLagestiondurisquequal itéestun processussystématiqued'évaluation,de maîtrise,decommunicationetderevuedesrisquesqualitédumédicament.Ellepeutêtreappliquéedefaçonprospectiveourétrospective.Ceprocessusparticipedoncàladémarched'améliorationcontinueetainsi,lemanagementdurisqueQualités'intègredoncpleinementdansuncontexteglobaldeManagementdelaQualité.5.1 Définitions5.1.1 LerisqueIlcaractériseunévénementindésirableparsaprobabilitéd'occurrenceetparlagravitédesdommagesencourus.C'estlerisquedefournirunproduit(médicament)nonconforme.C'estaussilaposs ibilitéqu'unprojetnes'exécute pasconformémentaux prévisionsdedates d'achèvement,dec oûtetdes pécifications .Cesécartsp arrapportsauxpr évisions sontconsidéréscommedifficilementacceptables,voirinacceptable.5.1.2 L'analysederisqueC'estunoutilinterneàunesociété,permettantdemieuxconnaîtreetmaîtriserunprocessusouunproduit.Anticiperlesrisquespermetderationaliserlaproductionendiminuantlesdéviations,lesnonconformitésetlesincidents.C'estunmoyendeprouverquelesystèmeassurelareproductibilitédesprocess,donclaqualitéduproduit.Ellepermetégalementd'êtreenconformitéaveclaréglementationetd'affirmer,aucoursd'uneinspectionoud'uneaudit,quelesystèmeestsouscontrôle.5.2 ObjectifsL'analysederisqueapourbutd'identifierlesdangerssignificatifspotentiels,d'évaluerleurprobabilitéd'apparitionainsiqueleurdegrédegravité.Pourréduireunrisque,onpeutdoncagiràquatreniveaux: enréduisantlasévéritédel'effetprovoquéparledanger enréduisantlaprobabilitéd'apparitiondudanger enévitantledangeretainsienéliminantlacause enaugmentantlesmoyensdedétection
24Laméthodederésolutiondeproblèmepermetd'avoir: unemeilleureconnaissanceduproblème(lesprocédésetprocessusdefabrication) unemeilleureanalyseduproblème lasolutionlamieuxadaptéeauproblème(réductiondurisque) d'améliorerlaqualitéduproduittoutenréduisantlescoûts.5.3 Lesréférentiels5.3.1 NormeISO31000:2009"Managementdurisque-Principesetlignesdirectrices"Ceréfére ntielestparuennovembre2009.C esrecomm andationsontpo urobjec tifd'harmoniserlesprincipesetlesprocessusdegestiondesrisquesentretouslessecteursindustrielssanspourautantlesuniformiser.Cettenormepréconiselamiseenplaced'uncadreorganisationnel(framework)afind'améliorerencontinueleprocessusdemanagementdesrisquesgrâceàdesmoyensdegestiondesrisquesetd'indicateursdeperformance.Lanormeeststructuréeentroisparties,àsavoirlesprincipes,lecadred'organisationetleprocessusdemanagement: Lesonzeprincipespermettentd'expliquerl'intérêtdumanagementdesrisques.Leprocessusd'intégrationdecesp rincipessefaitensuiteàdeu xn iveaux:le niveaudécisionneletleniveauopérationnel. Lecadred'organisationexpliquecommentintégrer,vialeprocessusitératifdelarouedeDeming (Plan-Do-Check-Act),lemanageme ntdesris quesdanslastratégiedel'organisation(conduitestratégique). Leprocessusdemanagementprécisecommentintégrerlemanagementdesrisquesauniveauopérationnel delastratégiedel'organisation(cond uiteopérati onnel ).Ceprocessusitératifestbienconnudesrisk-manager[17]Figure7:StructuedelanormeISO31000enmanagementdesrisques
Principe
• PrinciplesCadreOrganisaonnel
• FrameworkProcessusdemanagement
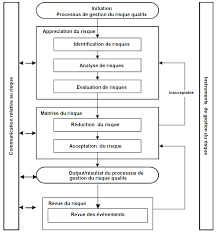
• Process255.3.2 ICHQ9"QualityRiskManagement"ICHQ9estincontournableentermedegestiondesrisquespharmaceutiques[10].Restantgénéralistes,cesrecommandationssontapplicablesàchacunedesétapesducycledeviedumédicament.Toutefois,enmars2008,cetexteestentrédanslaréglementationeuropéenneenannexe20desGMPs.Ilfournituneapprochesystématiquepourl'évaluationdurisquequalitéetdesexemplesd'outilspossiblespourcetteévaluation,qu'ellesoitprospectiveouréactive,toutaulongdelavieduproduit.Lesystèmedegestiondurisquequalitédoitgarantirquel'évaluationdurisquequalitéestbaséesurlaconnaissancescientifique,l'expérienceduprocédéet,aufinal,assurelaqualitéd'unproduittoutaulongdesoncycledevieetlasécuritédespatients.Deuxprincipessontfondamentaux[18]: L'évaluationdurisquequalitéàpartirdedonnéesscientifiquesfiablesetexactes Leniveaud'effortdép loyédeformali sationetdedocumentationduprocess usde gestiondurisquequalitédoitêtreproportionnelàlacriticitédecerisque
26Figure8:Aperçud'unprocédédegestiondurisquequalitéclassiqueissud'ICHQ95.3.2.1 Lesétapes5.3.2.1.1 InitiationdeladémarcheLerisqueestàprendreencomptedèsladéfinitionduprojet,idéalementdèslaphasededéveloppement(ICHQ8),carplusilestdétectétardivementpluslesconséquencespeuventêtregravesetdifficilementréversibles.Toutesles informations collectéeslorsdelaphasedeconc eption,d'industrialisation,de productionpuisdepost-productionsontintégréesàcetteanalyselorsdel'identificationdesrisques.Cesinformationsincluentlesphénomènesdangereuxetlessituationsdangereusesidentifiées.Ainsilagestiondesrisquesestassuréetoutaulongducycledeviedumédicament.Lorsdemodificationduproduit,l'impactduchangementapportéaumédicamentexistantestétudié
27etanalysé.Lacollectedenouvellesinformationssurlemédicamentoudesmédicamentssimilairesdéclencheégalementlarevuedel'analysederisque.5.3.2.1.2 EstimationdurisqueLapremièreétapedumanagementdesrisquesconsisteàdéfinirlesystèmeàétudierpourpouvoirparlasuiteinitierladémarched'identification,d'analyseetd'évaluationdesrisquesdusystème.Ilfautdoncconcevoir,mettreenplace,documenter,évaluer,mainteniretfaireévoluerunprocessuspouridentifieretréduirelesrisquesassociésàlaqualité.5.3.2.1.3 ContrôledurisqueUnefoislerisqueestimé,desmoyenssontmisenoeuvrepourlemaîtriser(réductiondelacriticitédesrisquesjusqu'àatteindreunniveauacceptable).5.3.2.1.4 CommunicationautourdurisqueUnevéritablecommunicationautourdurisquedoitêtreinstauréeaveclesdifférentsacteursimpliqués,allantdelaprisedecon naissanceetde conscie ncede srisques,àl'étatd'avancementduprocessusetauxrésultatsobtenussuiteàlamiseenplacedumanagementdesrisque.5.3.2.1.5 RevuepériodiquedurisqueévaluéLagestiondesrisquesestunprocessusdynamiquequiévolueaveclacollectedenouvellesinformationssurleproduit(identificationd'unenouvelledéfaillanceduproduitaucoursdesprocessdefabricationoudeconditionnement,réclamationscritiquesouderappelsdelots)maisaussiparlamiseenplacedenouvellesréglementationsetavancéesscientifiques.Unréexamendel'analysedesrisquesdoitêtredéclenchépouryévaluerlesnouveauxrisquesoudangersgénérés.C'estunfacteurd'améliorationquilorsqu'ilestbienmaîtriséestungaindetempsetdoncunenjeuéconomiquemajeurpourl'entreprise.5.4 Lesoutilsqualitépermettantd'optimiserl'analysederisquePouraméliorerlaqualitéinterneetexternedel'entreprise,ilexistedesméthodesetdesoutilsqualitéadaptésauxsituationsetobjectifs.L'utilisationdecesoutilscontribueàinscriredurablementl'entreprisedansunedynamiqued'améliorationcontinue.Lesoutilsqualitépeuventêtreutilisésàchacunedesétapesducycledeviedumédicament.Certainssontnécessairepourrésoudreouprévenirunproblèmeounon-conformité(CAPAs:PreventiveAction,CorrectiveAction),identifierlescausesd'undysfonctionnement,lorsdelaconceptiond'unnouveauproduit...Ilssontdonclargementutiliséspouroptimiserl'analysederisque.
285.4.1 BrainstormingLebrainstormingouremue-méningesestunetechniquederésolutioncréativedeproblème.Ellepermetdeposerleproblèmeetderechercherdessolutionsgrâceàunrecoupementd'idéeseffectuéparungroupedetravail(4à12personnes,choisiesdepréférencedansplusieursdisciplines)sousladirection d'un animateur.Lemaximum d'idéesdevraêtreexpriméetnotésuruntableau(paper-board)visibledetous.5.4.2 QQOQCPLeQQOQCPsertàidentifierleproblèmedemanièrestructuréeetdanssonensembleàpartirdesixquestions,Ilpermetd'avoirdes inform ationssuffisantespo urdétermineravecexactitudequelleenestlacauseprincipale.[19]Q:QUIQuifaitquoi?Quiestconcernéparleproblème?quiestintéresséparlerésultat?Quiestconcernéparlamiseenoeuvre?...Q:QUOIDequois 'agit-il?Quel estl'étatdelas ituation?Quel lessontlescaractéristiques?Quellessontlesconséquences?...O:OUOùleproblèmeapparaît-il?Dansquellieu?Surquelleéquipement?Aquelleplacedansleprocessus?...Q:QUANDQuandleproblè mea-t-ilétédéc ouvert?Depuisquandya-t-ilce problème?Quelleestsafréquence?...C:COMMENTCommentmettreenoeuvrelesmoyensnécessaires?Dequellemanièreintervientleproblème?...P:POURQUOIPourquoiréalisertellesactions?Pourquoirespectertellesprocédures?...5.4.3 Méthode5M-LeDiagrammed'IshikawaAppeléégalementDiagrammecause-effetouDiagrammeen"arêtesdepoisson",cetoutilpermetderechercherlescausesd'unproblèmeetdequalifierleurimpact.Larésolutiondeproblèmepermetdevisual iserglobalementetdefaçonstruc turéeparungraphiquearborescenttouteslescausespossiblesquiproduisentoupourraientproduirel'effetobservé.Leproblèmeestdéfinientermesd'effet.IlcorrespondàlaNonConformité.Onutiliseuneapproche5Mcorrespondantàtouteslesressourcespotentiellesd'unprocessusetpouvantêtrelescausesdelaNonconformité(Matières,Matériel,Méthodes,Milieu,Maind'oeuvre).Pourchacunedesfamilles,ilfautinscrirelescausesetsouscauses.
29Figure9:Schémad'undiagrammed'Ishikawa5.4.4 LediagrammedeParetoParetoestunéconomisteetsociologueItalien(1848-1923).Saméthodeapourbutdefaireapparaîtrelescauseslesplusimportantesquisontàl'origineduplusgrandnombred'effets.Sachantque20%descausessontàl'originede80%desconséquences,ilsuffitdetravaillersurces20%làpourinfluencerfortementlephénomène.Encesens,laloideParetoestunoutilefficacedeprisededécision.Présentésousformedegraphiqueenbandessimples,ellepermetdeclasserlescausesd esproblèmes .Lahauteu rdescolonnes,proportionnelleàl'importancedechaquecause,permetd'établirdesprioritésd' actionetlesactivitésd'amélioration.Engénéral les3premièrescol onnesrepré sentent 70à80%desnonconformités.Pouruneapproch ebeaucoupp lusscientifiqueontravailleraenfréquencecumuléeetles80%permettrontd'identifierles20%decausessurlesquellesilconviendrad'agirenpriorité.Ilpeutyavoirjusqu'à6-8causesidentifiables.Lerecoursàcegenredegraphiquedonnelieuàlarèglededitedel'ABC: Ilfautidentifierclairementl'ordred'importancedescausesdenonconformité, Visualiserl'ordredegrandeurdecescauses Choisirsurquoientreprendrelesactions(80/20) Adapterlesmoyensauxeffets(ABC)
315.5 LesoutilsdemanagementdurisqueQualitéTouteslesméthodesd'analysederisquesontbâtiesselonlamêmetrame.Néanmoins,aucunoutilouensembled'outilsn'estapplicableàtouteslessituations.Laméthodeutiliséedoitêtreadaptéeaucontextetoutenrestantproportionnelleaurisque.Figure12:Méthodologiegénéraled'uneanalysederisque5.5.1 L'AnalysePréliminairedesRisques:APR.L'APRaété développéeaudébutdesann ées1960dansle sdomainesaé ronautiqueset militaires.Utiliséedepuisdansden ombreusesautresindustr ies,l'Unio ndesIndu striesChimiques(UIC)recommandesonutilisationenFrancedepuisledébutdesannées1980.[20]SelonlanormeCEI300-3-9[21],l'APRestuneméthoderigoureused'analysesystématiquederisquesàpartird'unprocessusdéfiniaudépart.Ellepeutêtreutiliséelorsdesphasesamontdelaconceptionpouridentifierlesdangers,analyserleurfréquenceetévaluerleurcriticité.[22]LadémarcheAPRpeutprendredesformesextrêmementdiverses.Néanmoinsonretrouvesystématiquementtroisphasesquisontaussitroisobjectifs:
32 Identifierlesdangersetlescausesd'accidentséventuels Evalueretclasserlesrisquesassociésenutilisantunecombinaisondelagravitéetlaprobabilitéd'occurrence ProposerdesmesurescorrectivespossiblesEllefournitunepremièreanalysedesécuritéetdéterminelesdangerslesplusimportantsaustadedelaconceptiond'uneinstallation.Danslecasd'uneinstallationcomplexedéjàexistante,ellepeutcorrespondreàlaphasepréliminaireàl'applicationdeméthodesplusfinestellesquel'AMDEC,l'arbrededéfaillance...5.5.2 AMDECAnalysedesModesdeDéfaillance,deleurEffetsetdeleurCriticité.Outild'AméliorationContinueApparuen1960dansledomainedel'aéronautique,laméthodeinitialeestappeléeAnalysedesmodesdedéfaillancesetdeleurseffets(AMDE).L'AMDEestuneméthoded'analyseinductiveetpréventivedelasûretédefonctionnement(fiabilité,disponibilité,maintenabilité,sécurité).Ellepartdesdéfaillancesélémentairesdescomposantspourendéduirecequienrésulteetdoncàquellessituations,duesàcesdéfaillances,ilfauts'attendre.L'AMDECestessentiellementunedémarchedéductiveetexhau stivequiajouteunedimensiond'évaluationdelagravitédecessituations.Aujourd'huielleestlaméthodederéférencedanslemondemédical ,recommandée parlaHAS ,quipermetd'iden tifierlesdéfaillancespossiblesetd'indiquerleurseffets,avantmêmequ'unincidentseproduise.Elleconsisteàdéfiniretàévaluerauniveaud'unsystème,d'unproduitoud'unprocessus,leseffetsdesdéfaillancesdesélémentsdecedernier.Leprincipedelapréventionreposesurlerecensementsystématiqueetl'évaluationdesrisquespotentielsd'erreurssusceptiblesdeseproduireàtouteslesphasesderéalisationd'unsystème.Laréalisationd'uneAMDECsupposeledéroulementdelaméthodecommesuit: Laconstitutiond'ungroupedetravail L'analysefonctionnelleduprocédé(oudelamachine) Identifierlesdéfaillances,lesévalueretdéterminerleurcriticité Définirlesactionsàentreprendrepourleséliminer,réduireleurseffetsetempêcheroudétecterlescauses. DocumenterlamiseenapplicationdesactionsL'analysepréliminaireprendencompte3paramètresdurisque: Lasévéritéougravitédurisque(S) Laprobabilitéoufréquenced'apparitiondurisque(P) Ladétectabilitédurisque(D)
34Zone1à43correspondaurisquemodérépour lequel uneactioncorrective estàplanifier:RPN<43Zone43à343correspondaurisqueprioritairepourlequeluneactioncorrectiveestimmédiateRPN>43L'applicationetlesuividupland'actionveillerontàréduirelesrisqueslespluscritiquesenéliminantlacausedudéfaut,diminuantlafréquenced'apparitiondeladéfaillancesilacausenepeutêtresupprimée,améliorantlesmoyensdedétectiondudanger.AnalysederisqueduprocessusEvaluationdurisqueRéductiondurisqueEvaluationdurisquerésiduelDéfaillanceEffetsCausesOriginesSPDRPNMoyensdemaitriseSPDRPNGénérationdenouveauxdangers(oui/non)Dansnotrecas,leRPNmoyenestde43.DoncpourtouslesRPNsupérieursà43,desactionscorrectivesimmédiatesserontmisesenplace.Enfin,lerisquerésiduelestcalculéentenantcomptedesmoyensdemaîtrisemisenoeuvre.UnnouveauRPNaprèslamiseenplaced'actionscorrectivesestrecalculé.5.5.3 EvaluationglobaledesrisquesrésiduelsLorsdelamise enoeuvre desm oyensdemaîtris e,ilest étudiésiceux-cigénère ntdenouveauxrisquesoudangers.Siaucunnouveaurisquen'estgénéréetsilesrisquesrésiduelscombinésneprésententpasdenouveauxrisquespourlespatientsoulesutilisateurs,alorslesrisquesrésiduelssontacceptésdansleurglobalité.5.5.4 Analysedesrisquesetdel'exploitabilité(HAZOP)Lamétho deHAZOP,pourHAZardO Perability,estprinc ipalementdédiée àl'analysedes risquesdessystèmesthermohydrauliquespourlesquelsilestprimordialdemaîtriserdesparamètrescommelatempérature,lapression,ledébit,etc.L'HAZOPsuituneprocédureassezsemblableàcelleproposéeparl'AMDEC.
35HAZOPestbasésurunethéoriequisupposequelesévénementsderisquesontcauséspardesécartsparrapportauxintentionsdeconceptionoudefonctionnement.Lapremièreétapeconsisteàdécrirelefonc tio nnementnormalduprocess usdefaço ndétailléeenledécomposantenunesuited'opérationsprévues.Onenvisageensuitelesécartspossibles,lesdangersàl'aidedecequ'onappelle"Guide-mots"."Guide-mots"(parexemple,non,plus,autresquelapartiedu,etc.).Legroupedetravaildoitalorss'attacheràdéterminerlescausesetlesconséquencespotentiellesdechacunedecesdérivesetàidentifierlesmoyensexistantspermettantdedétectercettedérive,d'enprévenirl'occurrenceoud'enlimiterleseffets.[23][24]IntentionDéviationsCausespossiblesConséquencesPropositionsd'actionsHiérarchisationd'actionsFigure13:MéthodologieHAZOP
365.5.5 Analysedesdangersetpointscritiquespourleurmaîtrise(HACCP)LaméthodeHACCPsignifieHazardAnalysisCriticalControlPoint.Elleaétédéveloppéedanslesannées60parlaNASAencollaborationaveclasociétéPillsbury,pourpouvoirgarantirlasécuritédesalimentsdesastronautesenvoyésdansl'espace.Laprincipaleapplicationdecesystèmed'organisationd 'AssurancedelaQual itérestelamaîtrised elaqu alitémicrobiologiquedesproduitsalimentaires.HACCPreposesurseptprincipesetdouzeétapesdontlesdernièresétapescorrespondentauxseptprincipesdelaméthode,précédésdecinqétapespréliminairesdestinéesàcollectertouteslesinformationsnécessairesàl'accomplissementdesfameuxseptprincipes: Principe1:Effectueruneanalysedesrisquesetidentifierlesmesurespréventivespourchaqueétapeduprocessus; Principe2:Déterminerlespointscritiquesdecontrôle(CCP) Principe3:Fixerleoulesseuil(s)critique(s); Principe4:MettreenplaceunsystèmedesurveillancepermettantdemaîtriserlesCCP; Principe5:Déterminerlesmesurescorrectivesàprendrelorsquelasurveillancerelèvequ'unCCPdonnén'estpasmaîtrisé; Principe6:AppliquerdesprocéduresdevérificationafindeconfirmerquelesystèmeHACCPfonctionneefficacement; Principe7:Constituerundossierdanslequelfigureronttouteslesprocéduresettouslesrelevésconcernantcesprincipesetleurmiseenapplication.Lamétho deHACCP,démarchelog iqueetsystématique, étaitinitialementdestinéeau domainedel'agroalimentaire.Elles'estprogressivementétendueàd'autressecteurs,commel'industriechimiqueetpharmaceutique,dèslorsqu'ils'agit: Deconcevoiretdemettreenplaceunsystèmed'hygiène,pourunproduitouunprocédénouveau D'évalueroud'améliorerlesdispositionsexistantes,dansuneapprochecorrectiveetpréventiveàlafois,pourunproduitdéjàmissurlemarché.L'HACCPconstitueuneméthodespécifiqueetappropriéepouranalyserlesdangersetjustifierlespointscritiquesdesprocédéslesplussensibles.Ellepermetdefixerdesvaleurs-ciblesquidevrontêtresurveilléespourgarantirlaconstancedelaqualitéfinaledesproduits.[25][26]
385.5.6 L'arbrededéfaillance(FTA=FaultTreeAnalysis)L'arbrededéfaillan ceestunemé thodequipar td'unévénementfinali ndésirablep ourremonterverslescauses etconditionsdontlescombinaison ssontàl'origi ne .Ilvi seàreprésentergraphiquementl'ensembl edescombinaisonspossiblesquipeu ventinduirel'événementétudié.Achaqueniveaud'embrancheme ntdel'arbre,onpeutévaluerdescombinaison,descausesavecdesopérateurslogiques(et,ou).Onidentifieensuitelescausesracinesetlepland'actionsàmetteenoeuvre(mesurescorrectivesetpréventives)afindegarantirquelesaméliorationsprévuesrésoudrontleproblèmeetnemènerontpasàd'autreseffetsindésirables.Eneffetcetteméthodeestcourammentutiliséedanslesanalysesd'incidentsqualité(analysedesréclamations,lesdéfautsproduits,lesdéfaillancesdeprocessoudeconception).Lamiseenoeuvre préalabled'autresmé thodesd'analysedesrisquesdetypeinductif( HACCP,AMDEC,HAZOP)facili tegrandementlareche rchedesdéfaillances pourl'élaborationdel'arbre.[24]Figure15:Structuredel'arbrededéfaillance
40Lemanagementdurisqueintervientaujourd'huicommeunoutilessentieldanslesdifférentesactivitéspharmaceutiques.Baséesurlaconnaissancescientifiqueetlacompréhensiondesinteractionsentreleprocédéde fabricationetlaqu alitéattendu eduproduit,sonimplémentationauniveauduproduitetduprocédépermetd'assurerlamaîtrisedesrisquesliésaupatient.Applicableàchacunedesétapesducycledevieduproduit,cettedémarchevients'interfacerdirectementaveclesapprochesdeQualitybyDesign(ICHQ8).SelonlaFDA,lesdeuxapprochesprimordialespourlesinspectionsréglementairessont: L'approche"SystèmesQualité"dontlesdéviationssontlaprincipaleported'entréepourl'analysedusystèmequalité L'approche"Risk-Based".Ils'agitdegérercorrectementlesdéviations,demenerdesinvestigationsrobustesetdemettreenoeuvredesCAPAefficacesafindemaîtriserlesrisques.Lebutestdedémon trerauxauto ritésque l'onmaîtr iselesr isquesafind'augmenterlaconfianceetdiminuerlesfréquencesdesinspections.5.6 ICHQ10"PharmaceuticalQualitySystem"(PQS)ICHQ10correspondauxdernierstravauxdansledomainedelaqualitéquiviennentrenforcerlesexigencesentermedeSystèmedeManagementdelaQualitéetpromouvoirunsystèmed'améliorationcontinuedanslalignéedelanormeISO9001version2000.L'ISO9001n'étantpastoutàfai tadaptéeaux ex igencesp harmaceutiques,i létaitnéce ssairedecréerunréférentielpropre,s'appuyantsurl alogiqueISO9001.Aprèsavoiraétéintégré danslanouvellePartieIIIdesGMPEurope,l'ICHQ10vientdevoirsesrecommandationsintégréesdanslechapitre1desGMPEuropeentantqu'exigences.LalignedirectriceICHQ10eststructuréeen4chapitres,unglossaireetdeuxannexes: Chapitre1"LeSystèmeQualitéPharmaceutique" Chapitre2"Responsabilitédeladirection" Chapitre3"Améliorationcontinuedelaperformancedesprocessusetdelaqualitéduproduit" Chapitre3"AméliorationcontinueduSystèmeQualitéPharmaceutique"Samise enplacetoutaulong ducycledev iedupro duitdoitfaciliter l'innovation,l'améliorationcontinueetrenforcerle lienentrelesac tivitésdedéveloppementpharmaceutiqueetdefabrication.Ilestbasésuruneapprocheplusscientifiqueincluantlagestiondesconnaissancesetlagestiondesrisquesqualitéàtouslesstadesdelavieduproduit.
41LespiliersduPQS: Systèmedesurveillancedelaperformanceprocédéetdelaqualitéproduit Systèmed'actionscorrectivesetd'actionspréventives Systèmedegestiondeschangements Revuedeladirectionsurlaperformancedesprocédésetdelaqualitéproduit.L'annexesoulignelefaitquel'utilisationconjointedeQ8,Q9etQ10permetdebénéficierd'opportunitésdanslecontexteréglementaire"tiesitalltogether")ICHQ10ICHQ9Managementdesrisquesqualité(QualityRiskManagement)Gestiondesconnaissances(KnowledgeManagement)SystèmedesurveillancedelaperformancedesprocessusetdelaqualitédesproduitsSystèmed'ActionsCorrectivesetd'ActionsPréventives(CAPA)SystèmedemaîtrisedeschangementsRevuedeladirectionResponsabilitésdelaDirection(ManagementResponsabilities)Facilitateurs(Enablers)ÉlémentsduPQSConnaissance(Knowledge)ConnaissancedesrisquesQualitéBPF(GMP)DécouverteDéveloppementPharmaceutiqueTransfertdestechnologiesProductioncommercialeArrêtproduitAMMICHQ8R2DéveloppementPharmaceutique(PharmaceuticalDevelopment)Figure16:DiagrammedumodèleICHQ10
42Partie2:Maîtrisedeschangements ouChangeControl1 DéfinitionsLesproduitsfabriquésdansuneindustriepharmaceutiquedoiventêtreenconformitéaveclesexigencespharmaceutiquesetréglementairestoutaulongdeleurvie.Or,danslaréalitéquotidiennedufonctionnementnormald'uneentreprise,ilarrivequ'ilyaitdesmodifications,desdéviations,parrapportauxréférentielsappliqués.Ilestimportantpourl'entreprisederapidementévaluerlesincidencesetconséquencesdecesactespouridentifierlessuitesàdonneretlescontraintesréglementairesquivontendécouler.1.1 LesdéviationsUnedéviationestunécartparrapportàcequiaétépréétabli.Ils'agitd'unnon-respectinvolontaire,uneentorsenonplanifiée,imprévue,limitéedansletemps.ToutedéviationquiserépèteouquinécessiteraitdesmesuresdurablesenvuedesonéliminationrelèveducadredelagestiondesmodificationsouChangeControl.Cesmodificationsvontdu"mini-projet"auprojetàpartentièreetpeuventavoiruneinfluenceCritique,Majeure,MineuresurlaQUALITÉ.1.2 Lamaîtrisedeschangements:domained'applicationOntrouvedansleglossairedesBPF2011/8bis:Lamaitrisedeschangementsestun"systèmeformelparlequeldesreprésentantsqualitédesdisciplinesconcernéesexaminentles changementsproposésoueffectifss usceptiblesdemodifierlestatutvalidédesinstallations,systèmes,équipementsouprocédés.L'objectifestdedéterminerlesmesurespouvants'avérernécessairespourgarantiretdémontrerquelavaliditédusystèmeperdure."LeChange Controlestuneexi genceréglementairemis eenavant partoutesles agencesréglementairesinternationalescommeseule tuniquemoyendegarantirlamaîtrisedes procédésetlaqualitéproduit.Eneffet,avanttoutemiseenplace,lechangementportantsurlafabrication,leconditionnement,lesarticlesdeconditionnement,lecontrôle,lestockagedetoutproduitfabriquéetcontrôlésurlesite,doitêtreévaluéetautorisé.
43Lesystèmedemaîtrisedeschangementconsisteàévaluerlesimpactséventuelssurlaqualitéduprodui tetlarepr oductibilitéduprocédémaiségalement surl'hygiène,lasécuritéetl'environnement,lesBPF,lavalidationetlesenregistrementsréglementaires.Ceprocessusdoitêtremaîtrisécarc'estluiquigarantitquelesautresprocessusvontcontinueràêtremaîtrisés.Toutchangemen tnondéclaréetnongéréest uneentorseauxobligati onsdel'IndustriePharmaceutique:BPF,cGMP,RecommandationsFDA. C'estpourquoil esystèmechangecontrolesttoujoursinspectéparlesautoritéscompétentes,maisaussilorsdesauditsdugroupeoulesauditsdeslaboratoiresdonneursd'ordre.2 ICHQ10ICHQ10proposed'étendrelesconnaissancesàtraverslesdifférentsservicesdel'entreprise.Cettemodificationdéfinituneapprocheglobaleàtoutlecycledevieduproduitainsiqu'uneunevisoncommuneetunecollaborationentrelesentités.Lagestiondelaconnaissance(KnowledgeManagement)décritlessystèmesquifacilitentlacréationetlemaintiend'unétatdecontrôledelaperformancedesprocessusetlaqualitédesproduits.Danscecontexte,ledéploiementdelagestiondesrisques(QualityRiskManagement)estrequis.L'utilisationduQRMdoitêtresystématiquepouridentifieretmaîtriserlesrisques(patient).Pourassurerl'innovationetl'améliorationcontinue,"4PQSelements»del'ICHQ10étendentlaQualitéau-delàdesprocessusGMP.Parmiles"4PQSelements»,onretrouvelesystèmedemaîtrisedeschangementsdéfinicomme"L'innovation,l'améliorationcontinue,lesrésultatsobtenusparlasurveillancedelaperformanceduprocédéetlaqualitéduproduitetlesCAPAconduisentauxchangements.Afind'évaluer,amélioreretmettreenplacecorrectementceschangements,uneentreprisedoitbénéficierd'unsystèmeefficacedemaîtrisedeschangements.Ilyagénéralementdesdifférencesd'exigencesdanslesprocessusdemaîtrisedeschangements,avantlasoumissionréglementaireinitialemaisaussiaprès,lorsquedesmodificationsaudossierréglementairesontrequisesenapplicationdesexigencesrégionales".Enfonctiondel'étapeducycledevieduproduit,leprocessusdemaîtrisedeschangementsdoitinclurelesélémentssuivants,etcedemanièreappropriée: Lagesti ondurisquequalité.Elledoitêtreutili séepourév aluerleschangementsproposés.Leniveaud'effortàfournirainsiquelesformalitésdel'évaluationdoiventêtreenrapportavecleniveaudurisque Leschangemen tsproposésdoiventêtreévalués enfonctiondel'AMM,doivent prendreenconsidération l'espaced econception-sidétermi né-ainsiquela
44compréhensiondupro cédéetd uproduit.Lanécessitéou nond 'undépôt devariationsd'AMMoud'unedemanded'autorisationdemodificationtechniqueauprèsdesautoritéscompétentesdoitêtreévaluéeenapplicationdesexigencesrégionales.Anoterque,selon l'ICHQ8etd' unpoi ntdevuedese xigencesrégle mentaires, desopérationsmenéesauseind'u nespacedeconception existan tnesontpasconsidéréescommeétantunchangement.Cependant,d'unpointdevuedusystèmequalitépharmaceutique, l'ensembledeschangementsdoitê treévaluéaus eindusystèmedemaîtrisedeschangementsdel'entreprise; Leschangementsproposésdoiventêtreévaluésparuneéquiped'experts,regroupantlesexpertis esetconnaissancesdetousless ecteurs pertinents(parexemple,ledéveloppementpharmaceutique,la production,l'assurancequalité,lesaffaire smédicalesetréglementaires),afindes'assurerqu'ilssonttechniquementjustifiés.Lescritèresd'évaluationprospectived'unchangementproposédoiventêtredéfinis. Uneévaluationduchangementdoitêtrefaitedèssamiseenoeuvreetce,afindes'assurerquelesobj ectifsattendus soientatteintsetqu'iln' existe pasd'impactdélétèresurlaqualitéduproduit.DéveloppementpharmaceutiqueTransfertdetechnologiesFabricationcommercialeArrêtduproduitLeschangementssontunepartieinhérenteaudéveloppementdesprocessus.Ilsdoiventêtredocumentés;lesformalitésduprocessusdemaîtrisedeschangementsdoiventêtresconsistantsaveclestadededéveloppementpharmaceutique.LesystèmedemaîtrisedeschangementsdoitfournirunegestionetunedocumentationdesajustementsréaliséssurlesprocessusdurantlesactivitésdetransfertdetechnologiesUnsystèmeétablidemaîtrisedeschangementsdoitêtremisenplacepourlafabricationcommerciale.Unesupervisionparledépartementqualitédoitfournirl'assurancedel'utilisationappropriéedesapprochesscientifiquesetbaséessurlesrisquesToutchangementeffectuéaprèsl'arrêtdecommercialisationd'unproduitdoitêtrefaitautraversd'unsystèmeappropriédemaîtrisedeschangements.Tableau3:Applicationdusystèmedegestiondeschangementstoutaulongducycleduproduit
453 Lesétapesd'unedemandedechangement3.1 CréationLorsqu'unchangementestàmettreenplacedansunservice,lecréateurseralapersonneenchargedesuivreleprojetjusqu'àsamiseenplaceetclôture.Avantlaformalisationd'unedemandedechangement,ildoitréunirtouteslesinformationspréalables,nécessairespourévaluerlechangement.Ilorganisedesgroupesderéflexion,communiqueaveclesdifférentsinterlocuteurs,mènedesanalysesderisqueetrassembletouteladocumentationpermettantdejustifierlechangement(courriers,justificatifstechniques,plans,etc.).Ilpeutensuitedécriresademande: L'étatexistantetl'étatfutur, Justificatifduchangement, Lestravauxàmettreenplaceavecdesétapesénumérées, Laplanificationdestravauxetlenomdesintervenantsimpliquésdanscestravaux.3.2 EvaluationdelademandedechangementToutchangement,avantd'êtremisenplace,doitêtreévaluéparuncomitéd'expertsafindemesurerlesimpactspotentie lsdirectsouindirectssurlaqualité dupro duitetsurlaconformitéréglementaire.LeComitéd'évaluatio nestconstituéd'expertsprov enantdesservicesAssurance Qualité,Réglementaire,ValidationetHSES.Ilsdoiventêtrequalifiés,avoirl'expérienceetl'autoritépourévaluerl'importanceetl'acceptabilitéduchangementproposé.Chacunapportesonexpertise etseprononcequantàl'acceptationdeladem andede changement(lecontenu,lapertinence)etpeutéventuellementdemanderdescomplémentsd'informations.Ilsdoiventtenircomptedesrépercussionssur: laqualitédesproduits, lesBPFsenvigueur, lavalidationetrevalidation, lesréglementationsetleslégislationsapplicablesLagestiondelaconnaissance,préconiséeparlePQSdel'ICHQ10etainsiparICHQ9etICHQ8,estunélémentmajeurpourassurerlamaîtriseduprocessusdesCCetpourévaluerlesimpactsdeschangementssurlaqualitéduproduit,lasécuritédupatientetledossierd'AMM.
46Dansunprem iertemps, l'approcheQbD(ICHQ8)metl'ac centsurlesproduits, lacompréhensionetlecontrôledesprocessus.Cetteconnaissanceestbaséesurdesprincipesscientifiquesetdegestiondurisquequalité.Deplus,l'espacedeconceptionpermetuneflexibilitéréglementairequantauxvariationsquepourraientengendrerlesmodifications.Dansunsecondtemps,l'utilisationefficacedesoutilsdegestiondesrisques(ICHQ9)àtraverslecycledechangementpermetde: Mesurerlesimpactsparlaprobabilité,lagravité,ladétectabilité Utiliserdesconnaissan cesantérieures-ledévelo ppement,lafabricationd'autresemplacements,lessimilitudesavecd'autresproduits Comprendrel'adéquationdescontrôlesLemanagementdurisquequalitépeutêtreappliquéàlafoisdemanièreproactive,lorsdelamiseenplaced'unnouveauproduitparexemple,etrétrospective,lorsdemodificationdescaractéristiquesd'unproduitdéjàenplace.Lesdifférentsoutilspermettantd'effectuerdesanalysesderisqueavantlamiseenplacedechangementsontuneplaceimportantelorsdel'évaluationduchangement.Ilspermettentdedémontrerquelesimpactsduchangementsurlaqualitéduproduitetlesrisquesassociésontétéanticipés,définis,analysés,etainsiserontmaîtrisés.Lesexperts s'appuientsurcetteanal ysepours'assurerqueles risquesenco urussontacceptables.3.3 SuivietclôtureLesuividupland'acti onestde laresponsabilitéducréateur,maischaque personneestresponsabledesonaction("travail").Ledossierestcloslorsquel'ensembledestravaux(actionsbloquantesetnonbloquantes)estachevéetréalisédanslesconditionsprévuesetladocumentationjointeaudossier.
Préparaondelademande
• groupedetravailsurlechangement• Analysedesrisquesqualité• Documentaon,historique,arclesscienfiques
Créaon
• informaonsurletypedechangement:• Naturedelamodificaon• situaoncourante• situaonproposée• jusficaonduchangement• informaonsurlesproduitsconcernés...
Evaluaondesimpacts
• ExpertRéglementaire• ExpertQualité• Expertproducon/validaon• ExpertHSESApprobaonetPland'acon
• Elaboraonduplandesaconsàréaliserpardifférentsacteurs• Approbaonduplanparlesexperts• Prisedeconnaissancedesaconsàréaliserpourchacundesacteursconcernésetapprobaon
Suivietclôture
• Réalisaonetclôturedesaconsparlesacteursconcernés• Siaconsbloquantesavantmiseenplaceduchangement,approbaondesexpertspourautorisaondedémarrageexigée• Unefoistouteslesaconsréalisées,ladocumentaonsrenseignéesetjointesaudossier,clôturedudossier.
484 Lescritèresdemodifications4.1 Lesraisonsscientifiques,techniquesetéconomiquesLesprogrèsdelascienceetlesévolutionstechniquessontuncritèredemodificationdesméthodesdefabricationetdecontrôle,déposéesinitialementdansledossierd'AMM.Letitulairedel'AMMdoitintroduirecesmodificationsetsoumettreleprojetauxautorités,pourquelemédicamentsoitfabriquéetcontrôléselonlesméthodesscientifiquesreconnues.Lesprogrèsparticipentàl'améliorationdelaproductivité,deladétectabilitéetdelafiabilité,parledév eloppeme ntdeméthodesplusprécises,plusrapide s,moins couteusesetautomatiséesCetteaméliorations'effectueautravers: dechangementsd'équipementsplusperformantsoudechangementsd'organisation,permettantunemeilleuredétectabilitéetfiabilitédesprocessus. dudéveloppementdeméthodesplusprécises,plus rapides,moins couteuseetautomatisées. d'harmoniserlesméthodesdecontrôledulaboratoireCommeçapeutêtrel ecasp ourdesméthodes analytiquesouencor epourlessystèmesinformatiques.Eneffet,aujourd'huipresquelatotalitédesinstrumentsdetravailsontgérésvialessy stèmesinform atiques.Ilpeuts'agirdes outilsdegestiondesstocksoudeladocumentation,leséquipementsdeproductionoudecontrôle.LaLD11desBPF"systèmesinformatisés"prévoitlavalidationdesorteque"laqualitéduproduitoul'assurancedelaqualiténesoitpasaffectée",c'estpourquoiunemodificationsurunsystèmeinformatisédoitsegérercommetoutautremodificationetaveclamêmerigueur.5 LesimpactsdesmodificationsUnétablissementdeproductions'occupedelafabricationdesmédicaments.Lesdifférentesopérationsdeproductioncomp rennentl' achatetlecontrôledesmatièresp remièresetarticlesdeconditionnement,lafabricationdesmédicaments,leconditionnement,lecontrôledelaqualitéduproduitfini,lalibérationdeslotsfabriquésetlestockagedesmédicamentsenattentedeleur distributi on.Toutescesac tivitéssontencadréesparuncontexteréglementairebienprécis.Ilyaunimpactréglementairelorsquelamiseenapplicationduchangementnécessiteaupréalableunemodificationdesdossiersréglementairesenregistrés.
495.1 Lesimpactsentrel'organismeetlesfournisseursL'établissementpharmaceutiquesedoitdedéf inir,àtraversunappeld'offre,diff érentsfournisseurspourunemêmematière.Cettepolitiquepermetd'anticiperessentiellementlesaléasd'approvisionnementdesmatières.Unchangementdefournisseurnécessitel'agrémentdecenouveaufournisseuretdesauditsdel'établissementsontréalisés.Lesfournisseursetlessous-traitantssubissentlemêmetypedecontrainteséconomiquesquel'établissementpharmaceutiqueetdoiv entégalements'adapteraux progrès.Les modificationsapportéessurlesprocédé sousurlesmatièrespre mièresetarti clesdeconditionnementdufournisseur,peuventavoirunimpactindirectsurleproduitfabriquéparledonneurd'ordre.Ilestdoncnécessaired'établirdescahiersdeschargesetdescontratsclairs,avecenparticuli er,unengag ementfour nisseurimpliquantl'obligationded éclarertoutemodification.Desétudesdefaisabilitéserontmenéespourvérifierque lechangementsoitacceptable. Cesontdesessais,àpartird'échantillons,deformulationmaisaussidesessaisdemachinabilité.5.2 Lesimpactssurl'autorisationd'ouverturedel'établissementDèslorsqu' unemodification necorrespondpasàl 'autorisationd'ouverturedel'établissementpharmaceutiqueémiseparl'ANSMilfautledéclarer.Selonl'articleL51 24-3du CSP[5]:"toutemodificati onsubstantielledesélémentsdel'autorisationinitialeestsubordonnée àuneautorisationpréalab le.Undé cretenConseild'Etatfixeles casdemodific ationsubstantiel ledel' autorisation initiale.Lesautresmodificationsfontl'objetd'unedéclaration."Lesmodificationsdedemanded'ouverturedontilfautteni rcompte sontalorstoutesl esmodifications(e xtensionou suppressiond'u neactivitéparexemple) visàvis del'autorisationinitialeobten ueàl'ouver ture del'établissementpharmaceutiqueainsiqueles modificationsadministrativesdécritesdansl'articleR.5124-10-1duCSP.ArticleR.5124-10-2duCSPprécisequetoutemodificationautrequecellesmentionnéesdanslesarticlesprécédentetdoncnonsoumiseàunedemandepréalable,doitfairel'objetd'unedéclarationdansl'étatannueldel'établissementenvoyéàl'ANSM.Lorsdel'introductiond'unnouveauproduitsurlesitedefabrication,toutel'organisationestàrevoirentrainanttoutessortesdemodification.
505.3 Lesimpactssurl'autorisationdemisesurlemarché(AMM)5.3.1 NotiondevariationselonleCSPUnevariationcorrespondàlamodificationdestermesd'uneAMM.Elleestdéfiniecommetoutemodificationapportéeauxélémentsproduitsàl'appuidelademanded'autorisationtelsqu'ilsseprésentaientaumomentdeladélivrancedel'autorisationdemisesurlemarchéouàlasui ted esmod ificationsdéjàap prouvées,po urautantquenesoitpasrequisel'introductiond'unenouvelledemanded'autorisationdemisesurlemarchéconformémentàl'articleR.5121-41-1.[5]5.3.2 LesvariationsselonleréférentieleuropéenLesvariations Européennedécritesdans lerèglementCEN°1234/2008dela CommissionEuropéennedu24Novembre2008, etreprise danslag uideline(2010/C17/01)delaCommissionEuropéenne,sontclassé esentroistypesselo nlescondition sprquotesdbs_dbs6.pdfusesText_12
[PDF] guides méthodologiques de l'ordre des experts comptables
[PDF] guigoz
[PDF] guilhon 1998
[PDF] guillaume de seynes biographie
[PDF] guillaume de seynes hermès
[PDF] guinée bissau
[PDF] guinée carte
[PDF] guller guller marseille
[PDF] gup définition
[PDF] gup parkour
[PDF] gup politique de la ville
[PDF] gurley et shaw intermédiation financière
[PDF] gutenberg
[PDF] guy dauphin environnement
