 BPF PARTIE III : SYSTEME QUALITE PHARMACEUTIQUE (ICH Q10)
BPF PARTIE III : SYSTEME QUALITE PHARMACEUTIQUE (ICH Q10)
Ce document établit une nouvelle ligne directrice tripartite ICH qui décrit un modèle de système de management de la qualité efficace pour l'industrie
 Q3D : Directive concernant les impuretés élémentaires
Q3D : Directive concernant les impuretés élémentaires
29 janv. 2016 ... ICH. Ce processus aboutira à la modification ou si les révisions à ... Getting to the bottom of arsenic standards and guidelines. Environ ...
 PARTIE III : GESTION DU RISQUE QUALITÉ (ICH Q9)
PARTIE III : GESTION DU RISQUE QUALITÉ (ICH Q9)
ICH Q8 Développement pharmaceutique. ISO/IEC Guide 73:2002 – Gestion du Guidelines for Failure Modes and Effects Analysis (FMEA) for Medical Devices ...
 Ladoption pour lICH ligne directrice: Q3A(R2): Présence d
Ladoption pour lICH ligne directrice: Q3A(R2): Présence d
5 juin 2015 also available in English under the following Title: Guidance Document: International ... Human Use (ICH) Impurities in New Drug Substances; ICH ...
 LES ICH ET LA RÉGLEMENTATION PHARMACEUTIQUE LA
LES ICH ET LA RÉGLEMENTATION PHARMACEUTIQUE LA
13 mai 2017 L'application des guidelines ICH pour toutes les évaluations techniques. ... la SFSTP (Société Française des Sciences et des Techniques ...
 Implémentation de la guideline ICH Q3D au sein dun site de
Implémentation de la guideline ICH Q3D au sein dun site de
10 janv. 2019 The documents may come from teaching and research institutions in France or abroad or from public or private research centers. L'archive ...
 ICH Topic Q 6 B Specifications: Test Procedures and Acceptance
ICH Topic Q 6 B Specifications: Test Procedures and Acceptance
TEST PROCEDURES AND ACCEPTANCE CRITERIA FOR. BIOTECHNOLOGICAL/BIOLOGICAL PRODUCTS. ICH Harmonised Tripartite Guideline. Table of Contents. Page.
 GUIDE RELATIF A LA BIOEQUIVALENCE DES MEDICAMENTS A
GUIDE RELATIF A LA BIOEQUIVALENCE DES MEDICAMENTS A
12 janv. 2018 - Les guidelines CPMP : 'Guideline On The Investigation Of Bioequivalence'. - Les guidelines ICH M4 intitulées 'Organisation Of The Common ...
 ICH Topic Q 1 A (R2) Stability Testing of new Drug Substances and
ICH Topic Q 1 A (R2) Stability Testing of new Drug Substances and
The texts on test procedures etc. have been brought in line with the Q6A guideline. Relevant cross-references to other ICH guidelines have been introduced. •
 Guide bonnes pratiques de fabrication
Guide bonnes pratiques de fabrication
6 mai 2019 ... Guidelines for Failure Modes and Effects Analysis (FMEA) for Medical ... ICH Q9. Les outils de gestion du risque de la qualité tels que ceux ...
 BPF PARTIE III : SYSTEME QUALITE PHARMACEUTIQUE (ICH Q10)
BPF PARTIE III : SYSTEME QUALITE PHARMACEUTIQUE (ICH Q10)
Ce document établit une nouvelle ligne directrice tripartite ICH qui décrit un modèle de système de management de la qualité efficace pour l'industrie
 DICH Q8 à Q10: la maîtrise des changements dans un système de
DICH Q8 à Q10: la maîtrise des changements dans un système de
19 jan. 2015 recherche français ou étrangers des laboratoires ... Les GMP Guidelines
 addenda intégré de le6(r1) de lich : ligne directrice pour de bonnes
addenda intégré de le6(r1) de lich : ligne directrice pour de bonnes
Ces lignes directrices devraient être lues en parallèle avec d'autres directives de l'ICH concernant la réalisation d'essais cliniques [par exemple E2A (
 LES ICH ET LA RÉGLEMENTATION PHARMACEUTIQUE LA
LES ICH ET LA RÉGLEMENTATION PHARMACEUTIQUE LA
13 mai 2017 L'application des guidelines ICH pour toutes les évaluations techniques. ... la SFSTP (Société Française des Sciences et des Techniques ...
 ICH Topic Q 1 A (R2) Stability Testing of new Drug Substances and
ICH Topic Q 1 A (R2) Stability Testing of new Drug Substances and
The texts on test procedures etc. have been brought in line with the Q6A guideline. Relevant cross-references to other ICH guidelines have been introduced. •
 PARTIE III : GESTION DU RISQUE QUALITÉ (ICH Q9)
PARTIE III : GESTION DU RISQUE QUALITÉ (ICH Q9)
Guidelines for Failure Modes and Effects Analysis (FMEA) for Medical Devices 2003 Dyadem. Press
 ICH Topic Q 6 B Specifications: Test Procedures and Acceptance
ICH Topic Q 6 B Specifications: Test Procedures and Acceptance
SPECIFICATIONS: TEST PROCEDURES AND ACCEPTANCE CRITERIA FOR. BIOTECHNOLOGICAL/BIOLOGICAL PRODUCTS. ICH Harmonised Tripartite Guideline. Table of Contents.
 Q3C (R8) Step 5 - impurities: guideline for residual solvents
Q3C (R8) Step 5 - impurities: guideline for residual solvents
20 mai 2021 ICH Guideline Residual Solvents. Pharmeuropa. 1997;Suppl 9:57. 2. Tyl RW France KA
 Ladoption pour lICH ligne directrice: Q3A(R2): Présence d
Ladoption pour lICH ligne directrice: Q3A(R2): Présence d
5 jui. 2015 Requirements for the Registration of Pharmaceuticals for. Human Use (l'ICH): Présence d'impuretés dans les nouvelles.
 La réglementation pharmaceutique et les dossiers dautorisation de
La réglementation pharmaceutique et les dossiers dautorisation de
14 mar. 2018 recherche français ou étrangers des laboratoires ... parties ainsi que les références aux guidelines ICH ou ASEAN qui doivent être suivies.
 E6(R2): Addenda intégré de bonnes pratiques cliniques - ICH GCP
E6(R2): Addenda intégré de bonnes pratiques cliniques - ICH GCP
En adoptant cette ligne directrice de l’ICH Santé Canada fait siens les principes et les pratiques qui y sont énoncés Ce document doit être lu en parallèle avec la lettre d’accompagnement et les sections pertinentes des autres lignes directrices applicables à Santé Canada
 PARTIE III : GESTION DU RISQUE QUALITÉ (ICH Q9) - AFMPS
PARTIE III : GESTION DU RISQUE QUALITÉ (ICH Q9) - AFMPS
Il sert de base ou de document ressource indépendamment des autres documents qualité ICH tout en les étayant et complète les pratiques exigences normes et lignes directrices qualité en vigueur dans l’industrie pharmaceutique et dans le domaine réglementaire
 BPF PARTIE III : SYSTEME QUALITE PHARMACEUTIQUE (ICH Q10) - AFMPS
BPF PARTIE III : SYSTEME QUALITE PHARMACEUTIQUE (ICH Q10) - AFMPS
de mettre en œuvre l’ICH Q10 avec succès et de manière efficace Ces facilitateurs favoriseront la réalisation des objectifs décrits en section 1 5 en apportant les moyens nécessaires aux décisions basées sur les risques et les sciences et qui concernent la qualité des produits
 Q12 Annexes - ICH
Q12 Annexes - ICH
ICH HARMONISED GUIDELINE TECHNICAL AND REGULATORY CONSIDERATIONS FOR PHARMACEUTICAL PRODUCT LIFECYCLE MANAGEMENT Q12 Annexes Final version Adopted on 20 November 2019 This document has been developed by the appropriate ICH Expert Working Group and has been subject to consultation by the regulatory parties in accordance with the ICH Process
 IMPURITIES GUIDELINE FOR RESIDUAL S Q3C(R8) - ICH
IMPURITIES GUIDELINE FOR RESIDUAL S Q3C(R8) - ICH
ICH HARMONISED GUIDELINE IMPURITIES: GUIDELINE FORRESIDUAL SOLVENTS Q3C(R8) Current Step 4 version dated 22 April 2021 This Guideline has been developed by the appropriate ICH Expert Working Group and has been subject to consultation by the regulatory parties in accordance with the ICH Process
 E6: Les bonnes pratiques cliniques: Directives consolidées
E6: Les bonnes pratiques cliniques: Directives consolidées
Ligne directrice de l’ICH1 E6: Les bonnes pratiques cliniques: directives consolidées ERRATUM en Anglais et Français Les versions finales anglaise et française de la ligne directrice de l’ ICH adopté par Santé Canada: Les bonnes pratiques cliniques ont été revisées dûs à des corrections éditoriales post-étape 4 par le comité
 Q12 - ICH
Q12 - ICH
The concepts outlined in prior ICH Quality Guidelines (ICH Q8 Q9 Q10 and Q11) provide opportunities for science and risk-based approaches for drug development and risk-based regulatory decisions These guidelines are valuable in the assessment of Chemistry Manufacturing and Controls (CMC) changes across the product lifecycle
 Q8(R2) - ICH
Q8(R2) - ICH
ICH HARMONISED TRIPARTITE GUIDELINE PHARMACEUTICAL DEVELOPMENT Q8(R2) Current Step 4version dated August 2009 This Guideline has been developed by the appropriate ICH Expert Working Group and has been subject to consultation by the regulatory parties in accordance with the ICH Process
 Q1A(R2) - ICH
Q1A(R2) - ICH
This Guideline has been developed by the appropriate ICH Expert Working Group and has been subject to consultation by the regulatory parties in accordance with the ICH Process At Step 4 of the Process the final draft is recommended for adoption to the regulatory bodies of the European Union Japan and USA Q1A(R2) Document History
 Q3D(R1) - ICH
Q3D(R1) - ICH
ICH HARMONISED GUIDELINE GUIDELINE FOR ELEMENTAL IMPURITIES Q3D(R1) Finalversion Adopted on 22 March 2019 This Guideline has been developed by the appropriate ICH Expert Working Group and has been subject to consultation by the regulatory parties in accordance with the ICH Process
 ICH guideline Q2(R2) on validation of analytical procedures
ICH guideline Q2(R2) on validation of analytical procedures
ICH Q2(R2) Guideline 1 1 1 INTRODUCTION 2 This guideline presents a discussion of elements for consideration during the validation of 3 analytical procedures included as part of registration applications submitted within the ICH 4 member regulatory authorities Q2(R2) provides guidance and recommendations on how to 5
 ICH guideline Q9 (R1) on quality risk management
ICH guideline Q9 (R1) on quality risk management
At Step 2 of the ICH Process a consensus draft text or guideline agreed by the appropriate ICH Expert Working Group is transmitted by the ICH Assembly to the regulatory authorities of the ICH regions for internal and external consultation according to national or regional procedures
 Searches related to guidelines ich en français filetype:pdf
Searches related to guidelines ich en français filetype:pdf
Past regular attendance in ICH meetings Past appointment of experts in WGs Application of ICH Guidelines Have implemented at least the following ICH Guidelines (“Tier 1”): Q1: Stability Testing Guidelines Q7: Good Manufacturing Practice Guide for Active Pharmaceutical Ingredients E6: Good Clinical Practice Guideline
PARTIE III :
GESTION DU RISQUE QUALITÉ (ICH Q9)
2Table de matières
1. Introduction ............................................................................................ 3
2.Champs d'application............................................................................... 3
3. Principes de la gestion du risque qualité.................................................. 4
4. Processus général de gestion du risque qualité....................................... 4
4.1. Responsabilités ..................................................................................... 5
4.2. Initiation d'un processus de gestion du risque qualité.................................. 5
4.3. Appréciation du risque............................................................................
54.4. Maîtrise/contrôle du risque...................................................................... 6
4.5. Communication relative au risque ............................................................ 7
4.6. Revue du risque........................................................................................ 7
5. Méthodologie de gestion du risque........................................................... 7
6. Intégration de la gestion du risque qualité aux activités de l'industrie et de la réglementation ............................................................................. 8 7.Définitions ............................................................................................. 9
8. Références .............................................................................................. 11
Annexe I : Méthodes et outils de gestion du risqueI.1 Méthodes de base pour faciliter la gestion du risque....................................... 12
I.2 Analyse des modes de défaillance et de leurs effets (AMDE) - Failure Mode EffectsAnalysis (FMEA)........................................................................................ 12
I.3 Analyse des modes de défaillance, de leurs effets et de leur criticité (AMDEC) -Failure Mode, Effects and Criticality Analysis (
FMECA) .................................... 12
I.4 Arbre des défaillances - Fault Tree Analysis (FTA) .......................................... 13
I.5 Analyse des dangers et maîtrise des points critiques (HACCP) - Hazard Analysis andCritical Control Points (HACCP) ................................................................... 12
I.6 Analyse de dangers-exploitabilité (HAZOP)Hazard Operability Analysis (HAZOP) 13I.7 Analyse préliminaire des dangers (PHA) -
Preliminary Hazard Analysis (PHA)..... 14
I.8 Classement et filtrage des risques - Risk ranking and filtering ........................ 14 I.9 Outils statistiques complémentaires - Supporting statistical tools ..................... 15 Annexe II: Exemples d'application de la gestion du risque qualité................. 16II.1 Intégration de la gestion du risque qualité dans les systèmes qualité................ 16
II.2 Intégration de la gestion du risque qualité par les autorités compétentes.......... 17
II.3 Intégration de la gestion du risque qualité dans le développement................... 17
II.4 La gestion du risque qualité pour les locaux, équipements et utilités................. 18
II.5 Gestion du risque qualité dans le cadre de la gestion des matières................... 19II.6 Gestion du risque qualité dans le cadre de la production................................. 19
II.7 Gestion du risque qualité dans le cadre des laboratoires de contrôle et des études destabilité. ................................................................................................................................ 20
II.8 Gestion du risque qualité dans le cadre du conditionnement et del'étiquetage.............................................................................................. 20
3 1.Introduction
Les principes de la gestion du risque sont utilisés efficacement dans de nombreux domaines des affaires et de l'administration, tels que la finance, les assurances, la santé au travail, la santé publique, la pharmacovigilance et par les autorités compétentes. Bien qu'il existe quelques exemples de l'utilisation de la gestion du risque qualité dans l'industrie pharmaceutique, ils sont limités et ne rendent pas dûment compte des possibilités offertes par la gestion du risque qualité. De plus, l'importance des systèmes qualité est reconnue dans l'industrie pharmaceutique et il devient évident que la gestion du risque qualité est une composante importante d'un système qualité efficace. Il est couramment admis que le risque se définit comme la combinaison de la probabilité d'occurrence d'un dommage et de sa gravité. Cependant, il est difficile d'atteindre un consensus parmi les parties prenantes quant à l'application de la gestion du risque, dans la mesure où la perception du dommage potentiel, l'évaluation de la probabilité d'occurrence et de la gravité peuvent être différentes. En ce qui concerne les produits pharmaceutiques, malgré la diversité des parties prenantes, parmi lesquels on trouve les patients, lesprofessionnels de la santé, ainsi que les autorités politiques et l'industrie, la protection du
patient par la gestion du risque qualité doit être considérée comme de première importance.
La fabrication et l'utilisation d'un médicament, y compris ses composants, entraînent nécessairement un certain degré de risque. Le risque qualité n'est qu'un des éléments du risque global. Il est important de comprendre que la qualité du produit doit être maintenue pendant tout le cycle de vie du produit, afin que les caractéristiques importantes pour la qualité du médicament restent conformes à celles déterminées lors des études cliniques. Une approche efficace de la gestion du risque qualité peut permettre de garantir un haut niveau de qualité du médicament pour le patient en donnant des moyens proactifs d'identification et de maîtrise des dommages potentiels pendant le développement et la fabrication. De plus, l'application de la gestion du risque qualité peut améliorer le processus décisionnel lorsqu'un problème qualité se pose. Une gestion efficace du risque qualité peut permettreune prise de décisions plus pertinentes et éclairées, donner aux autorités compétentes
des garanties accrues quant à la capacité d'une entreprise à traiter les risques potentiels et
peut influer sur l'étendue et le niveau de surveillance directe exercée par les autorités compétentes. L'objet du présent document est de proposer une approche systématique de la gestion du risque qualité. Il sert de base ou de document ressource indépendamment des autres documents qualité ICH tout en les étayant, et complète les pratiques, exigences, normes et lignes directrices qualité en vigueur dans l'industrie pharmaceutique et dans le domaine réglementaire. Il fournit en particulier des indications sur les principes et sur certains outils de gestiondu risque qualité pouvant permettre une prise de décision, basée sur le risque, plus efficace
et cohérente, à la fois par les autorités compétentes et par l'industrie, en ce qui concerne
la qualité des substances actives et des médicaments tout au long de leur cycle de vie. Il ne vise pas à susciter de nouvelles attentes au-delà des exigences réglementaires actuelles. Il n'est pas toujours approprié ni toujours nécessaire d'employer un processus formel de gestion du risque (à l'aide d'outils reconnus et/ou de procédures internes, par exemple, procédures opérationnelles). L'utilisation de processus informels de gestion des risques (basés sur des outils empiriques et/ou des procédures internes) peut également être considéré comme acceptable. Un usage approprié de la gestion du risque qualité peut faciliter, sans pour autant occulter, l'obligation pour l'industrie de se conformer aux exigences de la réglementation et ne remplace pas la communication entre l'industrie et les autorités compétentes. 2.Champs d'application
La présente ligne directrice fournit les principes et des exemples d'outils de gestion du risque 4qualité pouvant s'appliquer à différents aspects de la qualité pharmaceutique. Ces aspects
incluent notamment les étapes de développement, de fabrication, de distribution ainsi que l'inspection et la soumission/révision des procédés tout au long du cycle de vie des substances actives, des médicaments, des produits biologiques et biotechnologiques (y compris l'utilisation des matières premières, solvants, excipients, articles de conditionnement et étiquettes des médicaments, produits biologiques et de biotechnologie). 3.Principes de la gestion du risque qualité
Les deux principes fondamentaux de la gestion du risque qualité sont :• L'évaluation du risque qualité doit se baser sur la connaissance scientifique et, au final,
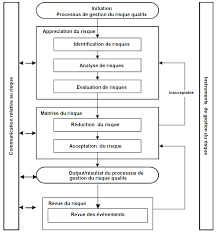
est étroitement liée à la protection des patients, et • Le degré d'effort, de formalisation et de documentation du processus de gestion du risque qualité doit être proportionné au niveau de risque considéré. 4. Processus général de gestion du risque qualité La gestion du risque qualité est un processus systématique d'évaluation, de maîtrise/contrôle, de communication et de surveillance des risques qualité du médicament tout au long du cycle de vie du produit. Un modèle de gestion du risque qualité estschématisé dans le diagramme (figure 1). D'autres modèles peuvent être utilisés. L'accent
mis sur chaque étape du diagramme peut varier d'un cas à l'autre, mais un processus robusteprendra en compte tous les éléments selon un niveau de détail adapté au risque considéré.
Figure
1. Aperçu d'un procédé de gestion du risque qualité classique
5Les étapes de décision ne sont pas indiqués dans le diagramme précédent car les décisions
peuvent intervenir à tout moment du procédé. Il peut s'agir de décisions de revenir à l'étape
précédente et de collecter des informations complémentaires, d'ajuster les modèles utilisés
ou même de clore le procédé de gestion du risque sur base des informations supportant une telle décision. Remarque : la mention " inacceptable » dans le diagramme ne fait pas seulement référenceà des exigences législatives ou réglementaires, mais aussi à la nécessité de revenir sur
quotesdbs_dbs7.pdfusesText_5[PDF] guides méthodologiques de l'ordre des experts comptables
[PDF] guigoz
[PDF] guilhon 1998
[PDF] guillaume de seynes biographie
[PDF] guillaume de seynes hermès
[PDF] guinée bissau
[PDF] guinée carte
[PDF] guller guller marseille
[PDF] gup définition
[PDF] gup parkour
[PDF] gup politique de la ville
[PDF] gurley et shaw intermédiation financière
[PDF] gutenberg
[PDF] guy dauphin environnement
