 Tous les exercices de Chimie MP-PSI-PT
Tous les exercices de Chimie MP-PSI-PT
pur et le diagramme binaire ressemble à la juxtaposition de deux diagrammes • Des corrigés complets
 Université Moulay Ismail
Université Moulay Ismail
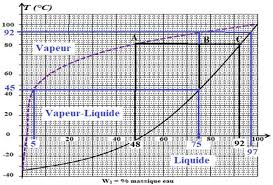
Exercice N° 3 -Diagramme binaire eau-ammoniac. Le diagramme liquide-vapeur isobare eau-ammoniac est représenté ci-dessous. On se propose d'étudier l
 TD4: Diagrammes TRC et TTT (Correction)
TD4: Diagrammes TRC et TTT (Correction)
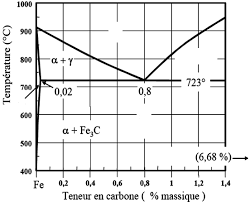
EXERCICE 2 : Soient les deux diagrammes TRC des nuances d'aciers 21CrMoV5-7 Q1- En supposant que cet acier obéit au diagramme binaire. Fe – C. Quels sont ...
 TD T5A Etude des équilibres liquide-vapeur des mélanges binaires
TD T5A Etude des équilibres liquide-vapeur des mélanges binaires
1/ Un mélange parfaitement miscible à l'état liquide de deux composés bout à température constante sous pression fixée. 2/ Le diagramme binaire liquide/vapeur d
 EL JOUHARI Exercices SMC5-M17-E3
EL JOUHARI Exercices SMC5-M17-E3
Recueil de quelques exercices de TD et Contrôles. Elément E3. A- DIAGRAMMES BINAIRES: EXERCICES RAPPELS. I- Etude du diagramme binaire solide- liquide Al2O3-BaO.
 Diagrammes de phase Exercices
Diagrammes de phase Exercices
On donne le diagramme de phase du mélange binaire bismuth-antimoine ci-dessous. Pour un alliage à 60%g d'antimoine déterminer la composition et la
 PSI Exercices Chimie Diagrammes binaires
PSI Exercices Chimie Diagrammes binaires
Exercice 1 : Diagramme binaire étain-bismuth. Le diagramme binaire isobare solide-liquide du système étain-bismuth est donné ci-dessous la composition.
 Chap. 2.
Chap. 2.
Exercice N°1 : Le cas du diagramme binaire Al-Cu. 1. Quel est le type de ce diagramme. 2. Indiquer le liquidus et le solidus. 3. Indiquer pour chaque région le
 CHAPITRES V-VI : DIAGRAMMES DEQUILIBRE (TD)
CHAPITRES V-VI : DIAGRAMMES DEQUILIBRE (TD)
d'exercices corrigés. Liquide. Pourcentage atomique de Si. Pourcentage massique Les proportions relatives des phases ne semblent pas respecter le diagramme ...
 Métallurgie : Cours et exercices corrigés
Métallurgie : Cours et exercices corrigés
diagramme binaire d'équilibre de phases. L'existence même des diagrammes d'équilibre découle des lois générales de la thermodynamique chimique. Les
 Tous les exercices de Chimie MP-PSI-PT
Tous les exercices de Chimie MP-PSI-PT
Les astérisques en marge des exercices indiquent le niveau de difficulté. pur et le diagramme binaire ressemble à la juxtaposition de deux diagrammes.
 Exercices de thermodynamique : diagrammes binaires
Exercices de thermodynamique : diagrammes binaires
P70) Construction et utilisation du diagramme binaire eau-toluène (à rendre) Diagrammes binaires : corrigé des exercices à rendre.
 Untitled
Untitled
Diagrammes binaires liquide-vapeur. EXERCICE AI Trace din diagramme LV. © Diagramme avec honoafedrape . Presente a maximum de temperature.
 Chap. 2.
Chap. 2.
Exercice N°1 : Le cas du diagramme binaire Al-Cu. 1. Quel est le type de ce diagramme. 2. Indiquer le liquidus et le solidus. 3. Indiquer pour chaque région le
 Recueil dexercices et de problèmes de Matériaux Métalliques
Recueil dexercices et de problèmes de Matériaux Métalliques
Le collecte de l'ensemble de ces exercices a été fait à partir de certains 1 - Quel est ce diagramme binaire le diagramme Fer-carbone ou le diagramme ...
 Diagrammes de Phases
Diagrammes de Phases
Le passage de la phase liquide à la phase solide s'appelle un changement de phase. Lorsqu'un métal pur en fusion est refroidi sous pression constante (pression.
 CHAPITRES V-VI : DIAGRAMMES DEQUILIBRE (TD)
CHAPITRES V-VI : DIAGRAMMES DEQUILIBRE (TD)
L'exercice sur les alliages pour le brasage permet de se familiariser avec l'utilisation des les diagrammes de phase binaires) ... d'exercices corrigés.
 Lexploitation dun diagramme binaire à solution solide Exemple de
Lexploitation dun diagramme binaire à solution solide Exemple de
1°) Indiquer les trajets des phases liquide et solide sur le diagramme. Corrigé de l'exercice : L'exploitation d'un diagramme binaire à solution solide.
 EQUILIBRE ENTRE PHASES DE SYSTEMES BINAIRES
EQUILIBRE ENTRE PHASES DE SYSTEMES BINAIRES
C'est donc la courbe limite d'existence de la vapeur. Exercices 1 : Savoir lire et exploiter les diagrammes binaires en terme de domaines. Décrire l'évolution
 Chimie PCSI
Chimie PCSI
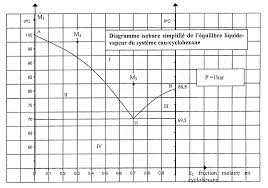
Equilibres binaires. Exercices d'entraînement. 1. Tracé d'un diagramme binaire LV. On considère un mélange de deux constituants A et B (A plus volatil que
 [PDF] Corrigé-TD-Binaires-LVpdf
[PDF] Corrigé-TD-Binaires-LVpdf
Diagrammes binaires liquide-vapeur EXERCICE A Trace din diagramme LV Diagramme avec housaziotrope Présente A maximum (intrachers intermoléculairs AB
 [PDF] Tous les exercices de Chimie MP-PSI-PT - ChercheInfo
[PDF] Tous les exercices de Chimie MP-PSI-PT - ChercheInfo
Exercice 3 1 Mélange binaire dioxygène-diazote (d'après Agrégation 2006) Le changement d'état des mélanges binaires O2-N2 s'étudie grâce au diagramme
 [PDF] EL JOUHARI Exercices SMC5-M17-E3
[PDF] EL JOUHARI Exercices SMC5-M17-E3
Recueil de quelques exercices de TD et Contrôles Elément E3 A- DIAGRAMMES BINAIRES: EXERCICES RAPPELS I- Etude du diagramme binaire solide- liquide
 [PDF] Diagrammes liquide – vapeur isobare et isotherme pour un mélange
[PDF] Diagrammes liquide – vapeur isobare et isotherme pour un mélange
Diagrammes liquide – vapeur isobare et isotherme pour un mélange A-B : corrigé 1 Lecture sur le diagramme isobare : le liquide qui bout à 45°C est de
 TD et Exercices corrigés Diagramme de Phases SMC Semestre 3 PDF
TD et Exercices corrigés Diagramme de Phases SMC Semestre 3 PDF
4 sept 2018 · Diagramme de Phases Exercices corrigés de Diagramme de phases SMC Semestre 3 PDF Exercices Diagramme de phases chimie SMC3 PDF à Télécharger
 [PDF] TD T5B Etude des équilibres solide-liquide des mélanges binaires
[PDF] TD T5B Etude des équilibres solide-liquide des mélanges binaires
Construire un diagramme isobare d'équilibre solide/liquide d'un mélange binaire à partir d'informations relatives aux courbes d'analyse thermique (T51)
 [PDF] Dernière série dexercices sur les diagrammes binaires
[PDF] Dernière série dexercices sur les diagrammes binaires
Le diagramme de cristallisation du binaire arsenic-zinc sous une pression de 1 bar est donné ci-dessous Il montre l'existence de deux composés définis de
 [PDF] TD BINAIRES 15-16
[PDF] TD BINAIRES 15-16
EXERCICE 2 a Voir diagramme ci-dessous Courbe de refroidissement La courbe rouge (1) de refroidissement correspond à la question posée ; la courbe (2)
 [PDF] CHAPITRES V-VI : DIAGRAMMES DEQUILIBRE (TD)
[PDF] CHAPITRES V-VI : DIAGRAMMES DEQUILIBRE (TD)
Réflexion sur le chemin de solidification L'exercice sur les alliages pour le brasage permet de se familiariser avec l'utilisation des diagrammes
Thermodynamique 2 :
Equilibres binaires
([HUŃLŃHV G·HQPUMvQHPHQP1. 7UMŃp G·XQ GLMJUMPPH NLQMLUH I9
On considère un mélange de deux constituants A et B (A plus volatil que B). On précise que A et B sont
miscibles en toutes proportions, mais que les mélanges liquides AB ne sont pas idéaux. Les interactions
pris séparément.1. Etablir l'allure du diagramme binaire en fonction de džB. Comment se nomme le point particulier du
diagramme ? Quelles sont les propriétés du mélange correspondant ?2. Donner l'allure des courbes de refroidissement de différents mélanges gazeux AB de manière à illustrer les
propriétés des différents domaines. On associera la variance du système à chaque portion de courbe.
illustration graphique de votre réponse utilisant le diagramme binaire tracé.2. Alliages or-argent
L'argent et l'or cristallisent en formant un alliage de substitution Au1-xAgx appelé "or pâle" ou "or vert" par les
orfèvres ; on admettra que ce mélange est idéal et se fait avec conservation des volumes.1. Hiéron, roi de Syracuse, fit faire une couronne par son orfèvre ; la densité de cette couronne, mesurée par
Archimède, était 17,1 et sa masse m = 4180 g. a) Quelle en était sa composition massique ? b) Quelle en était la composition molaire et la formule statistique Au1-xAgx ?2. L'argent et l'or sont miscibles en toutes proportions à l'état solide et forment un alliage de substitution
dont le diagramme binaire est donné ci-dessous. La température est en ordonnée et la fraction molaire en
argent en abscisse.On chauffe à la pression atmosphérique un alliage de masse totale égale à 1000 g dont la fraction molaire
en argent est 0,25. a) Quel est le nom des courbes de ce diagramme ? A quoi correspondent-elles ? b) Placer les espèces présentes dans les différentes zones du plan.c) A quelle température apparaît la première goutte de liquide et quelle est sa composition en fractions
molaires ?d) Déterminer la composition molaire et massique des différentes phases en présence à 1045 °C.
e) A T с 1010ΣC, on ajoute de maniğre isotherme de l'argent ă une masse m с 1000 g d'un mĠlange
dernier cristal de solide. Données : ʌ(Ag) с 10,5 g.cm-3 ʌ(Au) с 19,5 g.cm-3M(Ag) = 107,9 g.mol-1 M(Au) = 197,0 g.mol-1
3. GLMJUMPPH LVRNMUH j SMUPLU GHV ŃRXUNHV G·MQMO\VH POHUPLTXH
Le chlorure de sodium est parfois utilisé pour constituer des mélanges réfrigérants glace-sel. La figure suivante
en sel w, sous P = 1 bar.1. Tracer le diagramme binaire liquide isobare T = f(w) pour des mélanges eau-NaCl de fraction massique w
variant entre 0 et 0,25 en justifiant votre réponse.2. Quelle fraction massique minimale en sel faut-il choisir pour que le système soit encore liquide à - 15 °C ?
4. Diagramme binaire eau - acide nitrique
Le mélange acide nitrique - eau forme un
mélange binaire dont le diagramme isobare sous P = 1 bar est donné ci-dessous. La composition est donnée en fraction massique.1. Les constituants de ce mélange binaire
sont-ils miscibles à l'état liquide ?Comment nomme-t-on le mélange
correspondant au point A ? Quelles sont ses propriétés ? On considère un mélange liquide dont la composition est la suivante : nHNO3 + nH2O = 4 mol et nHNO3 = 0,3 mol. A quelle température apparaît la première bulle de vapeur ? Quelle est sa composition ? A quelle température disparaît la dernière goutte de liquide ?Quelle est sa composition ?
2. On porte ce mélange à T = 110°C. Quelles
sont les quantités de matière des phases en présence à cette température ?3. On effectue la distillation fractionnée de ce mélange liquide. Quel distillat obtient-on ? Quel résidu ?
Réflexion pratique / Vie quotidienne
5. Purification industrielle G·XQ ŃRPSRVp RUJMQLTXH
manipulation, 1,0 L d'eau a ĠtĠ introduit dans 50 L d'acĠtate de butyle pur. L'acĠtate de butyle et l'eau
massique en acétate de butyle est égale à 70 %. le pourcentage massique en acétate de butyle.2. Préciser le nom des courbes représentées.
4. Au cours de la distillation, on fait bouillir le mélange sous 1 atm et on récupère les vapeurs produites.
Yuelle masse d'acĠtate de butyle sera-t-il nécessaire de vaporiser du mélange liquide pour éliminer la
totalitĠ de l'eau introduite par mĠgarde ͍5. Une solution alternative consiste à introduire un desséchant dans le milieu, comme du sulfate de
Données :
- Masses molaires : MH2O = 18,0 g·molо1 ; MAB = 116,0 g·molо1 ; MMgSO4 = 120,4 g·molо1 ;
- Pridž de l'acĠtate de butyle ͗ 77 Φ le litre ; - Prix du sulfate de magnésium anhydre : 74 Φ le kilogramme.Exercices G·MSSURIRQGLVVHPHQP
6. Mélange chlorobenzène - bromobenzène
Un mélange de chlorobenzène (noté 1) et de bromobenzène (noté 2) se comporte comme un mélange idéal.
Sous une pression de 760 mmHg, il commence à bouillir à la température ɽ = 136,7 °C.1. Calculer la composition du mélange en phase liquide et en phase vapeur à cette température. On donne
les pressions de vapeur saturante (en mmHg) à cette température : chlorobenzène pur P1
* = 863 et bromobenzène pur P2 * = 453.2. A cette même température, tracer, en justifiant la dĠmarche suiǀie, la courbe d'Ġbullition donnant la
pression totale P en fonction de la fraction molaire en bromobenzène en phase liquide.3. Exploitation du diagramme :
a) Sur le même graphe, porter le point calculé à la question 1). liquide. En déduire les fractions molaires correspondantes en phase gazeuse. c) A partir des points calculés, tracer la courbe de rosée.4. A 136,7 °C, un mélange liquide constitué au total de 30 mol et de fraction molaire 0,50 est porté à la
pression totale de 640 mmHg. Déterminer les masses de chacune des phases. Données : Mchlorobenzène = 113 g.mol-1 Mbromobenzène = 157 g.mol-17. Binaire acide formique - formamide
donné ci-dessous. La composition est exprimée en fraction massique w.1. Déterminer les coordonnées du point C. En déduire la formule du composé défini correspondant avec les
coefficients les plus petits possibles. formique et de formamide de fractions massiques en formamide égales à 0,20 ; 0,40 et 0,85.à 0,65, est refroidie lentement. Déterminer la nature, la masse et la composition des phases présentes :
a) à о10 ΣC b) ă о25 ΣC8. Diagramme binaire propanone - sulfure de carbone
Les pressions partielles (en mmHg) de la propanone (1) et du sulfure de carbone (CS2,(2)) sont données à 308 K
en fonction de la fraction molaire du sulfure de carbone dans la phase liquide x2 x2 ы 0,00 0,06 0,12 0,20 0,35 0,50 0,72 0,83 0,93 0,96 1,00 P1 (mmHg) 344 331 313 290 264 242 207 180 109 73 0 P2 (mmHg) 0 111 192 272 358 404 448 465 492 501 5121. À partir de ces données, le diagramme binaire isotherme a été tracé. Indiquer le nombre et la nature des
phases présentes dans les domaines 1 à 4. Nommer les courbes (a) et (b). Comment se nomme le point Z
(Pz = 658 mmHg) ? Quelles sont les propriétés d'un tel mélange ? Comment procéder pour tracer le
diagramme à partir des données de l'énoncé ?2. À 308 K, un mélange liquide propanone - sulfure de carbone commence à bouillir sous 440 mmHg. En
déduire : a) la composition du mélange liquide et celle de la première bulle de vapeur qui apparaît. b) la composition de la dernière goutte de liquide qui disparaît.3. À 308 K, on considère un mélange de 6,0 mol de propanone et 4,0 mol de sulfure de carbone sous
580 mmHg. Déterminer la nature des phases en présence, leur composition et leur quantité respectives.
4. Lequel des deux constituants possède la température d'ébullition la plus élevée ? Indiquer la nature du
résidu et du distillat obtenu par distillation fractionnée sous 658 mmHg d'un mélange liquide de
composition x2ы = 0,3, puis x2
ы = 0,8.
9. Système anorthite-silice
L'anorthite notée A est un silicate de formule (2 SiO2, CaO, Al2O3). La silice, de formule SiO2, présente deux
formes allotropiques à l'état solide : la tridimyte T(s) pour une température inférieure à 1470 °C et la
cristobalite C(s) pour une température supérieure à 1470 °C.1. Préciser la nature des phases en présence dans les différentes plages du diagramme.
2. Que représente le point I ?
On étudie le refroidissement d'un mélange à 70 % de silice en masse (point N).3. À quelle température commence-t-il à se solidifier ? Quelle est alors la nature des cristaux déposés ?
4. Comment peut-on interpréter le segment horizontal à 1470 °C ?
5. Lorsque la température arrive juste à 1368 °C, calculer le rapport massique des phases solide et liquide qui
coexistent.6. Pourquoi, pendant un certain temps, tout en continuant de refroidir, la température reste-t-elle égale à
1368 °C ? Montrer que, après cristallisation totale, la température peut à nouveau baisser si on continue
de refroidir le système.7. Quelle est la composition globale du système solide à 1280 °C ?
8. Tracer la courbe de refroidissement du système. Calculer la variance pour chacune des parties de cette
courbe.10. Système binaire fer-titane
On étudie le diagramme isobare simplifié du système fer-titane, tracé sous P = P° en fonction de la fraction
molaire en titane.Les domaines 3 et 9 décrivent des phénomènes de miscibilité partielle : ils correspondent à des solutions
solides, notées Fe1оdžTix pour le domaine 3, et FeyTi1оy pour le domaine 9.1. Quel qualificatif donnez-ǀous audž compositions D et E d'une part, et C et F d'autre part ?
2. Déterminer les formules des composés correspondant aux points A, D, E et H.
3. Déterminer les limites de solution solide xы du titane dans le fer (domaine 3) et yы du fer dans le titane
(domaine 9).4. Quelles sont les phases présentes dans les domaines 1, 2, 4, 5, 6, 7 et 8 ?
mélange de composition H. On indiquera sur chaque partie des courbes la nature des phases présentes, et
on justifiera l'edžistence de ruptures de pente ou de paliers.11. Binaire liquide-solide Benzène-Naphtalène
Données : Les grandeurs sont indicées de la façon suivante : b = benzène et n = naphtalène.
Masses molaires : Mb = 78 g.mol-1 Mn = 128 g.mol-1 Enthalpies de fusion : fHb° = 9,91 kJ.mol-1 fHn° = 19,1 kJ.mol-1 Températures de fusion : ɽb = 5,6 °C ɽn = 79,9 °CT(K) = ɽ(°C) + 273,15
R = 8,314 J.K-1.mol-1
1. La phase liquide est idéale, mais la miscibilité est nulle en phase solide. Montrer que les deux branches du
liquidus ont pour équation : quotesdbs_dbs13.pdfusesText_19[PDF] diagramme binaire solide liquide
[PDF] la participation politique terminale es
[PDF] changement de phase allo prof
[PDF] exemple de condensation liquide
[PDF] phèdre coupable ou innocente arguments
[PDF] qu est ce qu une propriété caractéristique
[PDF] pourquoi phèdre est coupable
[PDF] phedre est innocente
[PDF] dissertation phedre seconde
[PDF] la culpabilité dans phèdre
[PDF] avantage tir sportif
[PDF] licence de tir
[PDF] tir sportif mineur
[PDF] stand de tir ouvert au public
