 Travail dirigé 10 : Solubilité et KPS
Travail dirigé 10 : Solubilité et KPS
et en fonction de la solubilité pour les exemples de l'exercice 1. 4. Connaissant leur solubilité à 25°C calculer le KPS des composés suivants : a S AgI= 1
 Précipitation et solubilité
Précipitation et solubilité
Corrigés en TD : Dosages de polyacides solubilité
 Exercices sur le chapitre « Précipitation - Produit de solubilité »
Exercices sur le chapitre « Précipitation - Produit de solubilité »
Exercices sur le chapitre « Précipitation - Produit de solubilité ». Exercice n° 1 : On considère un litre de solution saturée en chlorure de plomb. Calculer
 LES REACTIONS DE PRECIPITATION Exercice 1 (Daprès BTS BT
LES REACTIONS DE PRECIPITATION Exercice 1 (Daprès BTS BT
Exercice 2 (D'après BTS BT 2010 Produit de solubilité). 1. Solubilité de l'hydroxyde de cuivre (II) dans l'eau pure à 25°C. 1.1. Equation de dissolution de
 TD N°5 : Réactions de Solubilité - Précipitation
TD N°5 : Réactions de Solubilité - Précipitation
Exercice 1 : La solubilité de CaSO4 est de 2g/l. On mélange une solution saturée de sulfate de calcium avec un volume égal de solution de (NH4)2SO4
 EXERCICES LA SOLUBILITE
EXERCICES LA SOLUBILITE
La solubilité du chromate d'argent Ag2CrO4 dans l'eau à 25 ° est 0
 Corrigé exercice 15 - QUELQUES CALCULS DE SOLUBILITÉ
Corrigé exercice 15 - QUELQUES CALCULS DE SOLUBILITÉ
Lorsqu'on calcule la solubilité d'un solide ionique il faut écrire tout d'abord l'équation de la réaction modélisant au mieux la dissolution de ce sel.
 Exercices de révision- Oxydo-réduction et Piles électrochimiques
Exercices de révision- Oxydo-réduction et Piles électrochimiques
Corrigé. Exercice I. On considère la pile symbolisée par: Cu / Cu2+ (01M) 2). Calculer la solubilité S de PbS04 et déterminer le potentiel de l'électrode.
 EXERCICES – SÉRIE 6 Solubilité propriétés colligatives des
EXERCICES – SÉRIE 6 Solubilité propriétés colligatives des
6.1 La concentration en ions argent d'un litre d'une solution est [Ag+] = 4⋅10–3 M. Calculer la quantité de NaCl qu'il est nécessaire d'ajouter pour
 Cours et exercices de chimie des solutions
Cours et exercices de chimie des solutions
Relation entre produit de solubilité Ks et solubilité s. En remplaçant [C m+. ] 6- Chimie MPSI ; cours méthode et exercices corrigés ; Le nouveau précis Bréal.
 Solubilité dune espèce chimique
Solubilité dune espèce chimique
CORRECTION EXERCICES. Partie 1/ Chimie minérale. Fiche 2 : Solubilité d'une espèce chimique. Exercice 1 : Dissolution du sulfate de cuivre.
 Travail dirigé 10 : Solubilité et KPS
Travail dirigé 10 : Solubilité et KPS
solubilité et pH. - solubilité et complexe. Exercices : a) Equation de précipitation solubilité et constante produit solubilité Kps.
 LES REACTIONS DE PRECIPITATION Exercice 1 (Daprès BTS BT
LES REACTIONS DE PRECIPITATION Exercice 1 (Daprès BTS BT
Exercice 2 (D'après BTS BT 2010 Produit de solubilité). 1. Solubilité de l'hydroxyde de cuivre (II) dans l'eau pure à 25°C. 1.1. Equation de dissolution de
 Premier exercice
Premier exercice
???/???/???? Solubilité de l'acide benzoïque : s = 25 g.L. -1 . - Masses molaires en g.mol. -1. : acide benzoïque M1 = 122 ; benzoate de sodium M2 = 144 ...
 Thermodynamique et chimie des solutions Cours et Exercices
Thermodynamique et chimie des solutions Cours et Exercices
Thermodynamique et chimie des solutions : Cours et Exercices Corrigés Chapitre 2 : Equilibre Chimique : Solubilité / Précipitation…………………………. 1.
 Précipitation et solubilité
Précipitation et solubilité
Corrigés en TD : Dosages de polyacides solubilité
 SMPC (S2) Année universitaire : 2019/2020 Cours de chimie des
SMPC (S2) Année universitaire : 2019/2020 Cours de chimie des
2) Que devient cette solubilité dans une solution aqueuse de chromate de potassium K2CrO4 à. 001 mol.L-1 ? Exercice 6: Solubilité du carbonate de calcium : On
 Précipitation et dissolution Précipitation et dissolution
Précipitation et dissolution Précipitation et dissolution
???/???/???? Exercices. Exercice 1 : Calculs de solubilité. [?00]. Calculer la solubilité du chlorure d'argent (pKs(AgCl) = 97) et du chlorure de plomb ...
 18 - Titrage sol acidifiée AlIII
18 - Titrage sol acidifiée AlIII
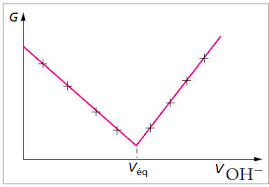
Corrigé exercice 18. TITRAGE D'UNE SOLUTION ACIDIFIÉE D'ALUMINIUM (III). La solution dosée contient les ions H O (concentration !)
 Physique Chimie
Physique Chimie
???/???/???? Un exercice corrigé et commenté suivi d'un exercice du ... chaux éteinte est peu soluble dans l'eau
 [PDF] 02solubilite-correction-1pdf
[PDF] 02solubilite-correction-1pdf
CORRECTION EXERCICES Partie 1/ Chimie minérale Fiche 2 : Solubilité d'une espèce chimique Exercice 1 : Dissolution du sulfate de cuivre
 [PDF] Précipitation et solubilité - cpge paradise
[PDF] Précipitation et solubilité - cpge paradise
Corrigés en TD : Dosages de polyacides solubilité mélange de cations solubilité en fonction du pH Dosages acidobasiques Exercice 1 : Dosages de
 [PDF] Exercices de solubilité
[PDF] Exercices de solubilité
Prévoir à l'aide des règles de solubilité si les composés suivants sont solubles dans l'eau ou non: a) le chlorure de cuivre(II) b) le carbonate de baryum
 [PDF] Travail dirigé 10 : Solubilité et KPS - AFO
[PDF] Travail dirigé 10 : Solubilité et KPS - AFO
solubilité et pH - solubilité et complexe Exercices : a) Equation de précipitation solubilité et constante produit solubilité Kps 1
 [PDF] Corrigé exercice 15 - QUELQUES CALCULS DE SOLUBILITÉ
[PDF] Corrigé exercice 15 - QUELQUES CALCULS DE SOLUBILITÉ
Lorsqu'on calcule la solubilité d'un solide ionique il faut écrire tout d'abord l'équation de la réaction modélisant au mieux la dissolution de ce sel
 [PDF] Exercices sur le chapitre « Précipitation - Produit de solubilité »
[PDF] Exercices sur le chapitre « Précipitation - Produit de solubilité »
Exercices sur le chapitre « Précipitation - Produit de solubilité » Exercice n° 1 : On considère un litre de solution saturée en chlorure de plomb
 [PDF] EXERCICES LA SOLUBILITE
[PDF] EXERCICES LA SOLUBILITE
1) A 25°C la solubilité dans l'eau de l'hydroxyde de cuivre II est de 2 Term STL SPCL –Lycée Ste Anne- Verdun B CHIOMENTO Exercice 3 : corrigé
 [PDF] TD N°5 : Réactions de Solubilité - Département de Pharmacie
[PDF] TD N°5 : Réactions de Solubilité - Département de Pharmacie
Exercice 1 : La solubilité de CaSO4 est de 2g/l On mélange une solution saturée de sulfate de calcium avec un volume égal de solution de (NH4)2SO4
 [PDF] correction exercices de revision : les reactions de precipitation
[PDF] correction exercices de revision : les reactions de precipitation
Exercice 2 (D'après BTS BT 2010 Produit de solubilité) 1 Solubilité de l'hydroxyde de cuivre (II) dans l'eau pure à 25°C 1 1 Equation de dissolution de
 [PDF] Chapitre 1 Solubilité - Exercices
[PDF] Chapitre 1 Solubilité - Exercices
Que peut-on conclure sur les valeurs des produits de solubilité de l'hydroxyde de fer (II) et de l'hydroxyde de magnésium ? EXERCICE 3 : Le fluorure de
1. Le produit de solubilité du bromate dargent AgBrO3 à 25°C est KS = 5,810-5.
1.1. Equation de léquilibre de solubilisation et expression produit de solubilité :
AgBrO3 = Ag+ + BrO3-
KS = [Ag+][ BrO3-]
1.2. Calcul de la solubilité de AgBrO3 dans leau pure à 25°C :
AgBrO3 = Ag+ + BrO3-E.I Excès 0 0
E.F Excès s s
1352 3 .106,7108,5 u u
LmolKs
sssBrOAgK S S La solubilité est de 7,610-3 mol.L-1 et le volume de la solution est de 1 L donc on peut dissoudre 7,610-3 mol. On a la relation : gMnmdoncM mn8,1236106,73uu u1.3. Calcul de la solubilité de AgBrO3 dans cette solution et de la masse de AgBrO3 que lon
peut dissoudre dans 1 L de cette solution : AgBrO3 = Ag+ + BrO3-E.I Excès 0 0,1
E.F Excès s s + 0,1
On a s << 0,1 donc s + 0,1 = 0,1
14 5 3 .108,51,0 108,51,0
1,0)1,0(
u u uLmolKs
sssBrOAgK S S La solubilité est de 5,810-6 mol.L-1 et le volume de la solution est de 1 L donc on peut dissoudre 5,810-6 mol. On a la relation : gMnmdoncM mn14,0236108,54uu u2. 2.1. Equation de la réaction de complexation des ions Ag + et expression de la constante de
formation :Ag+ + 2NH3 = Ag(NH3)2 +
@@@2 3 23NHAg
NHAgKF
2.2. Calcul de la constante de léquilibre prépondérant dont léquation sécrit:
AgBrO3 (s) + 2NH3 (aq) = Ag(NH3)2+ (aq) + BrO3- (aq) 3572 3 323
2 3
3231016,1108,5100,2 uuu u
SFKKNHAg
AgBrONHAg
NHBrONHAgK
2.3.Concentration AgBrO3 (s) + 2NH3 (aq) = Ag(NH3)2+ (aq) + BrO3- (aq)
Initiale Excès 0,5 mol.L-1 0 0
Excès 0,5 - 2s s s
Calcul de la solubilité s de AgBrO3 dans la solution : K est très grand (K > 103) donc la réaction est totale donc 0,5 - 2s = 0Donc s = 0,25 mol.L-1
Calcul de la masse maximale de AgBrO3 que lon peut dissoudre dans 1 L de cette solution : La solubilité est de 0,25 mol.L-1 et le volume de la solution est de 1 L donc on peut dissoudre0,25 mol. On a la relation :
gMnmdoncM mn5923625,0u u Exercice 2 (Daprès BTS BT 2010 Produit de solubilité)1. Solubilité de lhydroxyde de cuivre (II) dans leau pure à 25°C.
1.1. Equation de dissolution de lhydroxyde de cuivre (II) dans leau pure :
Cu(OH)2 = Cu2+ + 2OH-
1.2. Expression du produit de solubilité KS en fonction des concentrations molaires des
espèces présentes en solution :KS = [Cu2+][OH-]2
1.3. Expression littérale de KS en fonction de la solubilité s et calcul de sa valeur :
Cu(OH)2 = Cu2+ + 2OH-E.I Excès 0 0
E.F Excès s 2s
2+] = s et [OH-] = 2s d
donc KS = s[2s]2 = 4s3KS = 4(410-7)3 = 2,5610-19
2. pH dune solution aqueuse saturée dhydroxyde de cuivre (II).
2.1. Calcul de la concentration molaire des espèces présentes en solution :
[H3O+] = 10-pH = 10-7,9 = 1,26.10-8 mol.L-1 [OH-] = 10-14+pH = 10-6,1 = 7,94.10-7 mol.L-1 : 2ncu2+ = nOH-, donc2[Cu2+] = [OH-]
[Cu2+] = 1/2[OH-] [Cu2+] = 3,9710-7 mol.L-12.2. Calcul de la valeur du produit de solubilité de lhydroxyde de cuivre (II).
KS = [Cu2+][OH-]2
KS = 3,9710-7(7,9410-7)2
KS = 2,5010-19
Exercice 3 (Daprès BTS BT 2013 Dosage dune eau dEvian)1. Equation de la réaction de précipitation de lhydroxyde de calcium Ca(OH)2 :
Ca2+ + 2OH- = Ca(OH)2
2. Calcul du pH du début de précipitation dune solution aqueuse dion Ca2+ à la concentration
molaire c1 = 2,010-3 mol.L-1 : >@>@>@7,12108,1loglog .108,1106,5 1010.106,5102 1010
13 3 113
2 1414
3 13 3 2,5 22
22
u u u u u OHpH
LmolOHOH
LmolCaCa
KOHdoncOHCaK
SpK s S3. Equation de la réaction de précipitation de lhydroxyde de magnésium Mg(OH)2 :
Mg2+ + 2OH- = Mg(OH)2
4. Calcul du pH du début de précipitation dune solution aqueuse dion Mg2+ à la concentration
molaire c2 = 1,010-3 mol.L-1 : >@>@>@2,11101,7loglog .101,7104,1 1010.104,1101 1010
12 3 112
3 1414
3 13 3 7,8 22
22
u u u u u OHpH
LmolOHOH
LmolMgMg
KOHdoncOHMgK
SpK s S5. Calcul de la concentration molaire en ions Mg2+ restant libres à ce pH.
A ce pH tous les ions Mg2+ ont précipité car le pH de début de précipitation est de 11,2 pour
2+]libres = 0.
6. Les ions calcium ne précipiteront qu'une fois tous les ions magnésium précipités au vu des
constantes de solubilité. Donc lorsque le pH est de 12,5 les ions Mg2+ ont tous précipité mais pas encore les
ions calcium, ils sont tous libres. Exercice 4 (Daprès BTS BIOAC 2002 Solubilité et complexe)1. 1.1 Calcul la solubilité exprimée en rnol.L-1 puis en g.L-1 du chromate dargent Ag2CrO4 dans
leau pure : Ag2CrO4 = 2Ag+ + CrO42-E.I Excès 0 0
E.F Excès 2s s
125153
12 3 32
4 2 .103,28,331108,6 .108,64
1026,1
4 4 uu u u u LgsLmolKs
sCrOAgK S S1.2 Calcul la solubilité exprimée en rnol.L-1 puis en g.L-1 du chromate dargent Ag2CrO4 dans
une solution aqueuse de chromate de sodium 2Na+ + CrO42- à 16,2 g.L-1.1.1,0162
2,16 LmolM
CCm Ag2CrO4 = 2Ag+ + CrO42-E.I Excès 0 0,1
E.F Excès
1461612 222
4 2 .1089,58,3311077,1.1077,14,0
1026,1
4,0' '1,0'4,01,0''4 uu u u !! u uLgLmolKs
scarsssCrOAgK S S2. Cette molécule est un agent complexant car elle possède un doublet libre.
3. 3.1 Equations des deux équilibres qui sétablissent dans cette solution :
Ag2CrO4 = 2Ag+ + CrO42- (1)
Ag+ + 2 NH3 = Ag(NH3)2+ (2)
3.2 Pour la réaction (2), la constante de dissociation KD étant très petite, cette réaction est
quasi-totale dans le sens de formation du complexe. Lors de la mise en solution de Ag2CrO4, les ions Ag+
formation des ions Ag+ donc la solubilité de Ag2CrO4 augmente. Exercice 5 (Daprès BTS ABM 2007 Solubilité du carbonate de zinc)1. Equation de la réaction de dissolution du précipité du carbonate de zinc :
ZnCO3 = Zn2+ + CO32- (1)
2. Calcul de la solubilité s1 du carbonate de zinc dans leau pure :
ZnCO3 = Zn2+ + CO32-E.I Excès 0 0
E.F Excès s1 s1
168,10
1 2 1 2 3 2 .1098,31010 uLmolKs
sCOZnK SpK S S3. 3.1.
la concentration donc s2 < s13.2. Calcul de la solubilité s2
ZnCO3 = Zn2+ + CO32-E.I Excès 0 0,01
E.F Excès s2 0,01 + s2
19 8,10 2 22222 3 2 .1058,101,0 10 01,0 10 01,0
01,001,001,0
quotesdbs_dbs16.pdfusesText_22[PDF] solubilité d'un gaz dans l'eau collège
[PDF] loi de henry explication
[PDF] gaz dissous définition
[PDF] henry constant
[PDF] gaz dissous dans l'eau
[PDF] loi de henry plongée
[PDF] que faire pour respecter l'environnement
[PDF] respecter l'environnement c'est aussi respecter les autres
[PDF] pourquoi est il important de proteger l'environnement
[PDF] citoyenneté et environnement cours
[PDF] respect de l'autorité définition
[PDF] respect de l'environnement synonyme
[PDF] respect de l'environnement définition
[PDF] comment respecter l'environnement
