 Chapitre 8 Mélanges et corps purs
Chapitre 8 Mélanges et corps purs
Mélange homogène. 5. fer et soufre. Mélange hétérogène. 6. eau distillée. Corps pur. 7. oxygène + azote. Mélange homogène. 8. eau de vaisselle.
 Chapitre 1 : corps purs et mélanges
Chapitre 1 : corps purs et mélanges
Espèce chimique. Aspect. Corps pur ou mélange homogène / hétérogène ? Chlorure de sodium (NaCl) le sel de cuisine ! L'oxyde de fer (Fe2O3)
 Classification des corps purs
Classification des corps purs
Lorsqu'il s'agit d'un ensemble de mêmes atomes comme dans le cas du fer (Fe) ou du sodium (Na) cela s'appelle un corps pur élémentaire. (un seul atome - un.
 Distinguer corps purs et mélanges
Distinguer corps purs et mélanges
Que faire ? ? Connaître la composition massique d'un mélange c'est indiquer le pourcentage ou la fraction de chaque constituant
 Constitution et transformation de la matière Chapitre 1 : corps purs
Constitution et transformation de la matière Chapitre 1 : corps purs
Espèce chimique. Aspect. Corps pur ou mélange homogène / hétérogène ? Chlorure de sodium (NaCl) le sel de cuisine ! L'oxyde de fer (Fe2O3)
 Reaction chimique - Thermodynamique - Cinétique
Reaction chimique - Thermodynamique - Cinétique
Pour un système formé de différents corps purs les enthalpies s'ajoutent : * i i i. H n .H. = ?. Si les corps sont mélangés
 1. Matière corps purs et mélanges
1. Matière corps purs et mélanges
Un corps pur peut être identifié grâce à ses propriétés (voir chapitre 4). Voici quelques exemples de corps purs : le fer l'eau distillée et le chlorure de
 Partie Mécanique Thème 2 : Mouvement et interactions
Partie Mécanique Thème 2 : Mouvement et interactions
Mélanges et corps purs. 1. D'après le document 1 la solution de bouillie bordelaise est précipite vert
 Chapitre 1 Corps purs mélanges et identification despèces chimiques
Chapitre 1 Corps purs mélanges et identification despèces chimiques
Vous allez tout simplement faire « mumuse » avec les unités de la grandeur physique masse volumique (rien que le nom fait froid dans le dos…) je vais vous
 MELANGE ET CORPS PURS bis 18112018
MELANGE ET CORPS PURS bis 18112018
C'est l'opération qui consiste à faire passer un liquide à travers un filtre afin de retenir les particules légères qu'elle pourrait contenir. Conclusion : L'
 [PDF] MELANGE ET CORPS PURS bis 18112018
[PDF] MELANGE ET CORPS PURS bis 18112018
? Caractériser l'eau par ses constantes physiques ? Distinguer corps pur simple et corps pur composé ? Donner quelques exemples de mélanges ? Distinguer
 [PDF] 1 Matière corps purs et mélanges
[PDF] 1 Matière corps purs et mélanges
Un corps pur peut être identifié grâce à ses propriétés (voir chapitre 4) Voici quelques exemples de corps purs : le fer l'eau distillée et le chlorure de
 [PDF] Distinguer corps purs et mélanges
[PDF] Distinguer corps purs et mélanges
Un corps pur est une substance composée d'une seule espèce chimique ? Un mélange est constitué d'au moins deux espèces On distingue les mélanges
 [PDF] Chapitre 1 : corps purs et mélanges
[PDF] Chapitre 1 : corps purs et mélanges
Corps pur ou mélange homogène / hétérogène ? Chlorure de sodium (NaCl) le sel de cuisine ! L'oxyde de fer (Fe2O3) la rouille ! L'aluminium (Al)
 [PDF] Comment identifier les constituants dun mélange - Chapitre 1
[PDF] Comment identifier les constituants dun mélange - Chapitre 1
Le métal fer est un corps pur peu utilisé seul Mélangé à du carbone (environ 2 ) il forme l'acier un alliage très utilisé pour les constructions métalliques
 [PDF] CYCLE 4 - Classe de 5ème Activités de chimie mélanges/corps pur
[PDF] CYCLE 4 - Classe de 5ème Activités de chimie mélanges/corps pur
Explicatifs du déroulé Ici sont proposées 4 activités de chimie sur les notions suivantes : 1) Corps pur et mélange 2) Mélanges : homogène et hétérogène
 [PDF] Corps purs et mélanges
[PDF] Corps purs et mélanges
Un mélange est constitué de plusieurs espèces chimiques différentes 2 Corps purs simples et corps purs composés Un corps pur est constitué d'une seule espèce
 [PDF] Module 12 : Mélanges et corps purs
[PDF] Module 12 : Mélanges et corps purs
Module 1 2 : Mélanges et corps purs Objectifs : - Déterminer la composition d'une substance - Choisir une méthode de séparation adaptée Mélanges
 [PDF] Module 12 : Mélanges et corps purs
[PDF] Module 12 : Mélanges et corps purs
Pour chaque substance précisez s'il s'agit d'un corps pur simple (CPS) d'un corps pur composé (CPC) d'un mélange homogène (Mhomo) ou d'un
 [PDF] Chapitre 3- Les mélanges
[PDF] Chapitre 3- Les mélanges
Corps pur ou mélange ? Eau distillée L'eau est formée de particules toutes identiques d'un seul constituant
Est-ce que le fer est un corps pur ?
Un corps pur est un matériau constitué d'une seule esp? chimique, contrairement au mélange qui en comporte plusieurs. Un corps pur simple est constitué d'un seul type d'atomes (exemples : fer, Fe ; dioxygène, O2(g) …).Est-ce que l'acier est un corps pur ou un mélange ?
L'acier est un mélange de fer et de carbone.Est-ce que l'acier est un mélange ?
Un acier est un alliage métallique constitué principalement de fer et de carbone. Il se distingue des fontes et des ferroalliages par sa teneur en carbone comprise entre 0,02 % et 2 % en masse. C'est essentiellement cette teneur en carbone qui confère à l'acier ses propriétés.- L'acier est un alliage de fer, de carbone et, parfois, d'autres métaux. Ce mélange est homogène puisqu'il n'y a qu'une phase visible.
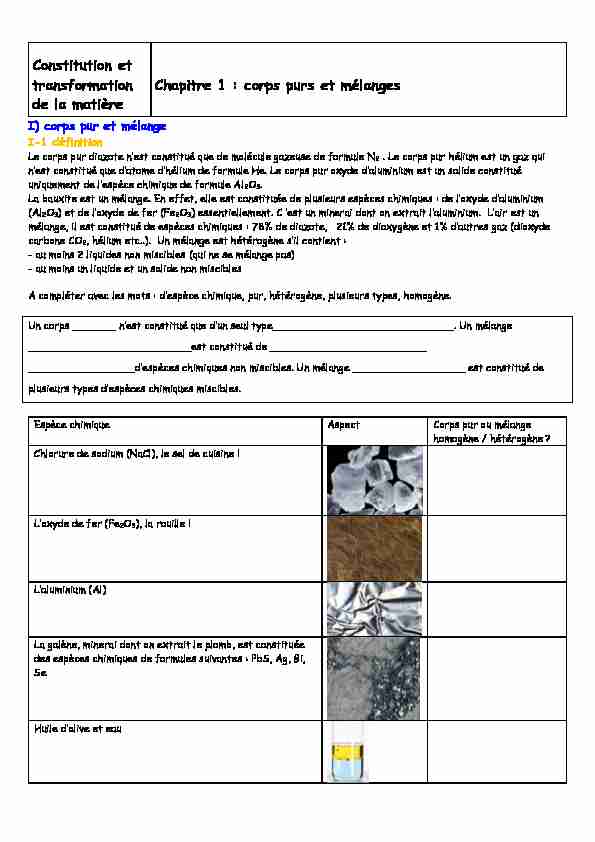
I) corps pur et mélange
I-1 définition
2 . Le corps pur hélium est un gaz qui
onstitué que 2O3. La bauxite est un mélange. En effet, elle est constituée de plusieurs espèces chimiques (Al2O32O3) essentiellement mélange, il est constitué de espèces chimiques : 78% de diazote, 21% de dioxygène et carbone CO2, hélium etc..). Un mélange est hétérogène contient : - au moins 2 liquides non miscibles (qui ne se mélange pas) - au moins un liquide et un solide non miscibles pur, hétérogène, plusieurs types, homogène.Un corps _______
__________________________est constitué de _________________________ non miscibles. Un mélange __________________ est constitué de plusieurs types dEspèce chimique Aspect Corps pur ou mélange
homogène / hétérogène ?Chlorure de sodium (NaCl), le sel de cuisine !
de fer (Fe2O3), la rouille ! (Al) La galène, minerai dont on extrait le plomb, est constituée des espèces chimiques de formules suivantes : PbS, Ag, Bi, SeConstitution et
transformation de la matièreChapitre 1 : corps purs et mélanges
Eau boueuse
Café sucré
I-2 nge
A sur celle de la masse
totale m du mélange : Le pourcentage en masse (pourcentage massique) ns le mélange vaut : ۯܕExemple :
de sodium de formule NaCl. On le prépare en dissolvant m(NaCl) = 9,0 chlorure de sodium de formule NaCl. On le prépare en dissolvant m(NaCl) = 9,0solution obtenu à pour masse m = 1000 g, déterminer la proportion en masse du chlorure de sodium dans la solution.
Convertir le résultat en pourcentage en masse de chlorure de sodium dissous. Le sérum physiologique est-il un corps
pur ? I-3La proporti VA sur
celle du volume total V du mélange : ۯܞ Le pourcentage en volume (pourcentage volumique) : ۯ܄Exercice
moyenne seize fois par minute et donc, au total, plus de 23 000 fois par période de 24 heures. Une personne absorbe ainsi quopièce de douze mètres cube (trois mètres de hauteur sur deux de long et deux de large). Sachant que le
2) qui entre dans les
poumons à chaque inspiration. II) on peut identifier des espèces chimiques de deux manières : e, densité, indice de réfraction, solubilité, etc) II-1 AAnimation CEA : les 3 états de la matière
La matière peut se trouver sous 3 états (plus un quatrième, le plasma, non détaillé dans ce cours) :
___________________ ___________________ ___________________ : sublimation, condensation (2 fois), vaporisation, fusion, liquéfaction, solidification,Exercice: à une pression P = 1 bar, f = -117
°C. La température la plus basse possible est de -273 °C. À cette température les atomes constituant la matière
sont immobiles. De -273 °C à -orme _______________. De -___________________. Pour une température supérieure à 79 °C ____________________ À chaque corps pur correspond des températures d fait à température constante au cours du temps. Ce Exercice : on a représenté sur les diagrammes ci-Quelle est la température
II-2 la masse volumique
Rappel : tableau de conversion des volumes. Effectuer le quiz (conversion et mesures de volume).Volume m3 (unité
légale)1 dm3 = 1 L 1 cm3 = 1 mL
A savoir
1 m3 = dm3 = L
1 L = cm3 = mL
Tableau de conversion des masses. Effectuer le quiz (conversion et mesures de masse).Masse t (tonne) kg g mg
A savoir :
1 t = kg
1 kg = g
1 g = mg
La masse volumique est représentée avec les lettres grecques )rô( ou )mu(La masse volumique
___________________ par le ______________________ = _______Unités légales : m (kg) ; V (m3) ;
Animation :mesurer . Donner le résultat en g.mL-1 en g.L-1 et en kilogramme par m3 (kg.m-3) (eau) = _________ g.mL-1 = _____________ kg.L-1 = _______________ kg.m-3 (air) = 1,3 g.mL-1 = ________ kg.L-1 = _____________ kg.m-3II-3. la densité
La (eau) : d = ______________ gazeux est égale au rapport de sa masse volumique air (air) : d = _______ , il faut convertir les masses volumiques dans les mêmes unités. Comme tout rapport de mêmes unités, unité !Exercice :
- la masse volumique du plomb est ߩutilisé pour gonfler des dirigeables et des ballons libres ou captifs. Bien que l'hydrogène ait une force portante
approximativement 7 % supérieure, l'hélium a l'avantage d'être incombustible (et même ignifuge)61. L'exploration
de l'atmosphère, notamment pour la météorologie s'effectue avec des ballons-sondes la plupart du temps gonflés à
l'hélium. Calculer sa masse volumique en g.mL-1, kg.L-1 et kg.m-3II-spèces chimiques par des tests chimiques
Quelques exemples à connaitre.
- le sulfate de cuivre anhydre (poudre de couleur blanche se transforme en sulfate de cuivre hydraté de coul (vidéo). Observer la photo et indiquez si la pomme, sur laquelle on a déposé du sulfate de cuivre anhydre, - Pour mettre en évi qui va se troubler (vidéo).- Afin de tester la présence de dihydrogène, on approche une bûchette enflammée d'un tube à
essai contenant du dihydrogène. La réaction chimique, amorcée par la source de chaleur, avec le dioxygène de l'air
produit une explosion (vidéo) II- Animation : la chromatographie de quelques colorantsPrincipe : voir la vidéo
La chromatographie un
mélange. A compléter avec les mots : solvant, éluant, capillarité, phase stationnaire.1. on trace sur une plaque (feuille de papier généralement) un trait à 1 cm du bord appelé ligne de dépôt.
La plaque correspond à la ___________ ________________________2. On dépose sur le trait une goutte de substance A à analyser et une ou plusieurs gouttes de substances connues
notées B, C etc.3. On plonge la phase stationnaire dans un ___________ appelé ___________________.
4. L monte par ________________ en
entrainant les gouttes de substances.5. Lorsque le solvant arrive à 1 cm du bord
supérieur de la phase stationnaire on sort la plaque et on la fait sécher.6. On analyse le chromatogramme obtenu pour
déterminer la composition de la tache inconnue. En effet, 2 taches qui migrent à la même hauteur correspondent à la même espèce chimique.Exercice: on a représenté ci-dessous le
chr Déterminer sa composition chimique, en indiquant le code des colorants entrant dans sa composition. : clique surPréparer le DS
1) Quelle est la différence entre un corps pur et
un mélange ?2) Pour un mélange, écrire la définition des termes suivants :
- proportion en volume et pourcentage volrps A3) Ecrire les définitions des termes suivants :
- masse volumique 45) Quelle est la composition ?
Programme officiel
Notions et contenus Capacités exigibles
Activités expérimentales support de la formationCorps purs et mélanges au quotidien.
chimiques, mélanges homogènes et hétérogènes.Citer des exemples courants de corps purs et de
mélanges homogènes et hétérogènes. de matière par des mesures physiques ou des tests chimiques. données expérimentales.Mesurer une température de ch
une chromatographie sur couche mince, mettre en oeuvre des tests chimiques, pour identifier une espèce mélange.Composition
grandeur de la valeur de sa masse volumique. données expérimentales.Mesurer des volumes et des masses pour estimer la
composition de mélanges. Capacité mathématique : utiliser les pourcentages et les fractions.quotesdbs_dbs32.pdfusesText_38[PDF] dauphine finance
[PDF] planète définition svt
[PDF] planète principalement constituée de roches solides
[PDF] terme général regroupant les corps céleste de forme déterminée
[PDF] ensemble de centaines de milliards d'étoiles
[PDF] enveloppe gazeuse située en périphérie d'une planète
[PDF] astre formé de gaz émettant de la lumière
[PDF] corps celeste qui tourne autour d'une etoile et qui n emet aucune lumiere
[PDF] sous corps premier
[PDF] commentaire composé les espaces du sommeil
[PDF] rrose sélavy
[PDF] l aumonyme desnos analyse
[PDF] henri michaux
[PDF] langage cuit desnos
