 TP N°7 : TITRAGE ACIDO-BASIQUE SUIVI PAR PH-METRIE
TP N°7 : TITRAGE ACIDO-BASIQUE SUIVI PAR PH-METRIE
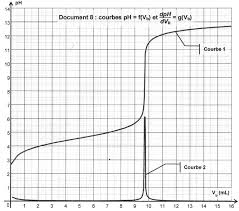
➢ On dose un acide « faible » par une base « forte » donc la solution à l'équivalence est basique le. pH est aux alentours de 8 (un peu plus) à l'équivalence.
 Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
tangentes parallèles ou méthode de la dérivée) ou dans un titrage conductimétrique. • Savoir choisir un indicateur coloré adapté à un titrage acido-basique.
 Correction du TP n°7 : Dosage acido-basique 2008-2009 - 1ere S
Correction du TP n°7 : Dosage acido-basique 2008-2009 - 1ere S
Correction du TP n°7 : Dosage acido-basique 2008-2009. Les objectifs du TP (aq) afin de réaliser un titrage acido- basique. 5) Calcul de la concentration ...
 Titrages acido-basiques en TP dinvestigation
Titrages acido-basiques en TP dinvestigation
décimolaire (les étudiants ont représenté la conductivité corrigée de la dilution σ(V0 + V) = f(V)) ; c) titrage pH-métrique de 200 mL du mélange HCl
 Correction du TP 20 La chimie du titrage direct acido-basique
Correction du TP 20 La chimie du titrage direct acido-basique
Correction du TP 20. La chimie du titrage direct acido-basique. Comment contrôler la composition d'un vinaigre ? OBJECTIFS : Pratiquer une démarche
 TP 9. DOSAGES PAR TITRAGE COLORIMETRIQUE - Correction I
TP 9. DOSAGES PAR TITRAGE COLORIMETRIQUE - Correction I
DOSAGE PAR TITRAGE COLORIMETRIQUE. II. Correction TP9. Dosage colorimétrique de l'acide lactique dans un lait. UTILISATION D'UN INDICATEUR COLORE ACIDO-BASIQUE.
 TP Chimie n° 3
TP Chimie n° 3
TP Chimie n° 3. Dosage acido-basique en présence d'indicateurs colorés. (Dosage de l'acide acétique contenu dans le vinaigre). 1 Introduction. Le vinaigre de
 T.P.10. Correction. DOSAGES PAR TITRAGE DIRECTS
T.P.10. Correction. DOSAGES PAR TITRAGE DIRECTS
Pour choisir un indicateur coloré acido-basique. Il connaître pHE. C'est l'ordonnée du point équivalent E (qui appartient à la courbe pH=f(Vb). L'ordonnée
 TRAVAUX PRATIQUES DE CHIMIE I
TRAVAUX PRATIQUES DE CHIMIE I
dosage acido-basique. I. Objectifs ………………………………………………………………………………….. 15. II d'un lait en réalisant un dosage acidobasique (TP 3). IV. Partie expérimentale.
 TP : dosage de lacidité titrable des tomates
TP : dosage de lacidité titrable des tomates
Ce TP a pour intérêt de faire réaliser et exploiter un dosage acido-basique sur un triacide et aussi de mettre en œuvre les notions concernant l
 Correction du TP n°7 : Dosage acido-basique 2008-2009 - 1ere S
Correction du TP n°7 : Dosage acido-basique 2008-2009 - 1ere S
Correction du TP n°7 : Dosage acido-basique 2008-2009 3) On en déduit donc que le DESTOP est une solution basique du fait de la présence des ions.
 Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
tangentes parallèles ou méthode de la dérivée) ou dans un titrage conductimétrique. • Savoir choisir un indicateur coloré adapté à un titrage acido-basique. •
 TP N°7 : TITRAGE ACIDO-BASIQUE SUIVI PAR PH-METRIE
TP N°7 : TITRAGE ACIDO-BASIQUE SUIVI PAR PH-METRIE
à partir de V = 1 mL. 6) Ceci permet de conclure que le point équivalent pour un titrage pH-métrique a même abscisse que l'extrémum de la courbe.
 Dosage dun vinaigre par suivi ph-métrique(TP) Titrage ACIDO
Dosage dun vinaigre par suivi ph-métrique(TP) Titrage ACIDO
Titrage ACIDO-BASIQUE. Titrage d'un vinaigre. Auteur Lydie Germain professeur au Lycée Clémenceau
 Titrages acido-basiques en TP dinvestigation
Titrages acido-basiques en TP dinvestigation
Figure 2 - Simulation avec le logiciel ChimGéné des titrages pH- métrique et conductimétrique (conductivité corrigée de la dilution) de 10 mL d'un mélange de
 Correction du TP 20 La chimie du titrage direct acido-basique
Correction du TP 20 La chimie du titrage direct acido-basique
Correction du TP 20. La chimie du titrage direct acido-basique. Comment contrôler la composition d'un vinaigre ? OBJECTIFS : Pratiquer une démarche
 TP CHIMIE-1 & TP CHIMIE-2
TP CHIMIE-1 & TP CHIMIE-2
TP I : Préparation d'une solution d'acide faible l'acide oxalique . TP II : Le dosage acido-basique (cas d'un acide fort par une base forte) ....... 14.
 TP Chimie n° 3
TP Chimie n° 3
Dosage acido-basique en présence d'indicateurs colorés. (Dosage de l'acide acétique contenu dans le vinaigre). 1 Introduction. Le vinaigre de vin est un produit
 TP 21 DOSAGE PAR TITRAGE - SIMULATION A. Titrage dune
TP 21 DOSAGE PAR TITRAGE - SIMULATION A. Titrage dune
Solution titrée: Solution dont on souhaite déterminer la concentration. Le titrage repose sur une réaction acido-basique faisant intervenir deux couples ...
 TP 9. DOSAGES PAR TITRAGE COLORIMETRIQUE - Correction I
TP 9. DOSAGES PAR TITRAGE COLORIMETRIQUE - Correction I
Titrage colorimétrique du diiode d'un antiseptique par le thiosulfate de sodium UTILISATION D'UN INDICATEUR COLORE ACIDO-BASIQUE. Le montage :.
1ere SCorrection du TP n°7 : Dosage acido-basique2008-2009
Les objectifs du TP :
Ce TP avait pour objectifs de comprendre le principe d'un dosage acido-basique par suiviconductimétrique et la notion d'équivalence, de repérer l'équivalence sur la courbe de dosage et
enfin de déterminer la concentration de l'espèce chimique contenue dans un produit déboucheur de
canalisations.II-A) Étude préliminaire :
1) Précautions a prendre pour manipuler le DESTOP :
Le pictogramme présent sur le flacon de DESTOP nous indique qu'il est corrosif. Il doit donc être
manipulé avec précautions, et le port de gants et de lunettes de protection est indispensable.2) Éléments chimiques présents dans le DESTOP ?
Le DESTOP est une solution aqueuse d'hydroxyde de sodium à 20%, elle donc constituée d'ions hydroxyde HO- (aq) et d'ions sodium Na+(aq).3) On en déduit donc que le DESTOP est une solution basique du fait de la présence des ions
hydroxydes HO- (aq).4) Si on cherche à doser les ions hydroxydes HO- (aq) contenus dans le DESTOP, il faudra titrer ce
dernier avec une solution contenant des ions oxonium H3O+ (aq), afin de réaliser un titrage acido-
basique.5) Calcul de la concentration du DESTOP :
L'étiquette sur le flacon nous indique que le pourcentage massique en hydroxyde de sodium (NaOH) est de 20%. On en déduit alors que mNaOH = 0,20 × msolution Or on sait que msolution = ρsolution × VsolutionSachant que la densité du DESTOP vaut d = 1,23 on en déduit que ρsolution = 1,23 × ρeau
On obtient alors msolution = 1,23 × ρeau × V D'où mNaOH = 0,20 × 1,23 × ρeau × VEt donc
nNaOH=mNaOH MNaOH =0,20×1,23×eau×VMNaOHCe qui nous donneCNaOH=nNaOH
V=0,20×1,23×eau
MNaOHSoitCNaOH=0,20×1,23×1000
23,016,01,00
CnaOH = 6,15 mol.L -1
II-B) Protocole du dosage du DESTOP :
On réalise le dosage d'une solution commerciale de DESTOP diluée 100 fois, par une solution d'acide chlorhydrique (H3O+ ; Cl- )(aq) de concentration CA = 1,00×10-1mol.L-1 .Le dosage est suivi par conductimétrie.
1/4 On mesure la conductivité de la solution après divers ajouts d'acide chlorhydrique dans le bécher.Résultats expérimentaux :
VA (mL)01234,1567,18910
111213,114151617181920212123
III-C) Exploitation des résultats du dosage :
1- Équation bilan de la réaction du titrage :
H3O+ (aq) + HO- (aq)2 H2O(l)
2-a) Bilan de matière avant l'équivalence :
H3O+ (aq) + HO- (aq)2 H2O(l)
État initialn(H3O+, versé)n(HO-, initial)excès État intermédiairen(H3O+, versé) - xn(HO-, initial) - xexcès État finaln(H3O+, versé) - xmaxn(HO-, initial) - xmaxexcès Avant l'état d'équivalence, le réactif limitant est l'ion oxonium H3O+ : Soit n(H3O+-, versé) - xmax = 0etn(HO-, initial) - xmax > 0 D'oùn(H3O+, versé) = xmaxetn(HO-, initial) > n(H3O+, versé)Ainsi à l'état final :
2/4ConductimètreCellule conductimétriqueBurette graduée
(H3O+; Cl-)(aq) CA = 1,00×10-1 mol.L-1 bécher20 mL de DESTOP¨dilué
100 fois
n(H3O+ , final) = 0 moln(HO-, final) = n(HO-, initial) - n(H3O+-, versé) n(Na+, final) = n(Na+,initial) = n(HO-,initial)n(Cl-, final) = n(Cl-versé) = n(H3O+, versé) b) Bilan de matière à l'équivalence :H3O+ (aq) + HO- (aq)2 H2O(l)
État initialn(H3O+, versé)n(HO-, initial)excès État intermédiairen(H3O+, versé) - xn(HO-, initial) - xexcès État finaln(H3O+, versé) - xmax, eqn(HO-, initial) - xmax, eqexcèsA l'état d'équvalence, H3O+ (aq) et HO- (aq) sont introduits en proportionsstoechiométriques.
Soitn(HO-, initial) - xmax, eq = n(H3O+, versé) - xmax, eq = 0 Et doncn(HO-, initial) = n(H3O+, versé) = xmax, eqSoit à l'état final :
c) Bilan de matière après l'équivalence :H3O+ (aq) + HO- (aq)2 H2O(l)
État initialn(H3O+, versé)n(HO-, initial)excès État intermédiairen(H3O+, versé) - xn(HO-, initial) - xexcès État finaln(H3O+, versé) - xmax,n(HO-, initial) - xmaxexcès Après l'équivalence, c'est l'ion hydroxyde HO- qui est limitant : Soit n(HO-, initial) - xmax = 0etn(H3O+, versé) - xmax, > 0 D'oùxmax = n(HO-, initial) etn(H3O+, versé) > n(HO-, initial)Soit l'état final :
3- Expression de la concentration C'B du DESTOP dilué :
D'après le tableau d'avancement établi a l'état d'équivalence, on sait que l'on a à l'équivalence :
n(HO-, initial) = n(H3O+, versé)Soit nA = nB
D'où CA × VA = C'B × VB
On en déduit donc que :C'B=CA×VA
VBC'B est la concentration inconnue de la solution titrée.CA est la concentration de la solution titrante.
VA est le volume de la solution titrante versé pour atteindre l'état d'équivalence. VB est le volume de solution titrée que l'on a dosé.3/4n(H3O+ , final) = 0 moln(HO-, final) = 0 mol
n(Na+, final) = n(Na+,initial) = n(HO-,initial)n(Cl-, final) = n(Cl-versé) = n(H3O+, versé) n(H3O+ , final) = n(H3O+, versé) - n(HO-,initial)n(HO-, final) = 0 mol n(Na+, final) = n(Na+,initial) = n(HO-,initial)n(Cl-, final) = n(Cl-versé) = n(H3O+, versé)4- Interprétation de la courbe de dosage :
La courbe met clairement en évidence deux domaines : -Dans le premier domaine, les ions H3O+ (aq) sont intégralement consommé lors de chaque transformation chimique correspondant à chaque ajout de la solution d'acide chlorhydrique (les ions H3O+ sont le réactif limitant). Dans ce domaine, la composition chimique dusystème évolue. Les ions HO-(aq) sont remplacés par des ions Cl- (aq) en même quantité et dont
la conductivité molaire ionique est beaucoup plus faible que celle de HO- (aq). C'est pour cela que la conductivité de la solution diminue linéairement.-Dans le second domaine, la totalité de l'espèce titrée (HO-) a été consommée et elle devient
alors le réactif limitant. La composition chimique du système évolue en raison des ajouts de
réactifs titrant sans donner lieu à une transformation chimique. L'addition d'ions H3O+ et Cl- dans la solution se traduit par une augmentation de la conductivité de la solution-Un point singulier sépare les deux domaines précédents, il s'agit de l'équivalence. En ce
point n(HO-, initial) = n(H3O+, versé). Il devient désormais possible de repérer l'équivalence sur la
courbe expérimentale (ainsi que le volume d'acide versé pour atteindre l'équivalence) et en conséquence, de déterminer la concentration molaire inconnue de l'hydroxyde de sodium à titrer.5- Volume d'acide versé pour atteindre l'équivalence :
De la courbe de dosage, on déduit le volume d'acide chlorhydrique versé pour atteindre
l'équivalence :VA, eq = 12,49 mL
6- En déduire la concentration du DESTOP :
On a à l'équivalence : C'B=CA×VAeq
VB=0,100×12,49
20=6,210-2mol.L-1
Sachant que le DESTOP a été dilué 100 fois, on en déduit sa concentration : CB = 100 × C'B = 100 × 6,2 10-2 = 6,2 mol.L-1 La concentration du DESTOP est donc d'environ 6,2 mol.L-1 ce qui est conforme a la valeur donnée par le fabriquant (6,15 mol.L-1 ).4/4VA (mL)σ (mS/cm)H3O+ réactif limitantHO- réactif limitant
Équivalence
H3O+ et HO- introduits en
proportions stoechiométriquesquotesdbs_dbs5.pdfusesText_10[PDF] titrage de l'acide ascorbique corrigé
[PDF] titrage de l'acide ascorbique par suivi ph-metrique
[PDF] titrage de l'acide lactique dans un lait correction
[PDF] titrage na2co3 par hcl
[PDF] titrage pdf
[PDF] titrage protocole
[PDF] titre d'identité républicain délai d'attente
[PDF] titre d'identité républicain périmé
[PDF] titre d'identité républicain pour algerien
[PDF] titre d'identité républicain renouvellement
[PDF] titre d'identité républicain sans passeport
[PDF] titre d'identité républicain urgent
[PDF] titre d'identité républicain val de marne
[PDF] titre professionnel gestionnaire de paie
