 6 cycles de production délectricité à vapeur
6 cycles de production délectricité à vapeur
23 juil. 2005 préchauffage du liquide grâce à un faible prélèvement de vapeur en cours de détente. ... vapeur symbolisé sur le schéma par une turbine
 Machines thermiques Sommaire
Machines thermiques Sommaire
Turbine à vapeur et centrale thermique à flamme. 3. Turbine à gaz et pdf". Olivier BONNEFO*; 24 07 2007. Caractéristiques thermodynamiques des différentes ...
 LES TURBINES A VAPEUR
LES TURBINES A VAPEUR
A la fin de l'année 1910 on pouvait compter comme tur- bines à vapeur en fonctionnement : près de 1 000 turbines. Bateau ou du genre Râteau
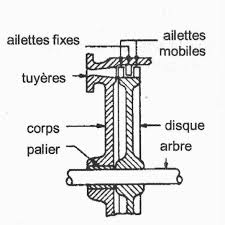 CHAPITRE I LES TURBINES
CHAPITRE I LES TURBINES
1 Attention à ne pas confondre le travail wt (en J/kg) avec la vitesse relative w (en m/s). Figure I.1 - turbine de LAVAL (1883) [1] vapeur tuyère tuyère.
 Untitled
Untitled
Nous adopterons donc le système à deux chutes de vitesse et un diamètre D. 181. Page 3. 128. LES TURBINES A VAPEUR. Calcul des tuyères
 Turbines
Turbines
3 oct. 2019 Ts3 – Ts4 = Ts2 – Ts1. Page 12. JL Fernandez – Blagnac Saint Exupéry - Cours Turbines. 12. Adaptation Turbine – Compresseur. Dans un turbo- ...
 Modelisation et régulation dune turbine à vapeur dans une centrale
Modelisation et régulation dune turbine à vapeur dans une centrale
soutirages sont effectués à différents niveaux de pressions au cours de la liétente de la vapeur dans la turbine: deux au niveau du premier étage (HP) et
 767-dimensionnement-des-turbines.pdf
767-dimensionnement-des-turbines.pdf
Mauvaise adaptation aux variations de chute qui modifient la vitesse du jet ce qui dégrade le rendement de cette turbine à action
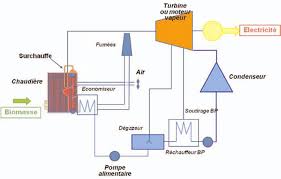 Produc on de force motrice ou électricité par cycle vapeur à par r de
Produc on de force motrice ou électricité par cycle vapeur à par r de
Les équipements u lisés sont des machines à vapeur : turbine ou moteur. La technologie des turbines à vapeur bénéficie d'une maturité acquise aux cours de ...
 Machines thermiques Sommaire
Machines thermiques Sommaire
Turbine à vapeur et centrale thermique à flamme l'énergie pour un système ouvert disponible sur : www ulb.ac.be sma enseignement thermo 1erprincipe.pdf.
 CYCLES THERMODYNAMIQUES DES MACHINES THERMIQUES
CYCLES THERMODYNAMIQUES DES MACHINES THERMIQUES
Plan du cours : - éléments d'histoire. - rappel de thermodynamique (principes cycles
 Réseaux vapeur
Réseaux vapeur
23 juil. 2005 chaudière une turbine et un condenseur
 Production de lEnergie Electrique
Production de lEnergie Electrique
cours introductif intitulé « généralités sur l'énergie » dans lequel sont réalisent la machine à vapeur et plus généralement
 767-dimensionnement-des-turbines.pdf
767-dimensionnement-des-turbines.pdf
Mauvaise adaptation aux variations de chute qui modifient la vitesse du jet ce qui dégrade le rendement de cette turbine à action
 Production délectricité
Production délectricité
02 bar) et basse température (20. °C – 60 °C). ? Production centralisée (300 – 1200. MW). Schéma d'une centrale à vapeur. Chaudière. Turbine. Condenseur.
 COURS hydraulique générale MEPA 2010
COURS hydraulique générale MEPA 2010
Au cours de cette transformation les molécules de vapeur installations où il se produit (canalisation
 Cours de conversion dénergie (UEF 3.1.1) Dr. Amar ZERROUT
Cours de conversion dénergie (UEF 3.1.1) Dr. Amar ZERROUT
à un ou plusieurs soutirages de vapeur cycle mixte (gaz-vapeur)
 COURS DE THERMODYNAMIQUE
COURS DE THERMODYNAMIQUE
Quelle est la température finale de la vapeur obtenue ? Données : Chaleur latente de fusion de glace : Lf = 352 kJ/kg. Chaleur latente de vaporisation de l'eau
 Turbines hydrauliques
Turbines hydrauliques
Le présent cours est destiné à des ingénieurs ou techniciens non spécialisés dans le domaine des petites centrales hydrauliques. Il leur permettra d'acquérir
 [PDF] Modelisation et régulation dune turbine à vapeur dans une centrale
[PDF] Modelisation et régulation dune turbine à vapeur dans une centrale
Ce projet de fin d'étude a pour but la modélisation d'une turbine à vapeur dans une centrale thermique en vue d'une régulation de la fréquence de sortie de
 TURBINES À VAPEUR — Fonctionnement -Technologie -Exploitation
TURBINES À VAPEUR — Fonctionnement -Technologie -Exploitation
Les turbines à vapeur sont des machines motrices rotatives qui transforment l'énergie de la vapeur en énergie mécanique Elles sont utilisées pour entraîner
 [PDF] 6 cycles de production délectricité à vapeur
[PDF] 6 cycles de production délectricité à vapeur
23 juil 2005 · Il montre qu'une telle centrale comprend quatre composants : une pompe une chaudière une turbine et un condenseur traversés par le même débit
 LES TURBINES A VAPEUR - La Houille Blanche
LES TURBINES A VAPEUR - La Houille Blanche
A la fin de l'année 1910 on pouvait compter comme tur- bines à vapeur en fonctionnement : près de 1 000 turbines Bateau ou du genre Râteau telles que les
 [PDF] SAMI-BOUTERRApdf
[PDF] SAMI-BOUTERRApdf
Nous avons tenté par la simulation d'une étude statique de deux modèles d'aubes de turbine à vapeur haute pression et basse pression dessinés au préalable sous
 [PDF] Calcul optimal des soutirages dans une turbine à vapeur dun cycle
[PDF] Calcul optimal des soutirages dans une turbine à vapeur dun cycle
La différence de température et pression maximale puissance générée et rendement entre la turbine à gaz et celle à vapeur sont résumées dans le tableau suivant
 [PDF] les turbines a vapeur - ORBi
[PDF] les turbines a vapeur - ORBi
Voir tome XVIII page 145 (1) ) CHAPITRE III Calcul des turbines à vapeur Nous n'aurons en vue dans ce chapitre que le calcul
 [PDF] CHAPITRE I LES TURBINES
[PDF] CHAPITRE I LES TURBINES
1 TURBINE Á ACTION 1 1 Généralités Une turbine à action est constituée d'une série de tuyères fixes Figure I 1 - turbine de LAVAL (1883) [1] vapeur
 [PDF] Turbines - Eduscol
[PDF] Turbines - Eduscol
3 oct 2019 · 1 Cours Thermopropulsion Turbines Rôle ? La turbine transforme l'énergie potentiel contenue dans les gaz brûlés en énergie
Comment fonctionne une turbine à vapeur ?
La turbine à vapeur
La vapeur produite à haute pression est injectée à l'entrée de la turbine. À ce niveau, elle subit une série de détente au travers de plusieurs étages de roue à aubes, en générant l'énergie mécanique nécessaire à mettre l'arbre en rotation.Comment la vapeur d'eau fait tourner une turbine ?
La turbine à action a des tuyères fixes qui orientent le débit de vapeur en jets à haute vitesse. Ces jets contiennent une importante énergie cinétique, qui est convertie en rotation de l'arbre par la forme des aubes du rotor, lorsque les jets de vapeur changent de direction.Quel est le cycle thermodynamique utilisé par une centrale à vapeur avec turbine à vapeur ?
Le cycle de Rankine ou cycle de vapeur de Rankine est le processus largement utilisé par les centrales électriques telles que les centrales à charbon ou les réacteurs nucléaires.- Turbine à action. Turbine dans laquelle toute l'énergie disponible dans le fluide est convertie en énergie cinétique avant qu'elle n'agisse sur la roue de la turbine (d'apr. Eau 1981).

Mohamed BOUDIAF »
Faculté de Chimie
Département de Génie des Matériaux
Destiné
aux étudiants de 1ère année Génie des ProcédésRachida OUARGLI-SAKER
2015-2016
Scientifique
COURS DE
THERMODYNAMIQUE
République Algérienne Démocratique Et PopulaireAvant propos :
Ce cours de thermodynamique est destiné aux étudiants de 1ère année érieur de spécialité génie des procédés et science de la matière. Le premier chapitre introduit les notions fondamentales et les premières définitions utilisées en .Le deuxième chapitre développe
premier principe. Le troisième chapitre est consacré à la chimie. Le quatrième et dernier chapitre présente le deuxième principe de la thermodynamique, les notions et les différentes expr ainsi introduction aux machines thermiques et les cycles thermodynamiques. Cette présentation résulte de la lecture de nombreux ouvrages et documents dont la plupart ne sont pas cités dans la bibliographie.Tables des matières
CHAPITRE I : Notions fondamentales de la thermodynamiqueI. 1. Introduction générale 01
I.1.1. Notion de la température 02
I.1.2. Notion de la pression 03
05I.1.4. Unités 05
06I.2.1. Définition du système 06
I.2.3. Evolution ou transformation du système 07 08 I.2.5. Représentations graphiques des évolutions du système 10I.2.6. 11
I.2.7. Principe zéro 12
CHAPITRE II : travail, chaleur, énergie interneII.1. Introduction 13
(U) 13II.2.1. 13
II.3. La chaleur (Q) 14
II.3.1. Chaleur sensible 14
II.3.2. Chaleur latente 15
II.3.3. Calorimétrie 16
II.4. Le travail (W) 19
II.5. Convention du 21
II.6. Le 1er principe de la thermodynamique 22
II.6.1. Enoncé du 1er principe de la thermodynamique 22 23II. 8. Capacité calorifique 24
II.9. Les transformations réversibles 26
II.9.1. ransformationisochore (à volume constant) 26 II.9.2. ransformation isobare (à pression constante) 27 II.9.3. ransformationisotherme (à température constante) 29 II.9.4. ransformationadiabatique (chaleur Q constante) 30 CHAPITRE III : Thermochimie : Application du 1er principe à la chimie III. 1. Etat standard et chaleur de réaction 36III. 2. Relation entre 38
III.3. Enthalpie standard de réaction 39
III.4. Loi de HESS 40
III.5. Loi de KIRCHOFF 43
III.6. Energie de la liaison covalente 45
CHAPITRE IV : 2ème principe de la thermodynamiqueIV.1. Introduction 47
47IV.3. Enoncés du second principe 48
IV.3.1. Enoncé de CLAUSIUS 48
IV.3.2. Enoncé de KELVIN 48
IV.3.3. Enoncé mathématique 49
5153
IV.5.1. Transformation isotherme réversible 53
IV.5.2. Transformation isobare réversible 53
IV.5.3. Transformation isochore réversible 54
IV.5.4. Transformation adiabatique 54
5455
IV.7. 57
IV.8. 60
60IV.10. Les machines thermiques 62
IV.10.1. Machines thermodynamiques (T.D) 62
IV.10.2. Machines dynamo-thermiques (D.T) 63
IV.11. Cycles thermodynamiques 64
IV.11.1. Cycle de Carnot 65
IV.11.2. Cycle de Beau Rochas (OTTO) 66
IV.11.3. Cycle de Diesel 66
IV.11.4. Cycle de Rankine 67
IV.11.5. Cycle de Stirling 68
Références bibliographiques 71
1 CHAPITRE I : Notions fondamentales de la thermodynamiqueI. 1. Introduction générale
La thermodynamique est une science qui nait à la fin du 17ème siècle On rapporte que Denis PAPIN (Physicien français, 1647-1714 et ainsi fournir du travail. trouver les conditions optimales pour transformer la chaleur en travail. On trouve dans cette phrase les trois (03) mots fondateurs de la thermodynamique. Ce non (thermodynamique) vient du grec signifiant respectivement chaleur et force. On peut décrire la thermodynamique de deux (02) manières ou selon deux (02) aspects différents : a. : on s microscopique ou atomique en utilisant comme variables les grandeurs cinétiques thermodynamique classique ou statique. a. Thermodynamique classique Elle explique le comportement de la matière ou des systèmes en fonction de leurs variationsévolution et dresse le bilan énergétique du système. Le chemin suivi par la transformation du
système peut jouer un rôle (la notion de réversibilité des transformations). 2 b. Thermodynamique statique et la signification des variables macroscopiques (P, T) et chaleur.I. 1. 1. Notion de température
Vi des
molécules et donc leur énergie cinétique Ei du milieu est plus grand.A la température 0K (Zéro absolu à -273°C), les atomes et les molécules qui constituent la
matière sont figées.Exemple :
, les molécules du gaz se totalement aléatoire avec des vitesses Vi.Gaz dans une enceinte
Donc la température est définie par la relation suivante:Où :
M est la masse des particules.
V est la vitesse des particules qui constituent la matière. k est une constante.T est la température de la matière.
3 On peut définir plusieurs échelles de température, telle qui précède toute autre échelle. e (K) en kelvin en fonction du Celsius. selon une échelle prédéfinie. Il existe différents types de thermomètres utilisés dans la pratique, ci-dessous quelques exemples les plus utilisé :Les thermomètres à mercure.
Les résistances de platine utilisables entre de 200 à °C630.à 1300°C.
Les résistances à semi-conducteurs en Germanium (Ge) pour T< 77 KI. 1. 2. Notion de la pression
La pression est due aux nombreux chocs des atomes ou molécules de la matière sur les parois du récipient.Exemple :
a N molécules de gaz en agitation permanente.Pression dans une enceinte
4Soit ܖ
Donc, on définit la pression par la relation suivante:Où :
P est la nte.
M est la masse des molécules de gaz.
V est la vitesse des molécules de gaz.
On distingue entre pression absolue et relative et entre pression totale et partielleOù :
Pabs : Pression absolue.
Prel : Pression relative.
Patm : Pression atmosphérique.
Où :
Pi : Pression partielle.
Xi : Fraction molaire.
PT : Pression totale.
Donc :
5 I. 1. Les échanges de lde la matière se présentent sous deux formes possibles; la chaleur (Q) ou le travail (W). chelle microscopique comme une et des atomes sous forme désordonnée (chaleur Q), ou ordonnée (travail W).Déplacement du piston
Transfert de chaleur (Q) Transfert de travail (W) par déplacement du pistonI. 1. 4. Unités
La majorité des unités en Système international [S. I] utilisés dans ce cours sont les suivants :
Temps : en secondes [s]
Température : en degré Kelvin [K]
Pression : en Pascal [Pa] ou [N/m2]
1 Pa = 1 N/m2 ; 1atm = 1,013bar = 1,013105 Pa = 760 Torr = 76 cmHg
1 bar = 105 Pa = 750 Torr
Energie: en Joule [J] et
1 calorie = 4,184 Joules
Puissance : en Watt [W] et 1W = 1 J/s
6 I.I. 2. 1. Définition du système
Pour décrire thermodynamiquement un système, il faut à la fois : Définir le système en délimitant ses frontières par rapport au milieu extérieur.Le système est défini comme une partie de matière (de masse donnée) délimitée par rapport
space entourant le système.Milieu
Extérieur
Délimitation du système
Il existe différents types de systèmes thermodynamiques qui sont représentés dans le tableau
ci-dessous:Système Echange de
matière ExempleIsolé Non Non Calorimètre
Fermé Non Oui Piles électriques
Ouvert Oui Oui Être vivant
Système Système
7I. 2. 2. Etat du système
les macroscopiques (m, P, T, V,etc) dites aussi . possibles. des valeurs bien définies et constantes.On distingue alors selon le cas entre :
Variables ou grandeurs thermiques (P, V, T) ou calorifiques (U, H, W, Q, S). Variables extensives, -à dire proportionnelles à la quantité de matière telle que (m, V, U,..etc) ou variables intensives, -à dire indépendantes de la masse telle que (P,T, concentration,). On définit souvent des grandeurs massiques-à d système telle que : le volume massique. I. 2. 3. Evolution ou transformation du système système évolue et les variables dmodifiés. On dit que le système se initial (1) à un autre état final (2). (W ou Q cédés) Ou (W ou Q reçus)Evolution
Etat (1) Etat (2) (Q ou W) avec le milieu extérieurP1, V1, T1 P2, V2, T2
8 Au cours du système varient pour atteindre un autre (1) (2) se déroule en général hors équilibre. On distingue alors entre : Transformations réversibles ou (idéales) : ce sont les transformations infiniment lentes Transformations irréversibles (réelles) : ce sont des transformations rapides et brutales hors équilibre. intermédiaires peu -statiques). Les transformations naturelles spontanées sont irréversibles; elles ne peuvent évoluer que dans un seul sens. (a) (b) Transformations: (a) irréversible et (b) réversible I. 2. pas toutes indépendantes, mais liées entre elles par des équations dites du type : ݂:2quotesdbs_dbs32.pdfusesText_38[PDF] machine thermique pdf
[PDF] machine thermique fonctionnement
[PDF] machine thermique exercice corrigé pdf
[PDF] cycles thermodynamiques des machines thermiques
[PDF] cours moteur thermique pdf gratuit
[PDF] turbine ? vapeur cours
[PDF] chaine d acquisition capteurs
[PDF] chaines de markov pour les nuls
[PDF] chaine de markov definition
[PDF] chaine de markov cours simple pdf
[PDF] chaînes de markov cours exercices et corrigés détaillés
[PDF] chaine de markov application
[PDF] changement globaux pdf
[PDF] comment reduire le rechauffement climatique
