 Les changements détat du corps pur : transformations physiques et
Les changements détat du corps pur : transformations physiques et
10 juil. 2013 Corrigé des exercices ... Le diagramme de changement d'état de ... Dans le cours vous trouvez le diagramme du corps pur de l'hélium :.
 Physique : THERMODYNAMIQUE CORRECTION - TD PHYSIQUE 6
Physique : THERMODYNAMIQUE CORRECTION - TD PHYSIQUE 6
vaporisation d'eau liquide. • fonte d'un glaçon. • liquéfaction d'un gaz. DIAGRAMME DE CHANGEMENT D'ETAT DU CORPS PUR (P T). Exercice n°1 : Point triple
 C5-ETUDE DES CHANGEMENTS DETAT_Exercices-Livre
C5-ETUDE DES CHANGEMENTS DETAT_Exercices-Livre
fusion de l'eau. Recherche les propositions exactes et corrige celles qui ... d'état exercices ... Un corps pur change d'état à température constante.
 SERIE DEXERCICES N° 27 : THERMODYNAMIQUE : CORPS PUR
SERIE DEXERCICES N° 27 : THERMODYNAMIQUE : CORPS PUR
L'état initial I correspond à une vapeur saturante sèche ( xV1 = 1 ) à la température T1 = 485 K (à la pression P1 = f (T1) = 20 bar ). L'état final. F
 Chapitre 20 Corps purs et mélanges
Chapitre 20 Corps purs et mélanges
18 mai 2006 En physique et en métallurgie la fusion est le passage d'un corps de l'état solide vers l'état liquide. Hypothèses : Selon TOI : • À quelle ...
 Exercices de Thermodynamique
Exercices de Thermodynamique
1) D'apr`es l'équation d'état du gaz parfait le nombre de molécules par unité de volume est n? = N. V. = P. kBT ?. 10?6.1
 TD2 – Changements détat du corps pur et potentiel chimique
TD2 – Changements détat du corps pur et potentiel chimique
TD2 – Changements d'état du corps pur D : comme la pression de vapeur saturante et la température coïncident ... Mais là
 4eme - Chimie - Corrigé Exercices chap 1 2 3
4eme - Chimie - Corrigé Exercices chap 1 2 3
Physique Chimie - Corrigés d'exercices – niveau 4 ème a) Le tube 1 est un corps pur car il n'est composé que d'un seul constituant.
 Devoir maison : chapitre 6 : transformation physique
Devoir maison : chapitre 6 : transformation physique
solidification de l'eau. 5) Quand dit-on qu'un changement d'état d'un corps pur est exothermique ? Endothermique ? Donner un exemple dans chacun des cas en
 Physique et Chimie cycle 4 Classe de CINQUIÈME
Physique et Chimie cycle 4 Classe de CINQUIÈME
Exercice 2 : Est-ce un corps pur ? Mathéo réalise un changement d'état d'un corps liquide. Il relève la température toutes les minutes. Il obtient le.
 [PDF] transformations physiques et diagrammes détat du corps pur
[PDF] transformations physiques et diagrammes détat du corps pur
10 juil 2013 · Exercices du chapitre 1 Les changements d'état du corps pur : transformations physiques et diagrammes d'état du corps pur Corrigé des
 Les changements détat dun corps pur - Exercices avec les corrections
Les changements détat dun corps pur - Exercices avec les corrections
Les changements d'état d'un corps pur – 5ème – Exercices avec les corrections – PDF à imprimer Exercice 01 : Compléter le texte suivant : a) La vaporisation
 [PDF] CH7 LES CHANGEMENTS DÉTATS – exercices
[PDF] CH7 LES CHANGEMENTS DÉTATS – exercices
a) Que contient le bécher à 5 min du début de l'expérience ? de la glace et de l'eau liquide car à 5 min on est sur le palier b) A quel moment l'eau liquide
 [PDF] SERIE DEXERCICES N° 27 : THERMODYNAMIQUE - Unisciel
[PDF] SERIE DEXERCICES N° 27 : THERMODYNAMIQUE - Unisciel
Série d'exercices 27 1 SERIE D'EXERCICES N° 27 : THERMODYNAMIQUE : CORPS PUR DIPHASE EN EQUILIBRE Exercice 1 : détente d'une vapeur d'eau dans une
 [PDF] C5-ETUDE DES CHANGEMENTS DETAT_Exercices-Livre
[PDF] C5-ETUDE DES CHANGEMENTS DETAT_Exercices-Livre
LO 00 12 Léon n'a pas de mémoire Léon a retenu que la courbe de changement d'état d'un corps pur possédait un palier 1 Que signifie le mot palier? Trol 2
 [PDF] Exercice 1 : Dans un tube à essais on a réalisé la solidification dun
[PDF] Exercice 1 : Dans un tube à essais on a réalisé la solidification dun
Dans un tube à essais on a réalisé la solidification d'un corps pur A qui n'est pas de l'eau Cette solidification a duré 8 minutes 1) Sous quel état
 [PDF] ATS TD 4 : Changement détat du corps pur - TSI Ljfhtml
[PDF] ATS TD 4 : Changement détat du corps pur - TSI Ljfhtml
On chauffe 1 g de glace pris à la température T1=250 K pour la transformer en eau liquide à T 2=300 K sous une pression extérieure de 1 bar constante Calculer
 [PDF] TD2 – Changements détat du corps pur et potentiel chimique
[PDF] TD2 – Changements détat du corps pur et potentiel chimique
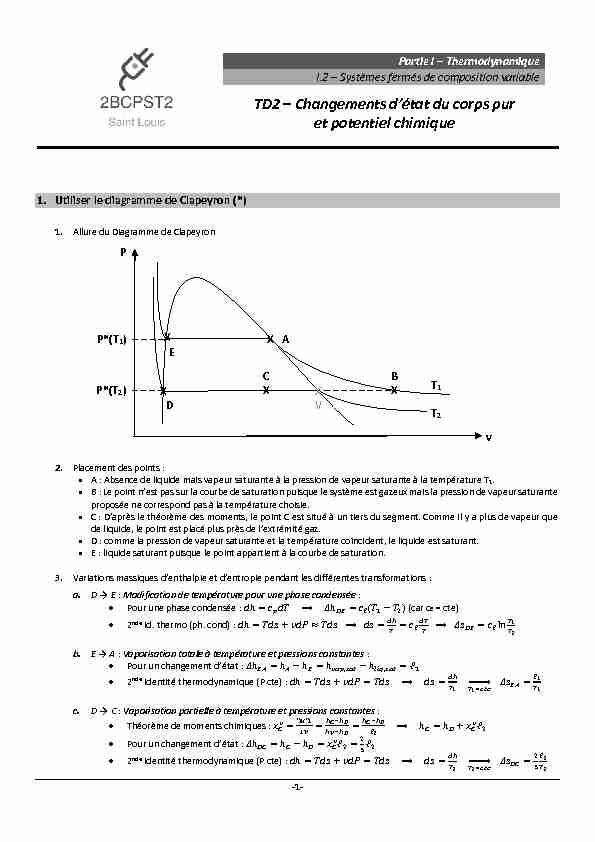
TD2 – Changements d'état du corps pur et potentiel chimique 1 Utiliser le diagramme de Clapeyron (*) 1 Allure du Diagramme de Clapeyron
 Exercices Lelivrescolairefr
Exercices Lelivrescolairefr
Corrigé 1 On observe un palier de température sur la courbe La substance qui change d'état est donc un corps pur 2 Un palier apparait à une température
 -1-
-1- Partie I ʹ Thermodynamique
I.2 ʹ Systèmes fermés de composition variable et potentiel chimique1. Utiliser le diagramme de Clapeyron (*)
1. Allure du Diagramme de Clapeyron
2. Placement des points :
A : Absence de liquide mais vapeur saturante à la pression de vapeur saturante à la température T1.
proposée ne correspond pas à la température choisie.D : comme la pression de vapeur saturante et la température coïncident, le liquide est saturant.
E : liquide saturant puisque le point appartient à la courbe de saturation. a. ї : Modification de température pour une phase condensée : b. ї : Vaporisation totale à température et pressions constantes : c. ї : Vaporisation partielle à température et pressions constantes :P*(T2) ʹ ʹ ʹ ʹ ʹ ʹ ʹ ʹ ʹ ʹ ʹ ʹ ʹ
P v T1 T2 X A B X C X X D X EP*(T1) ʹ ʹ ʹ ʹʹ
X V -2-d. ї : Compression isotherme de GP puis liquéfaction à température et pressions constantes :
Phase ї : compression isotherme du GP :
o 2ème loi de Joule : ݄݀ீൌோఊ o ߂݄ாൌെ߂Bilan :
o ߂݄ாൌ߂݄߂ e. E ї : Refroidissement de liquide (phase condensée) puis vaporisation partielle Phase ї : refroidissement de liquide (opposé de la transformation D їE) Phase ї : liquéfaction partielle à T et P cte (déjà calculé)Bilan :
2. Fusion de glace (*)
Le milieu final ne contient que de la glace. Dans ce cas, il faut que trouver que Tfinale < 0 °C.Le système étudié est {calorimètre + eau liquide + glace}. Ce système évolue de façon adiabatique (Q = 0) et isobare (en
La combinaison des trois termes conduit à :
-3-système, à partir de la seconde identité thermodynamique (privilégiée du fait de la constance de P pendant la
transformation) : a) Changement de température pour phase condensée : ݀ܵ b) Changement de température pour phase condensée : ݀ܵ c) Transformation plus complexe à décomposer pour chaque sous-partie de la transformation :Bilan :
Le signe positif obtenu atteste du caractère irréversible de la fusion spontanée des glaçons ici.
-4-2. Diagramme de Clapeyron :
3. Calcul des transferts thermiques :
QAB : la transformation AB est adiabatique : QAB = 0o Le calcul du travail des forces pressantes utilise le caractère isobare (P = cte) réversible (Pext = P) :
La transformation CD étant isenthalpique,
8,6 bar ʹ ʹ ʹ ʹ ʹ ʹ ʹ ʹ ʹ
2,8 bar ʹ ʹ ʹ ʹ ʹ ʹ ʹ ʹ ʹ ʹ ʹ ʹ
P v 293 K263 K
X A B X X C X D B' X X -5-
Le mélange liquide-vapeur en D contient en masse, 11 % de vapeur. Le point D devrait être représenté à 11 % du segment
froide (piste, QF > 0) et la cède à une source chaude (air ambiant, QC < 0). Pour réaliser ce transfert contre-intuitif, elle a
besoin de recevoir un travail (W > 0), par exemple électrique (grandeur coûteuse). Reste à identifier les phases de transformation associées à QF et QC :QC doit être négatif : QC = QBC
QF doit être positif : QF = QDA
En cas de fonctionnement réversible, Sc = 0 implique que Se = 0. -6-La transformation est isobare et adiabatique.
Le système {calorimètre + son contenu} est soumis à deux types de travaux : avec R = U/I = Ϯё͘cette formulation est limitée aux systèmes de composition constante. Ici, pour maintenir la pression constante, le
fuites thermiques ce qui entraîne une surestimation du résultat.part, le signe de la grandeur est correct : la vaporisation est un phénomène endothermique qui nécessite un apport de
6. Loi de Raoult et de Henry (*)
1. Expressions du potentiel chimique :
saturante de i : constituant i mais pur. On en déduit la loi de Raoult : ܲൌݔκܲ -7-4. Expressions du potentiel chimique du constituant i dans chacune des deux phases :
Ont été utilisés les arguments suivants : La solution est infiniment diluée : ݊௦௩௧κبLa quantité de matière de solvant ݊௦௩௧κ est reliée à son volume grâce au volume molaire : ܸൌ݊௦௩௧κܸ
En introduisant le terme RT ln KH (avec KH : constante de Henry pour le constituant i à la température T), on aboutit à la
loi de Henry : ܲൌݔκܭ6. La courbe expérimentale présente bien deux asymptotes :
La zone intermédiaire correspond aux mélanges réels entre les deux situations extrêmes où i est solvant et soluté.
7. Mélange de deux gaz (*)
Calculs préliminaires :
ͻ Quantité de matière de diazote : ݊ேమൌ ͻ Quantité de matière de dioxygène : ݊ைమൌͲǡʹͲ݈݉ avant et après le mélange :Diazote Dioxygène
-8- puisque le potentiel chimique standard dépend de la température. Ainsi :Conclusion :
Puisque les températures des deux gaz restent constantes lors de ce mélange. Comme la température de chaque gaz reste constante pendant ce mélange :Remarque : il est facile de prouver le caractère isotherme du mélange étudié ici. En effet, le premier principe appliqué au
pressantes : W = 0. Les parois du récipient sont calorifugées : Q = 0. Puisque les deux gaz ont la même température initiale et la même température finale. -9-4. Dans une solution saturée de diiode, le diiode est en équilibre sous deux phases : soluté dans la phase aqueuse et solde
pur (xI2,solide = 1). De fait, le potentiel chimique du diiode prend la même valeur dans les deux phases en équilibre :
que soluté dans la solution :5. Une concentration molaire est déterminée par spectrophotométrie selon un dosage par étalonnage :
Réglage du spectrophotomètre :
o Réalisation du zéro avec le solvant (CCl4 ici) Tracé de la courbe A = f(C) et vérification de sa linéarité.En dehors du diiode, toutes les espèces sont incolores. La présence de diiode en solution aqueuse est attestée par une
Si la concentration du diiode en phase organique est donnée, celle en phase aqueuse doit être déterminée à partir du
-10-9. Etude de documents : Montée de la sève dans les arbres (***)
Où Psurf représente la pression à la surface supérieure du liquide et z la " profondeur » du point considéré par rapport à
la surface du liquide.2. Le solvant est en équilibre sous deux phases, correspondant aux deux compartiments.
Où xA représente la fraction molaire du solvant dans le mélange {solvant + soluté} à gauche.
que ܸla montée de sève correspond à une pression à la surface supérieure de la sève négligeable devant 1 bar, alors
4. Une concentration massique de 20 à 30 g.L-1 de sucres (C12H22O11) dans la sève équivaut à une concentration molaire de
Cette hauteur est insuffisante pour le cas des séquoias géants. -11-Schéma 1 Schéma 2
Schéma 1 : à partir de la relation de la statique des fluides, ܲ௧ൌܲெߩ
Schéma 2 : le document 2 précise que la pression au-dessus du ménisque (Patm ici) présente une surpression
par rapport la pression sous le ménisque (PM) : ܲ௧ൌܲPar définition, pour la pression exercée par une colonne de 760 mm de mercure correspond à la pression atmosphérique.
La pression exercée par une colonne de 100 cm = 1000 mmHg est un tiers plus importante que la pression
atmosphérique.La pression en bas du tube vaut toujours Patm. La pression à la surface supérieure du mercure se déduit de la loi de la
statique des fluides : ܲ௧ൌܲ௦௨ߩSans évaporation : ܲ௧ൌܲ௦௨௦௦௩௧ߩ݄݃ଵൎߩ݄݃ଵ avec ݄ଵൌͲ݉݉ܪ
La pression en bas du tube vaut toujours Patm. La pression à la surface supérieure du mercure se déduit de la loi de la
qui tire sur la colonne de liquide et fait monter la sève.10. Potentiel hydrique (***)
4. Expression du potentiel hydrique :
quotesdbs_dbs32.pdfusesText_38[PDF] exercice de chimie 1ere année biologie
[PDF] cours préparatoire mp tunisie pdf
[PDF] cours de tce 1er année biologie pdf
[PDF] les cours de geologie pdf
[PDF] cours de biologie cellulaire 1ere année snv
[PDF] cours biologie cellulaire usthb
[PDF] td physique 1ere année snv
[PDF] physique 1 annee snv
[PDF] chimie analytique cours pharmacie
[PDF] cristallographie coordinence
[PDF] résumé cristallographie
[PDF] cours cristallographie pdf
[PDF] cristallographie compacité
[PDF] chimie tout-en-un pcsi pdf
