 TS1 QUOTIENT DE RÉACTION 02/01/2006 Exercice n°1. On
TS1 QUOTIENT DE RÉACTION 02/01/2006 Exercice n°1. On
2 janv. 2006 Calculer le quotient de la réaction pour ces deux valeurs d'avancement. Conclure. Exercice n°4. ACIDE MÉTHANOÏQUE ET ION ÉTHANOATE. Une ...
 TS2 Critère dévolution spontanée Exercice n°1: Mélange acide
TS2 Critère dévolution spontanée Exercice n°1: Mélange acide
Exercice n°1: Mélange acide/base. On réalise le mélange suivant : – V1 = 200 Donner l'expression du quotient initial de réaction Qr
 Transformations chimiques
Transformations chimiques
Exercices du chapitre 2. Les transformations chimiques. Corrigés des exercices 2) Exprimer le quotient de réaction Qr en fonction de la quantité de matière de.
 Sens dévolution spontanée dun système Exercices p 141 qcm n° 1
Sens dévolution spontanée dun système Exercices p 141 qcm n° 1
Quantité des ions iodure ayant réagi. A l'équilibre le quotient de réaction de la transformation (2) égale à la constante d'équilibre.
 Les transformations chimiques - Enoncés des exercices
Les transformations chimiques - Enoncés des exercices
15 sept. 2017 Exprimer leur quotient de réaction Q en fonction des activités des espèces mises en jeu ... Calculer r. Exercice 3 : avancement volumique ξv d' ...
 Exercices du chapitre Chimie 6 : Quotient de réaction ; constante d
Exercices du chapitre Chimie 6 : Quotient de réaction ; constante d
Exercices du chapitre Chimie 6 : Quotient de réaction ; constante d'équilibre. TS. Exercices – Chimie 6 : Quotient de réaction ; constante d'équilibre. Page 1
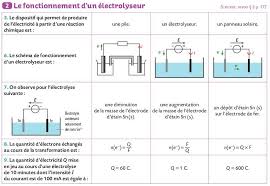 Exercices CH 9 Forcé le sens dévolution dun système p 179 qcm n
Exercices CH 9 Forcé le sens dévolution dun système p 179 qcm n
Quotient de réaction (2) et sens d'évolution spontanée. c. Evolution notable ? d. Méthode pour faire évoluer le système. Page 4
 Terminale générale - Exercices - Devoirs
Terminale générale - Exercices - Devoirs
Quelle est l'équation d'oxydoréduction qui a lieu entre les ions iodures et les ions peroxodisulfate ? 2. Exprimer le quotient de réaction. 3. Combien vaut Qri.
 TD 7 - Quotients de réaction équilibres 1 Exercice 1 - Ecriture de
TD 7 - Quotients de réaction équilibres 1 Exercice 1 - Ecriture de
2 Exercice 2 - Prévision du sens d'évolution. On considère la réaction acido-basique suivante de constante de réaction K = 0
 Correction des exercices du chapitre 6
Correction des exercices du chapitre 6
: la réaction n'est pas totale. c. et d. Quotient de réaction et constante de réaction dans l'état d'équilibre : D'après la conservation de la matière
 Exercices du chapitre Chimie 6 : Quotient de réaction ; constante d
Exercices du chapitre Chimie 6 : Quotient de réaction ; constante d
Exercices du chapitre Chimie 6 : Quotient de réaction ; constante d'équilibre. TS. Exercices – Chimie 6 : Quotient de réaction ; constante d'équilibre.
 TD 7 - Quotients de réaction équilibres 1 Exercice 1 - Ecriture de
TD 7 - Quotients de réaction équilibres 1 Exercice 1 - Ecriture de
1 Exercice 1 - Ecriture de quotients de réaction. Question (1.1). Ecrivez le quotient de réaction des réactions suivantes : 1.1.a.) Ag+ + Cl? = AgCl(s) ;.
 TD n° 1 Etude des équilibres - Corrigé
TD n° 1 Etude des équilibres - Corrigé
Exercice 4 : calcul des concentrations initiales et sens d'évolution spontanée Il faut comparer la valeur du quotient de réaction dans l'état initial Qr ...
 Evolution spontanée dun système chimique – Exercices
Evolution spontanée dun système chimique – Exercices
Ecrire l'équation de la réaction chimique qui se produit entre les ions argent et le métal cuivre. 2. Déterminer le quotient de réaction initial.
 Les transformations chimiques - Enoncés des exercices
Les transformations chimiques - Enoncés des exercices
Exercice 1 : expressions de quotients réactionnels Exprimer leur quotient de réaction Q en fonction des activités des espèces mises en jeu.
 Correction des exercices du chapitre 6
Correction des exercices du chapitre 6
: la réaction n'est pas totale. c. et d. Quotient de réaction et constante de réaction dans l'état d'équilibre : D'
 Quotient de réaction ; constante déquilibre
Quotient de réaction ; constante déquilibre
2) Calcul du quotient de réaction Qr : règles à appliquer a) Le solvant b) Solide c) gaz. Conclusion d) Exercices. 3) Quotient de la réaction inverse.
 Système chimique et équilibre
Système chimique et équilibre
Exercice C2 – Exprimer un quotient de réaction. Donner l'expression du quotient de réaction associé à chacune des réactions ci-dessous.
 Évolution dun système chimique vers un état final 1
Évolution dun système chimique vers un état final 1
Exercices d'application du cours. Expression des activités et quotients de réaction. Exercice 1. Dans chaque cas exprimer les activités de chacun des
 Chapitre 5 Aspects macroscopiques - Exercices
Chapitre 5 Aspects macroscopiques - Exercices
Donner l'expression du quotient de réaction Qr. 3. Calculer la valeur de Qr et préciser le sens d'évolution de la transformation chimique. EXERCICE 3 : Synthèse
 [PDF] Exercices du chapitre Chimie 6 : Quotient de réaction
[PDF] Exercices du chapitre Chimie 6 : Quotient de réaction
Exercices du chapitre Chimie 6 : Quotient de réaction ; constante d'équilibre TS Exercices – Chimie 6 : Quotient de réaction ; constante d'équilibre
 [PDF] TD 7 - Quotients de réaction équilibres 1 Exercice 1 - Pierre Adroguer
[PDF] TD 7 - Quotients de réaction équilibres 1 Exercice 1 - Pierre Adroguer
1 Exercice 1 - Ecriture de quotients de réaction Question (1 1) Ecrivez le quotient de réaction des réactions suivantes : 1 1 a ) Ag+ + Cl? = AgCl(s) ;
 Quotient de réaction exercices de chimie de terminale S correction
Quotient de réaction exercices de chimie de terminale S correction
Correction des exercices de chimie sur le Quotient de réaction la constante d'équilibre et le taux d'avancement final d'une réaction chimique pour la
 [PDF] Correction des exercices du chapitre 6 - Physagreg
[PDF] Correction des exercices du chapitre 6 - Physagreg
Correction exercices 1 Correction des exercices du chapitre 6 Exercice n° 19 p 124 : a Equation de la réaction : Fe3+ (aq) + SCN- (aq) = FeSCN2+ (aq)
 [PDF] Enoncés des exercices
[PDF] Enoncés des exercices
15 sept 2017 · 2) Exprimer le quotient de réaction Qr en fonction de la quantité de matière de chacun des constituants de la pression totale Ptot et de P°
 [PDF] Les transformations chimiques - Corrigés des exercices
[PDF] Les transformations chimiques - Corrigés des exercices
15 sept 2017 · Exercice 1 : expressions de quotients réactionnels 2) Proposer l'équation chimique de la réaction chimique qui est observée :
 [PDF] Exercices de révisions : Physique-chimie
[PDF] Exercices de révisions : Physique-chimie
Exercice n°3 : Quantité de matière et tableau d'avancement Il s'agit de la réaction de combustion du 11-diméthylhydrazine avec pour comburant le
 [PDF] 3 Exercice :4 - AlloSchool
[PDF] 3 Exercice :4 - AlloSchool
Exercice :1 Écrire les équations des réactions suivantes ainsi que les expressions littérales de leurs quotients de réaction a)- Réaction de l'ion argent
 [PDF] Evolution spontanée dun système chimique - Exercices - Devoirs
[PDF] Evolution spontanée dun système chimique - Exercices - Devoirs
Quelle est l'équation d'oxydoréduction qui a lieu entre les ions iodures et les ions peroxodisulfate ? 2 Exprimer le quotient de réaction 3 Combien vaut Qri
 [PDF] dossier 8 équilibre chimique et quotient de réaction - Mediachimie
[PDF] dossier 8 équilibre chimique et quotient de réaction - Mediachimie
6 jan 2021 · Notions et contenus Quotient de réaction Qr Système à l'équilibre chimique : constante d'équilibre K(T) Critère d'évolution spontanée d'un
Comment calculer le quotient de la réaction ?
L'état d'équilibre est l'état final d'un système réactif. A chaque esp? chimique est associée une grandeur sans dimension dont la valeur vaut 1 lorsque l'esp? chimique se trouve à l'état standard . Cette grandeur est l'activité de l'esp? chimique concernée.Comment calculer QR ?
Transformation totale : une transformation chimique est totale si au moins l'un des réactifs a été entièrement consommé. Transformation non totale : une transformation chimique est non totale si tous les réactifs sont encore présents à la fin de la réaction.
 1
1 EXERCICE 1 : QCM
1. Une synthèse organique se fait en 3 étapes ;
les rendements respectifs sont 95%, 79 % et81%. Quel est le rendement global de la
synthèse ? :A. 85 %
B. 61 %
C. 255 %
2. Pour une réaction endothermique, une
augmentation de la température du système, permet :A. 'ĂŵĠliorer le rendement
3. Laquelle de ces affirmations sur les catalyseurs
A. Il est consommé et régénéré au cours de la synthèse.B. Il accélère la réaction en abaissant
réactifs on parle de catalyse hétérogène générateur délivrant une intensité de 100 mA pendant 1 heure ?A. Q = 360 C
B. Q = 36 000 C
C. Q = 2,7x10-5 C
EXERCICE 2 : Quotient réactionnel
Dans un bécher, on mélange les espèces suivantes :5,0 g de cuivre solide en poudre
La transformation chimique qui se produit est : 2 Fe3+ (aq) + Cu(s) = 2 Fe2+(aq) + Cu2+(aq) EXERCICE 3 : Synthèse avec un meilleur rendementL'équation de réaction de synthèse de l' éthanoate de linalyle s'écrit sous la forme :
C10H18O + C4H6O3 = C12H20O2 + C2H4O2
linalol anhydride acétique éthanoate de linalyle acide acétique
2Linalol Anhydride
éthanoïque
Ethanoate de
linalyle (ester) Acide éthanoïque Densité dA = 0,87 dB = 1,08 dC = 0,89 dE = 1,18Masse molaire
(g.mol-1) MA = 154 MB = 102 MC = 196 ME = 601. A quelle famille appartient cette transformation chimique ?
- le réactif limitant de la réaction4. Citer 2 paramètres à modifier pour améliorer le rendement de la synthèse.
EXERCICE 4 : Elaboration du zinc par électrolyse cathode. Données : couples oxydant/réducteur : Zn2+(aq) / Zn(s) ; H+(aq) / H2(g) ; O2(g) / H2O(l)1) Schématiser l'électrolyseur en précisant le nom de chaque électrode, les polarités du générateur et le sens
de déplacement des porteurs de charges.2) Ecrire les demi-équations des réactions se produisant aux électrodes.
EXERCICE 5 : Chromage des jantes
Pour protéger des jantes de moto en acier (alliage de fer métallique et de carbone) contre la corrosion. Elles sont
contenant des ions chrome (III).1) Lister le matériel et les produits nécessaires pour le chromage des jantes par électrolyse.
4) En réalité, m = 100 g de chrome ont été déposé sur la jante. En déduire la valeur du rendement R de
Données : Masse molaire du chrome M(Cr) = 52 g.mol-1 3EXERCICE 6 : QCM
rapport suivant :A. ߟ
B. ߟ
C. ߟ
réaction :B. De réduction
suivante est vérifiée :A. QR < K
B. QR > K
C. QR = K
4. Quels paramètres peuvent influer sur le
A. La température
Exercice 7 : Vrai ou faux
Pour chacune des propositions suivantes, indiquer si la réponse est exacte ou non : produit du rendement de chacune des étapes. moléculaire.3. En catalyse hétérogène, le catalyseur et les réactifs sont dans la même phase.
Exercice 8 : Taxol et Taxotère®
Le taxol et le Taxotère® sont des substances actives aux propriétés anticancéreuses, ce sont des alcaloïdes obtenus
par hémisynthèse à partir d'une molécule extraite des feuilles de l'if européen (Taxus baccata).
4Sources : Médiachimie
1. Pourquoi les chercheurs ont préféré travailler sur la synthèse du Taxotère® plutôt que sur le Taxol?
à une synthèse totale ?
pour le développement durable ?DOCUMENT 1 : Le taxol
Au début des années 1960, devant le nombre toujours croissant de cancers, des équipes de chercheurs se sont penchées sur
l'obtention de molécules aux propriétés anticancéreuses. Après avoir passé au crible bon nombre d'espèces végétales, des
botanistes et des chimistes ont remarqué que l'Ġcorce de l'if du Pacifique contenait une molécule intéressante, le taxol.
Cependant, le taxol, initialement isolé de l'écorce du tronc de l'if du Pacifique, n'y est présent qu'en faible quantité. Au mieux,
un arbre centenaire peut produire 3 kg d'écorces, soit 300 mg de taxol. Même en optimisant le processus extractif, la
production de 1 kg de taxol nécessite environ 7 tonnes d'écorces et le traitement d'un seul patient pendant 1 an nécessite en
moyenne l'abattage de 3 arbres. On ne peut donc pas envisager une production industrielle sans à terme détruire l'espèce.
Ainsi, entre 1983 et 1993, un grand nombre de laboratoires ont travaillé sur la synthèse totale du taxol à partir de dérivé simple
du pétrole en y arrivant en pas moins de 30 étapes. Au cours de l'Ġlaboration de cette synthèse, ils ont imaginé une autre
molécule, le Taxotère, cousine du taxol, mais deux fois plus efficace et avec moins d'effets secondaires.
Différentes possibilités d'exploitation ont été envisagées et testées pour produire le Taxotère. Une seule a été retenue pour
le produire en quantité plus importante: les feuilles de l'if Européen (Taxus baccata). Matière première aisément renouvelable,
elles contiennent en quantité importante (de 0.02 à 0.1%) la partie cyclique de la molécule de Taxotère: la 10-
désacétatylbaccatine III ou DAB III. Le Taxotère est alors élaboré par hémisynthèse à partir de cet analogue structural, le DAB
III. C'est Pierre Potier qui est à l'origine de cette découverte en 1986 et qui propose en 1988 l'hémisynthèse actuelle.
quotesdbs_dbs33.pdfusesText_39[PDF] r archimédien demonstration
[PDF] dérivation première s
[PDF] relation metrique dans un cercle
[PDF] relation métrique et angulaire dans le triangle
[PDF] différence symétrique de deux ensembles
[PDF] complémentaire d'un ensemble
[PDF] a\b ensemble
[PDF] différence de deux ensembles
[PDF] partition d'un ensemble exercices
[PDF] différence symétrique démonstration
[PDF] partition d'un ensemble démonstration
[PDF] arguments contre l'existence de dieu
[PDF] math 5eme 2017
[PDF] géométrie 5e collège
