 2 - Quels solides conduisent le courant électrique ? • Compétences
2 - Quels solides conduisent le courant électrique ? • Compétences
conducteurs. Le sulfate de cuivre peut être conducteur puisqu'il y a le mot « cuivre » dedans. par contre
 Sur les propriétés magnétiques du cuivre et de quelques sels de
Sur les propriétés magnétiques du cuivre et de quelques sels de
Lorsque le cuivre pur a été manipulé il est toujours magnétique à l'appareil; a /br~'9r~ lorsqu'il a été travaillé. Ce n'est qu'après quelques lavages dans
 Pierron - Conductibilité électrique des solutions aqueuses
Pierron - Conductibilité électrique des solutions aqueuses
o Sulfate de cuivre II o Pour montrer le caractère conducteur ou non des solutions aqueuses il faut ... solutions aqueuses n'est pas de constater.
 Observations : Identification des réactifs : Identification des produits
Observations : Identification des réactifs : Identification des produits
La réaction entre le sulfate de cuivre et le zinc : C'est donc le zinc Zn qui est l'autre réactif. ... Que s'est-il passé pour le réactif Cu2+ ?
 Conductibilité électrique de solides _Doc. professeur
Conductibilité électrique de solides _Doc. professeur
o Le sucre le sel et le sulfate de cuivre II doivent être bien secs pour l'expérience et déposés Le corps humain est-il conducteur ou isolant ?
 ANNALES SCIENCES PHYSIQUES 3ème
ANNALES SCIENCES PHYSIQUES 3ème
Tout conducteur est caractérisé par sa résistance au passage du courant. solution de sulfate de cuivre des ions Cu²+ se transforment en atomes.
 Sommaire
Sommaire
sulfate de cuivre » : ce solide de couleur blanche quand il est 1- Quels sont les liquides bons conducteurs du courant électrique ?
 CHP 3 : Lion et la conduction électrique dans les solutions aqueuses
CHP 3 : Lion et la conduction électrique dans les solutions aqueuses
I) Toutes les solutions aqueuses conduisent-elle le courant électrique ? La solution de sulfate de cuivre contient des ions sulfates qui sont incolores ...
 Instrumentation : modèle de spectrophotomètre
Instrumentation : modèle de spectrophotomètre
Il est possible de tester le spectrophotomètre calibré en effectuant une mesure de solution de sulfate de cuivre mais toute solution colorée pourrait ...
 CUIVRE COMPOSES ET ALLIAGES
CUIVRE COMPOSES ET ALLIAGES
10 mars 2015 cuivre étudiés dans cette fiche
 [PDF] Sommaire - Blogpeda
[PDF] Sommaire - Blogpeda
Tu as appris à détecter la présence d'eau au moyen du « test au sulfate de cuivre » : ce solide de couleur blanche quand il est déshydraté bleuit en présence
 [PDF] Toutes les solutions aqueuses conduisent-elles le courant électrique
[PDF] Toutes les solutions aqueuses conduisent-elles le courant électrique
3 Les solutions qui conduisent le courant électrique sont l'eau salée la solution de sulfate de cuivre et la solution de permanganate de potassium
 [PDF] LES LIQUIDES CONDUISENT-ILS LE COURANT ? – TP CH3 LA
[PDF] LES LIQUIDES CONDUISENT-ILS LE COURANT ? – TP CH3 LA
Les solutions de sulfate de cuivre et d'eau salée conduisent le courant puisqu'il s'affiche une intensité sur l'ampèremetre Quelle solution d'eau salée conduit
 [PDF] 2 - Quels solides conduisent le courant électrique
[PDF] 2 - Quels solides conduisent le courant électrique
Le sulfate de cuivre peut être conducteur puisqu'il y a le mot « cuivre » dedans par contre je pense que le sucre est isolant 2 Montage Pour tester les
 [PDF] Conductibilité électrique de solides _Doc professeur - Pierron
[PDF] Conductibilité électrique de solides _Doc professeur - Pierron
Le cuivre le fer l'aluminium et le zinc sont des solides conducteurs Ce sont tous des métaux b Quels sont les solides qui ne conduisent pas le courant
 [PDF] TP1 Conduction electrique
[PDF] TP1 Conduction electrique
ions sulfate ne colorent pas la solution à quel ion est due la couleur de la solution ? • L'ion cuivre est-il un ion positif ou un ion négatif ? La solution de
 [PDF] Conduction électrique et structure de la matière
[PDF] Conduction électrique et structure de la matière
Pour tester le caractère conducteur ou isolant d'une solution il faut -du sulfate de cuivre contenant entre autres des ions positifs de couleur bleue
 [PDF] DOCUMENT (daprès Wikipédia)
[PDF] DOCUMENT (daprès Wikipédia)
Le sel de table est un assemblage d'ions sodium Na + et d'ions chlorure Cl ? Le sulfate de cuivre est formé par la combinaison d'un ion cuivre (Cu2+)
 Chapitre III - Conduction électrique des solutions aqueuses
Chapitre III - Conduction électrique des solutions aqueuses
De nombreux cristaux sont constitués d'ions ( sel sulfate de cuivre ) Un cristal ionique n'est donc pas un conducteur électrique
Est-ce que le sulfate de cuivre est conducteur ?
On peut en déduire que l'eau salée et la solution de sulfate de cuivre sont conductrices car elles contiennent de particules électriquement chargées. Ce sont ces particules qu'on appelle des ions.Pourquoi le cuivre est un bon conducteur ?
alors pourquoi le cuivre et ils conducteur. le courant électrique on l'a vu c'est une circulation d'électrons or il se trouve que. l'atom de cuivre poss? sur sa dernière orbite. un électron qui ne demande qu'à se déplacer un.Quel est la nature du courant électrique dans la solution de sulfate de cuivre 2 ?
Le courant électrique dans la solution de sulfate de cuivre et dans le cuivre (métal) n'est pas dû au déplacement du même type de porteurs de charges. Dans la solution de sulfate de cuivre : ce sont des ions qui se déplacent. Dans le métal cuivre : ce sont des électrons libres qui se déplacent.- Les solutions d'alcool et d'eau pure ne contiennent que des molécules et ne laissent pas passer le courant.
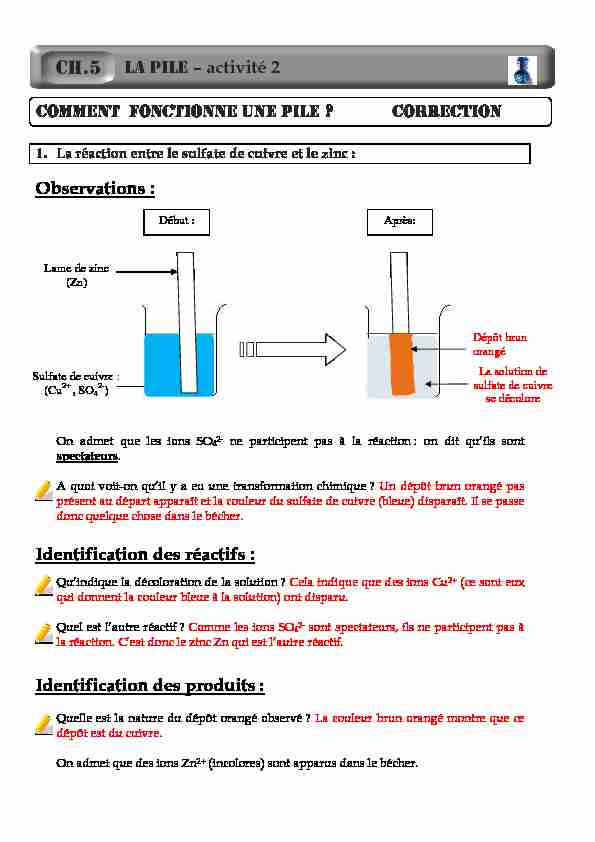
1. La réaction entre le sulfate de cuivre et le zinc :
Observations :
On admet que les ions SO42- ne participent pas à la réaction : on dit qu'ils sont
spectateurs A quoi voit-on qu'il y a eu une transformation chimique ?Un dépôt brun orangé pas
présent au départ apparaît et la couleur du sulfate de cuivre (bleue) disparaît. Il se passe
donc quelque chose dans le bécher.Identification des réactifs :
Qu'indique la décoloration de la solution ? Cela indique que des ions Cu2+ (ce sont eux qui donnent la couleur bleue à la solution) ont disparu.Quel est l'autre réactif ?
Comme les ions SO42- sont spectateurs, ils ne participent pas à la réaction. C'est donc le zinc Zn qui est l'autre réactif.Identification des produits :
Quelle est la nature du dépôt orangé observé ?La couleur brun orangé montre que ce
dépôt est du cuivre.On admet que des ions Zn
2+ (incolores) sont apparus dans le bécher.
CH.5 COMMENT FONCTIONNE UNE PILE ? CORRECTIONLame de zinc
(Zn)Sulfate de cuivre :
(Cu2+ , SO42-)
Dépôt brun
orangéLa solution de
sulfate de cuivre se décoloreDébut :
Après:
LA PILE - activité 2
Bilan de la transformation chimique :
Réactif 1 + Réactif 2 Produit 1 + Produit 2
Cu2+ + Zn Cu + Zn2+Interprétation de la transformation :
Que s'est-il passé pour le réactif Zn ?
L'atome Zn s'est transformé en
Zn2+ en perdant 2 e-.
Zn Zn
2+ + 2 e-
Que s'est-il passé pour le réactif Cu
2+ ?L'ion Cu
2+ s'est transformé en Cu en gagnant 2 e-
Cu2+ + 2 e- Cu
Donc lors de la transformation, l'ion Cu2+ a capturé les 2e- libérés par l'atome de zinc Zn
pour former un atome de cuivre Cu.2. Comment utiliser cet échange d'électron pour produire un courant ?
Lors de la transformation précédente, il y a échange d'électrons entre Cu2+ et Zn. Cet
échange d'électrons se fait lorsque l'ion Cu2+ et l'atome Zn sont en contact.
On sait que le courant dans les fils conducteurs correspond à un déplacement d'électrons. Ne pourrait-on pas utiliser cet échange d'électrons pour produire un courant ?Il suffit d'éloigner l'ion Cu2+ de l'atome Zn et de les relier par un fil conducteur. Ils
continueraient d'échanger leurs 2 électrons par l'intermédiaire du fil conducteur. Ainsi, on crée un courant électrique dans le fil grâce à la transformation chimique.Fil conducteur
3. Fonctionnement de la pile Daniell :
Schématiser la pile Daniell :
Expliquer pourquoi la lame de zinc s'use. Ecrire la transformation mise en jeu.Zn Zn
2+ + 2 e-
Expliquer pourquoi la lame de cuivre s'épaissit. Ecrire la transformation mise en jeu. Cu2+ + 2 e- Cu
4. Pourquoi la pile s'use-t-elle ?
Au bout d'un certain temps d'utilisation, la pile n'arrive plus à débiter de courant. A votre avis pourquoi ? Deux hypothèses sont attendues. Justifiez-les. Si la pile n'arrive plus à débiter de courant c'est que : Soit il n'y a plus de zinc Zn pour fournir les électrons. Alors la réaction ne peut plus avoir lieu.Soit il n'y a plus d'ions cuivre Cu2+ pour récupérer les électrons. Alors la réaction ne
peut plus avoir lieu. La pile s'arrêtera lorsqu'un des deux réactifs Zn ou Cu2+ viendra à manquer.
Zn disparaît : la lame de zinc
s'use.Cu apparaît : la lame de cuivre s'épaissit.
quotesdbs_dbs33.pdfusesText_39[PDF] glossaire transport maritime
[PDF] glossaire maritime pdf
[PDF] cours transport maritime pdf
[PDF] calcul stabilité navire
[PDF] exercices corrigés de stabilité du navire pdf
[PDF] principe des travaux virtuels exercices+corrigés
[PDF] exemple déplacement virtuel
[PDF] principe des travaux virtuels poutre
[PDF] principe des travaux virtuels pdf
[PDF] théorème des travaux virtuels mécanique
[PDF] théorème des travaux virtuels rdm
[PDF] principe des travaux virtuels exercices+corrigés pdf
[PDF] méthode des déplacements exercices corrigés
[PDF] formulaire demande de déplacement professionnel
