 Exercices Cinétique électrochimique – Courbes intensité-potentiel
Exercices Cinétique électrochimique – Courbes intensité-potentiel
Donner l'expression de la tension minimale d'une électrolyse en tenant compte des termes de chute ohmique et de surtension. Correction détaillée en vidéo.
 Cinétique électrochimique
Cinétique électrochimique
23 mar. 2022 Correction TD 23 : Cinétique électrochimique. Blaise Pascal PT 2021-2022. Exercice 2 : Allure d'une courbe intensité-potentiel
 Corrigé des TD R2 et R3 - Cinétique électrochimique
Corrigé des TD R2 et R3 - Cinétique électrochimique
Courbes de POLARISATION : CARACTERISTIQUES ET UTILISATION. 7/ Vrai. EXERCICE 1: PALIERS DE DIFFUSION. 1/ Aucune surtension à vide anodique ou cathodique n'est
 Cinétique électrochimique
Cinétique électrochimique
23 mar. 2022 accéder aux corrigés ... Représenter l'allure de la courbe intensité-potentiel obtenue. Exercice 2 : Allure d'une courbe intensité-potentiel ...
 Cinétique électrochimique
Cinétique électrochimique
14 mar. 2023 Correction TD 23 : Cinétique électrochimique. Blaise Pascal PT 2022-2023. Exercice 2 : Allure d'une courbe intensité-potentiel
 Exercices de révision- Oxydo-réduction et Piles électrochimiques
Exercices de révision- Oxydo-réduction et Piles électrochimiques
Corrigé. Exercice I. On considère la pile symbolisée par: Cu / Cu2+ (01M) Exercices de révision- Oxydo-réduction et Piles électrochimiques
 Electrochimie des solides - Exercices corrigés avec rappels de cours
Electrochimie des solides - Exercices corrigés avec rappels de cours
4.2 - Cinétique électrochimique. 76. 4.2.1 - Rappels électrochImIe des solIdes - exercIces corrIgés aVec rappels de cours. Exercice 3.13 - SrZrO3 conducteur ...
 Filière sciences de la matière Cours délectrochimie SMC Semestre 5
Filière sciences de la matière Cours délectrochimie SMC Semestre 5
CHAPITRE III : CINETIQUE ELECTROCHIMIQUE. I. Polarisation et surtension d'une Correction de diffusion : graphique semi-logarithmique (cas d'oxydation).
 Cinétique électrochimique
Cinétique électrochimique
Son principe est abordé dans l'exercice 1 de la rubrique « Pour s'entraîner ». 2. Modifications des courbes intensité-potentiel. 2.1. Courant limite de
 Exercices Cinétique électrochimique – Courbes intensité-potentiel
Exercices Cinétique électrochimique – Courbes intensité-potentiel
Donner l'expression de la tension minimale d'une électrolyse en tenant compte des termes de chute ohmique et de surtension. Correction détaillée en vidéo.
 PDF Compressor
PDF Compressor
Corrigé du TD R2/R3- Cinétique électrochimique. 2. EXERCICE 2 PREMIERE APPROCHE DE LA CORROSION DU FER EN MILIEU HUMIDE. 1.a/ D'une part le fer n'est pas
 Cinétique électrochimique
Cinétique électrochimique
7 avr. 2021 TD 25 – Électrochimie. Correction. Cinétique électrochimique. Exercice 1 : Allure d'une courbe intensité-potentiel.
 APPROCHE QUALITATIVE DE LA CINETIQUE ELECTROCHIMIQUE
APPROCHE QUALITATIVE DE LA CINETIQUE ELECTROCHIMIQUE
TD C3 : ELECTROCHIMIE : APPROCHE QUALITATIVE DE LA CINETIQUE. ELECTROCHIMIQUE. Exercice 1 : Système rapide ou lent. Pour le couple H+ / H2(g)
 Cinétique électrochimique
Cinétique électrochimique
27 mar. 2021 Le cas échéant placer graphiquement le potentiel mixte et les courants anodique et cathodique. Exercice 1 : Allure d'une courbe intensité- ...
 Electrochimie des solides - Exercices corrigés avec rappels de cours
Electrochimie des solides - Exercices corrigés avec rappels de cours
électrochImIe des solIdes - exercIces corrIgés aVec rappels de cours. Exercice 1.9 - Etude cristallochimique et thermodynamique du dioxyde de thorium ThO2.
 Filière sciences de la matière Cours délectrochimie SMC Semestre 5
Filière sciences de la matière Cours délectrochimie SMC Semestre 5
CHAPITRE III : CINETIQUE ELECTROCHIMIQUE. I. Polarisation et surtension d'une électrode. I.1. Définition : I.2. Différents types de courbe de polarisation.
 li(jiI Nt)SUP
li(jiI Nt)SUP
Résumés de cours et exercices corrigés 2.5 - Synthèses électrochimiques ... cinétique oxydo-réduction et thermochimie
 Cinétique électrochimique
Cinétique électrochimique
Son principe est abordé dans l'exercice 1 de la rubrique « Pour s'entraîner ». 2. Modifications des courbes intensité-potentiel. 2.1. Courant limite de
 CORRIGE
CORRIGE
25 mar. 2016 PREMIER EXERCICE e2a PC 2015 ... Ce sujet a ... électrochimique d'une cellule élémentaire de pile à combustible peut être représenté selon.
 [PDF] Exercices Cinétique électrochimique – Courbes intensité-potentiel
[PDF] Exercices Cinétique électrochimique – Courbes intensité-potentiel
1 Rappeler et établir la relation entre vitesse d'une réaction électrochimique et intensité du courant 2 Quels phénomènes peuvent limiter cinétiquement une
 [PDF] Corrigé des TD R2 et R3 Cinétique électrochimique - AlloSchool
[PDF] Corrigé des TD R2 et R3 Cinétique électrochimique - AlloSchool
Corrigé du TD R2/R3- Cinétique électrochimique Exercice 2 PREMIERE APPROCHE DE LA CORROSION DU FER EN MILIEU HUMIDE 1 a/ D'une part le fer n'est pas
 [PDF] TD R2 et R3 Cinétique électrochimique - AlloSchool
[PDF] TD R2 et R3 Cinétique électrochimique - AlloSchool
TD R2/R3 – Cinétique électrochimique 3 R PC - Lycée Baimbridge – Mars 2018 A MOMIN EXERCICE 2 (***) : PREMIERE APPROCHE DE LA CORROSION DU FER EN
 [PDF] Cinétique électrochimique - Étienne Thibierge
[PDF] Cinétique électrochimique - Étienne Thibierge
23 mar 2022 · TD 23 – Électrochimie Correction Cinétique électrochimique Exercice 1 : Allure d'une courbe intensité-potentiel
 [PDF] TD n°14 Cinétique électrochimique
[PDF] TD n°14 Cinétique électrochimique
Cinétique électrochimique Exercice 1 : Couple du cuivre Le document ci-contre fournit la courbe courant-potentiel pour une électrode de cuivre au contact
 [PDF] Exercices : 20 -Électrochimie
[PDF] Exercices : 20 -Électrochimie
Exercices : 20 -Électrochimie A Thermodynamique de l'oxydo-réduction 1 Pile `a combustible On réalise la pile `a combustible représentée par :
 Exercices Cinétique électrochimique Courbes intensité-potentiel
Exercices Cinétique électrochimique Courbes intensité-potentiel
Exercices Cinétique électrochimique Courbes intensité-potentiel Applications directes du cours Potentiels standard : Couple Al 3+ Al Zn 2+ Zn Fe 2+ Fe Pb 2+
 Cinétique électrochimique - PDF Free Download - DocPlayerfr
Cinétique électrochimique - PDF Free Download - DocPlayerfr
Exercice 3 : Allure d une courbe intensité-potentiel toujours 2 1 i a (ma) 02 03 ? i c (ma) Surtension ; Courant de diffusion 02 ? ? 17 E ESH (V) 4 -
 [PDF] Electrochimie Exercice n° 1 :
[PDF] Electrochimie Exercice n° 1 :
Electrochimie Exercice n° 1 : On réalise la pile Daniell en utilisant : - un bécher renfermant 100cm3 d'une solution molaire de sulfate de
 Eléctrochimie SMC5 Cours // Td Et Exercices // Résumés // Examens
Eléctrochimie SMC5 Cours // Td Et Exercices // Résumés // Examens
30 sept 2019 · Eléctrochimie (SMC5) Cours // Td Et Exercices // Résumés // Examens cour Electrochimie SMC5 S5 PDF MODULE D'ELECTROCHIMIE Cours+TD SMC5
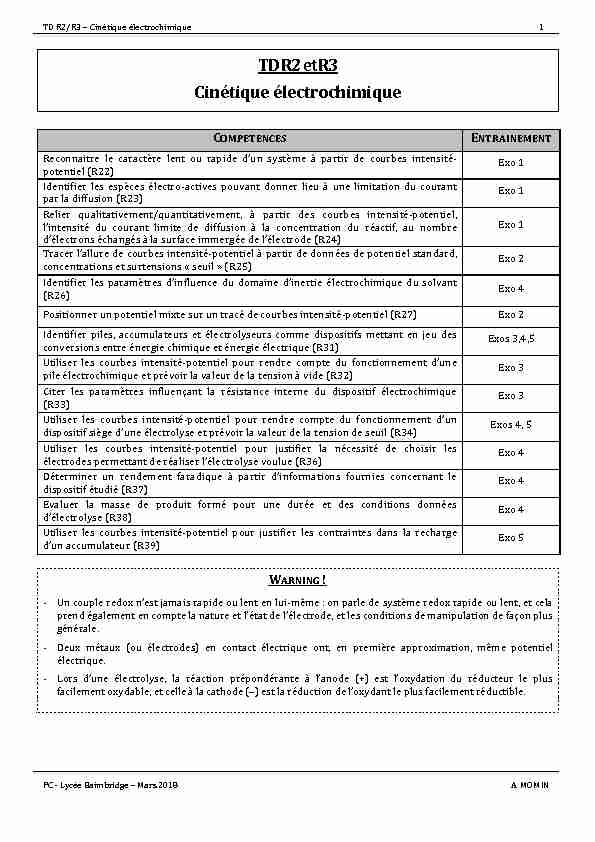
TDR2/R3-Cinétiqueélectrochimique1RPC-LycéeBaimbridge-Mars2018A.MOMINTDR2etR3CinétiqueélectrochimiqueCOMPETENCESENTRAINEMENTReconnaitrelecar actèrelen tourapided'unsystèmeàp artirdecou rbesinten sité-potentiel(R22)Exo1Identifierlesespècesélectro-activespouvantdonnerlieuàunelimitationducourantparladiffusion(R23)Exo1Relierqualitative ment/quantitativement,àpartirdescourbesintensité-potentiel,l'intensitéducourantlimiteded iffusionà laconcentrationduréactif,aunombred'électronséchangésàlasurfaceimmergéedel'électrode(R24)Exo1Tracerl'alluredecourbesintensité-potentielàpartirdedonnéesdepotentielstandard,concentrationsetsurtensions"seuil»(R25)Exo2Identifierlesparamètresd'influencedudomained'inertieélectrochimiquedusolvant(R26)Exo4Positionnerunpotentielmixtesuruntracédecourbesintensité-potentiel(R27)Exo2Identifierpiles,accumulateursetélectrolyseurscommedispositifsmettantenjeudesconversionsentreénergiechimiqueeténergieélectrique(R31)Exos3,4,5Utiliserlescourbesintensité-potentielpourrendrecomptedufonctionnementd'unepileélectrochimiqueetprévoirlavaleurdelatensionàvide(R32)Exo3Citerlesparamètresinfluençantlarésistanc einternedudispositifélec trochimi que(R33)Exo3Utiliserlescourbesint ensité-potentielpourrendrecompted ufonctionne mentd'undispositifsièged'uneélectrolyseetprévoirlavaleurdelatensiondeseuil(R34)Exos4,5Utiliserlescourbesint ensité-potentielpourjustifierlané cessité dechoisirlesélectrodespermettantderéaliserl'électrolysevoulue(R36)Exo4Déterminerunrendementfaradi queàpar tird'informationsfourniesc oncernantledispositifétudié(R37)Exo4Evaluerlamassede produitfo rmépouruneduréeetd escondit ionsdonnéesd'électrolyse(R38)Exo4Utiliserlescourbesintensité-potentielpourjustifierlescontraintesdanslarecharged'unaccumulateur(R39)Exo5WARNING!-Uncoupleredoxn'estjamaisrapideoulentenlui-même:onparledesystèmeredoxrapideoulent,etcelaprendégalementencomptelanatureetl'étatdel'électrode,etlesconditionsdemanipulationdefaçonplusgénérale.-Deuxmétaux( ouélectrodes)enco ntactéle ctriqueont,en premièr eapproximation,mêmepotent ielélectrique.-Lorsd'uneélec trolyse,laréacti onprépondéranteàl'anode(+)est l'oxydati onduréducteurleplusfacilementoxydable,etcelleàlacathode(-)estlaréductiondel'oxydantleplusfacilementréductible.
TDR2/R3-Cinétiqueélectrochimique2RPC-LycéeBaimbridge-Mars2018A.MOMINQCMDECOURSPrécisersilespropositionssuivantessontvraiesoufausses,enjustifiantlaréponse:1/Uneélectrodedezincpeutêtreemployéecommecontre-électrodedansunmontageàtroisélectrodesdestinéautracédecourbesintensité-potentiel.2/L'existencedepaliersdediffusionsurunecourbeintensité-potentielestlesigned'unelimitationdelavitessedetransfertdechargeversl'électrode.3/Unesurtensionanodiqueoucathodiqueestcaractéristiqued'uncoupleredox.4/Latensiondisponibleauxbornesd'unepileenfonctionnementestplusfaiblequecelleprévueparlathermodynamiqueenévolutionréversible.5/Latensionàappliquerauxbornesd'unélectrolyseurenfonctionnementestplusfaiblequecelleprévueparlathermodynamiqueenévolutionréversible.6/Lorsd'uneé lectrolyse,pour augmenterlerendementfaradiqueetlavi tessed'élect rolyse,on atoutintérêtàaugmenterlatensionappliquéeauxbornesdel'électrolyseur.7/Pourunaccumulateurdonné,ladifférencedepotentielanode/cathodeestplusélevélorsduprocessusdechargequelorsduprocessusdedécharge.COURBESDEPOLARISATION:CARACTERISTIQUESETUTILISATIONEXERCICE1(**):PALIERSDEDIFFUSIONOndonnelescourbesintensité-potentielrelativesauxsystèmessuivants:a/solutiondenitrated'argentAg#,NO'-àlaconcentration������=1,0×10/0molL/6/électroded'argent;b/solutiond'iodatedesodiumNa#,IO'-àlaconcentration������=1,0×10/0molL/6/électrodedeplatine(courbeobtenueenfaisantdécroitretrèslentementlepotentieldel'électrodedetravailàpartirdesavaleurmaximale).1/Lessystèmesélectrochimiques(a)et(b)sont-ilsrapidesoulents?2/Pourquoin'observe-t-onpasdepalierdediffusionanodiquepourlesystème(a)? 3/Pourquelleraisonobserve-t-ondesvaguesderéductiondehauteurdifférentepourlesystème(b)? 4/Prévoirl'alluredelacourbedepolarisationcorrespondantàunesolutiond'ionsFe0#etd'ionsAg#auxconcentrationsrespectives������et2������surélec trodedeplatine.Onconsidèreraquelescoe fficientsdediffusiondesdiversesespècessonttrèsvoisins,etquetouslescouplessontrapidessurélectrodedeplatine. Données:���°Ag#/Ag(s)=0,80V���°Fe'#/Fe0#=0,77V���°Fe0#/Fe(s)=-0,44VTD#R2#et#R3#-#Cinétique#électrochimique########2#R#PC#8#Lycée#Baimbridge#-#Mars#2015#########A.#MOMIN#COURBES!DE!POLARISATION!#EXERCICE#1#(*+)#:#COMPORTEMENT#DE#METAUX#ALCALINS#DANS#L'EAU#(CCP#PC)#1/#Établir#l'équation#de#la#réaction#du#lithium#sur#l'eau#avec#formation#d'ion#Li+#et#de#l'ion#hydroxyde#OH-.#2/#Calculer#la#constante#thermodynamique#de#cette#réaction,#K#°,#écrite#avec#un#coefficient#stoechiométrique#de#1#pour#Li,##à#l'aide#des#potentiels#standard#redox#des#couples#impliqués#et#de#pKe.#Conclure.#3/#Répondre#aux#mêmes#questions#pour#le#sodium.#Quel#est,#du#point#de#vue#thermodynamique,#le#plus#réactif#vis8à8vis#de#l'eau#?#4/#Les#courbes#intensité8potentiel,#tracées#à#pH#=#7,#des#diverses#espèces#intervenant,#sont#représentées#ci8dessous#:# A#quelle#vitesse#relative#le#lithium#et#le#sodium#sont8ils#oxydés#par#l'eau#(la#réponse#doit#être#justifiée#en#analysant#les#courbes#de#polarisation)#?#Quel#est#alors#le#potentiel#du#métal#en#solution#?##Données(à(298(K#:#E#°(Li+/Li(s))#=#-#3,04#V###E#°(Na+/Na(s))#=#-#2,71#V####pKe#=#14,0####!"!ln!=0,059!log!(!)##EXERCICE#2#(**)#:#PALIERS#DE#DIFFUSION#On#donne#les#courbes#intensité8potentiel#relatives#aux#systèmes#suivants#:#a) solution#de#nitrate#d'argent#(Ag+,#NO!-)#à#la#concentration#C0#=#1,0#1082#mol#L81#/#électrode#d'argent#b) solution#d'iodate#de#sodium#(Na+,#IO!-)#à#la#concentration#C0#/#électrode#de#platine####
TDR2/R3-Cinétiqueélectrochimique3RPC-LycéeBaimbridge-Mars2018A.MOMINEXERCICE2(***):PREMIEREAPPROCHEDELACORROSIONDUFERENMILIEUHUMIDELeferestunmétalductiletrèsabondantdanslacrouteterrestre.Additionnédecarboneetdediversadditifsmétalliques,ilformedesalliages,appelésaciers,dontlespropriétésmécaniquessonttrèslargem entsupérieuresàcellesdufe r,avecunmoduled'Youngdel'ordrede 200GPa.Lesac ierssontai nsidesmatériauxtrèscourantsdanslaconstruction.Leprincipaldéfautdesaciersestleursensibilitéàlacorrosion.Àl'airlibreetenprésenced'humidité,lefers'oxydeenformantdelarouille,composéedediversoxydesethydroxydesdefer(II)et(III).Nousétudionsiciquelquescaractéristiquesélémentairesdelacorrosionduferdansuneatmosphèrehumidemarine,commecellequel'onrencontredansleszoneslittoralesguadeloupéennes.L'objectifestdedéterminerlanatureetlemodedeformationdelarouille,etdejustifieruneobservationcourantesurlalocalisationdelacorrosiond'unnavire.1. StabilitéthermodynamiqueduferenmilieuhumideApartirdesdonnéesetdesdocumentsàvotredisposition:1.a/Justifierquedanslesconditionshumidesdécrites,lefern'estpasstableetpeuts'oxyderenFe(+II)etenFe(+III).DonnerleséquationsdesréactionscorrespondantesaupHmarin.1.b/Enprenantencomptel'évolutiondupHdanslafinecouched'eaudemerdéposéeàlasurfacedel'acier,proposerunecompositionchimiquequalitativepossiblepourlarouille.2. Caractéristiquescinétiquesdelaformationdelarouille2.a/Entraçantl'alluredescourbesintensité-potentielappropriées,justifierqualitativementquel'oxydationprépondéranteentrainelaformationd'hydroxydedefer(+III).2.b/Compléterleschémasuivantenindiquantlesespècesmanquantesetletrajetdesélectronsentrezonesanodiquesetzonescathodiques,quel'onindiquera.2.c/[Bonus]Enquoiuneeausaléeaccélère-t-elleleprocessusdecorrosiond'aprèslaquestionprécédente?Onpeutfacilementvérifier,enobservantdevieuxrafiots,quelacorrosionestplusprononcéesurlefonddelacoquequeprocheduniveaudeflottaisondunavire.Cephénomènes'appelle"corrosiondifférentielle».2.d/Enconsidérantl'évolutiondelapositiondelavaguecathodiquepourlaréductiondeO0enfonctiondelaconcentrationdissouteendioxygène,commentpeut-onexpliquerqueleszonescathodiquessontplutôtlocaliséesàproximitédelasurfacedeflottaison.Justifieralorsl'observationdécrite.Fe(s)O2(g)Fe(OH)3(s)eau saléeacieratmosphère
TDR2/R3-Cinétiqueélectrochimique4RPC-LycéeBaimbridge-Mars2018A.MOMINDocument1:Potentielsredoxà298KCoupleredoxFe'#(aq)/Fe(s)Fe0#(aq)/Fe(s)O0(aq)/H0O(l)H0O(l)/H0(g)Potentielredoxstandard���°(���)-0,04-0,441,280������M(NO)/PM���(Q)=1,28+0,015log���MS°-0,060p���V���PM���(Q)/PM(���)=-0,030logYZMY°-0,060p���VDocument2:DiagrammesE-pHduferetdel'eauConcentrationsdetracé:���[,\]=10/^molL/6(diagrammedufer);������M(NO)=5,1×10/_molL/6(diagrammedel'eau)Pressiondetracé:���PM=1bar(diagrammedel'eau)Document3:SurtensionscinétiquesSurtensionsanodiquessurfer:négligeablespourlescouplesFe0#(aq)/Fe(s)etFe'#(aq)/Fe(s).Surtensionscathodiquessurfer:������O0(aq)/H0O(l)≈-0,6V������H0O(l)/H0(g)≈-0,2VDocument4:L'eaudemerSalinitémoyenne:35gL/6(essentiellementionsNa#etionsCl/)pHmoyen:8,2PILES,ACCUMULATEURSETELECTROLYSEURSEXERCICE3(**+):PILESSALINESETPILESALCALINESOnconsidèrelesdeuxpilesdécritesdansletableauàlapagesuivante.1/Expliquerpourquoietdansquelbut,danscespiles,ledioxydedemanganèseestmélangéàdugraphite.2/Écrire,pourchaquepile, l'équationdelaréactiondefon ctionneme ntlor squecelle-cidébi te;on considèreraque,pourlesdeuxpiles,MnO0(s)estréduitenMnO(OH)(s).3/Onconsidèreunepilealcalineconstituéede6,0gdezincenpoudreet8,0gdedioxydedemanganèse;lamassedesautresconstituants(électrolyte,boitier,graphite...)estde18g.Laforceélectromotricedelapile
TDR2/R3-Cinétiqueélectrochimique5RPC-LycéeBaimbridge-Mars2018A.MOMINeste=1,5V.3.a/Calculerlacapacitédelapile,enC.3.b/Calculerl'énergiemassiquemaximale(enWhkg-1)produiteparcettepile.3.c/Indiquer,àl'aidedecourb esinte nsité-potentiel,lespointsdefonctio nnementanodique etcathodiquedelapile.Comments'exprimelatensiondélivréeparcettepilequandelledébiteuneintensitéi?Données:RConstanteglobaledeformationducomplexe[Zn(OH)k]0/à25°C:���=1,0×106_Produitdesolubilitédel'hydroxydedezinc,Zn(OH)0(s),à25°C:������=1,0×10/6pConstanted'aciditéde���������#:������=10/u,0Massesmolairesengmol-1:���(Mn)=54,9���(O)=16,0���(Zn)=65,4ConstantedeFaraday:ℱ=96485Cmol/6EXERCICE4(**+):PRODUCTIONDUDICHLOREPARDESPROCEDESELECTROLYTIQUESETAPPLICATION(MINESPSI2003)Ledichl oreestprodui tparélectrolysed'unesolu tionaqueusec oncentréedechloruredesodi um(lasaumure).Celle-ciest traitéepré alablementpouréliminer lesionscalcium,magnésiumetautresion smétalliquesgênants.Ilexis tedifférentsprocéd ésélectrolytiques:ce llulesàdiaphragmes(noné tudiées dansceproblème),cellulesàmembranesetcellulesàcathodedemercure(plusvieuxprocédé,tombéendésuétude).A-EtudepréliminaireAqu elleréactiond'élect rolysedoit-ons'att endreàp���=7,0sionn etientc ompteque decritèresthermodynamiques.TD#R2#et#R3#-#Cinétique#électrochimique########6#R#PC#8#Lycée#Baimbridge#-#Mars#2015#########A.#MOMIN#4/#L'anode#est#désormais#en#titane#recouvert#de#dioxyde#de#titane#TiO2#(non#électroactive),#et#la#cathode#en#platine.##4.a/#Tracer#les#courbes#intensité8potentiel#utiles#à#la#discussion,#à#partir#des#données#fournies.##4.b/#Quelles#sont#désormais#les#réactions#prépondérantes#aux#électrodes#?##4.c/#Evaluer#l'ordre#de#grandeur#de#la#tension#d'électrolyse#maximale#pour#conserver#un#rendement#faradique#de#100#%#à#l'anode,#si#on#peut#négliger#la#chute#ohmique).##4.d/#Déterminer#la#quantité#de#mati ère#de#pr oduit#formé#à#l'anode#dans #de#telle s#conditions#d'électrolyse,#sous#un#courant#de#100#A#et#pendant#30#minutes.#5/#La#cathode#en#platine#est#désormais#remplacée#par#une#cathode#en#mercure#("#procédé#à#cathode#en#mercure#»),#et#l'anode#est#en#titane.#Le#mercure#forme#avec#le#sodium#un#alliage#liquide#noté#Na(Hg)#et#appelé#amalgame#de#sodium.#Tracer#les#branches#cathodiques#des#courbes#intensité8potentiel#pertinentes,#et#conclure.##Données#:#E#°(O2(g)/H2O(l))#=#1,23#V##E#°(H+/H2(g))#=#0#V#E#°(Cl2(g)/Cl-)#=#1,40#V#E#°(Na+/Na(s))#=#-#2,71#V#E#°(Na+/Na(Hg))#=#-#1,70#V##!"!ln!=0,059!log!(!)########F#=#96485#C#mol81#Surtensions#anodiques#sur#Ti#:#ηa,0(O2(g)/H2O(l))#=#1,40#V#ηa,0(Cl2(g)/Cl-)#=#0,10#V#Surtensions#cathodiques#sur#Hg#:#ηc,0(H+/H2(g))#=#-#1,60#V#ηc,0(Na+/Na(Hg))#=#-#0,05#V##EXERCICE#7#(**+)#:#PILES#SALINES#ET#ALCALINES#On#considère#les#deux#piles#décrites#dans#le#tableau#ci#dessous.#####Pile!saline!#Pile!alcaline!##!!Anode!Réducteur!Récipient#de#zinc#Poudre#de#zinc#Collecteur!Tige#métallique#Cathode!Oxydant!Dioxyde#de#manganèse#MnO2#+#poudre#de#carbone#Dioxyde#de#manganèse#MnO2#+#poudre#de#carbone#Collecteur!Graphite#Récipient#en#acier#Électrolyte!Chlorures#d'ammonium#et#de#zinc#gélifiés##Solution#aqueuse#d'hydroxyde#de#potassium##1/#Expliquer#pourquoi#et#dans#quel#but,#dans#ces#piles,#le#dioxyde#de#manganèse#est#mélangé#à#du#graphite.#Gaine#de#zinc#Électrolyte#MnO2#+##carbone#graphite#Tige#de#carbone#Laiton#+!_!Isolant#Boîtier#en#acier#MnO2#+#carbone#graphite#Électrolyte#Poudre#de#zinc#Conducteur#métallique#Joint#séparateur#Fond#en#acier#+!_!
TDR2/R3-Cinétiqueélectrochimique6RPC-LycéeBaimbridge-Mars2018A.MOMINB-ProcédéàcellulesàmembraneUnschémadeprinciped'unecelluleàmembrane,àcompléter,estreprésentéci-après:Lesanodesentitanesontrecouvertesd'oxydesdetitaneetderuthénium,etlescathodessontennickel.Laséparationentrelescompartimentscathodiquesetanodiquesestconstituéedemembranesperméablesauxseulscations.Cesmembranessontdespolymèresperfluorosulfoniquesouperfluorocarboxyliques.Onobtientlescourbesdensitédecourant-potentielprésentéesàlapagesuivante.B1/Quelleestlaréactionprépondérantequiaeffectivementlieuàchaqueélectroded'unepart,globalementd'autrepart,pourunevaleurdedensitédecourantn'excédantpasleslimitesdutracédescourbes?B2/Aprèsavoirfigurélesensdecirculationdesélectronsàl'extérieurdel'électrolyseuretàl'aidedescourbesdensitédecour ant-potentiel,légenderchacunedescases numérotéesde1à8duschém adeprincipe.vers circuit de concentration saumure diluée vers concentration H2O saumure saturée 12348756
TDR2/R3-Cinétiqueélectrochimique7RPC-LycéeBaimbridge-Mars2018A.MOMINLadensitédecourant���utiliséedansceprocédéestégaleà4kAm/0.OnnégligelespertespareffetJoule.B3/Pourquoipréfère-t-onutiliserladensitédecourantplutôtquel'intensité?Quelleestlavaleurdelatensionappliquéeauxbornesdel'électrolyseurpourceprocédé?Détaillerladémarcheetleraisonnement.B4/Endéduirel'énergienécessairepourproduireunetonnededichlore(���Cl0=70,9gmol/6).C-ProcédéàcellulesàcathodesdemercureLacathodeest,dansceprocédé,constituéed'unlitdemercureliquidesituésurunplaninclinéaufonddelacellule.Lesanodessontdisposéesparallèlementàlasurfacedumercureàunedistancedel'ordrede1cm.Lavitessed'écoulementdumercureestd'environ1ms/6.Lanappedemercureaunesurfacede18m0,qu'onsupposeégaleàcelledel'ensembledesanodesimmergées.Lesodiumformeaveclemercureunalliageliquideappeléamalgamedesodium,notéNa(Hg).C1/Quelsontleseffetsrecherchésparl'utilisationd'unecathodeaumercure?C2/Quelleestlaréactionquiaréellementlieudanslacelluleàélectrolysepourunevaleurdedensitédecourantn'excédantpasleslimitesdutracédescourbes?C3/Sachantquelatensionappliquéeestde3,6V,quelleestladensitéducourantquicirculedanslecircuit?Calculer,danscesconditions,lamassedesodiumproduiteen1hdanslacellule.L'amalgameNa(Hg)quis'é coulepargravité(du faitdupl anincliné)estenvoyédansu ndécomposeu r(cylindreenacier,garniàl'intérieurdemorceauxdegraphite)où,parréactionavecdel'eauadoucie,onrégénèrelemercureetonobtientdelasoudeetdudihydrogène.C4/Ecrirel'équation-bilandecetteréaction.Lemercureestrecyclé;lalessivedesoudeformée(NaOHdeconcentrationégaleà740gL/6)estévacuéeparletrop-plein.
TDR2/R3-Cinétiqueélectrochimique8RPC-LycéeBaimbridge-Mars2018A.MOMIND-Application:l'eaudeJavel(complément)L'eaudeJavelestunesolutionaqueusebasiqueéquimolaired'hypochloritedesodiumNaClOetdechloruredesodium.Elleestpréparéeparréactiondirecteentreledichloreetl'hydroxydedesodiumproduitsparl'électrolyseduchloruredesodium.Ecrirel'équation-bilandelaréactiondeformationdel'eaudeJavel.DonnéesPotentielsstandard���°à25°CetàpH=0:���°(O0(g)/H0O(l))=1,23V���°(H0O(l)/H0(g))=0V���°(Cl0(g)/Cl/)=1,39V���°(ClOH/Cl0(g))=1,59V���°(Na+/Na(s))=-2,71VMassemolairedudichloreetdusodium:���(Cl0)=70,9gmol/6���Na=23,0gmol/6ConstantedeFaraday:ℱ=96485Cmol/6{|ℱln10≈0,059VEXERCICE5(**):L'ACCUMULATEURAUPLOMB(D'APRESCCPPC)Lesbatteriesdevoituresontconstituéesdelamiseenséried'accumulateursauplomb.Lefonctionnementdeces accumulateu rsestbasésurlescouplesredoxPbO0(s)/Pb0#etPb0#/Pb(s).Leurreprésent ationschématiqueestlasuivante:Pb(s)|PbSOk(s)|solutionaqueused'acidesulfurique|PbSOk(s)|PbO0(s)|Pb(s).Unedesélectrodesestconstituéedeplombrecouvertd'unecoucheimperméablededioxydedeplomb,etl'autreestconstituéedeplombpur.L'électrolyteestl'acidesulfuriqueconcentréà5molL/6(p���=0);danscesconditions,lesionsPb2+précipitentsouslaformedesulfatedeplomb(+II)PbSOk(s).1/Comparer,defaçonqualitative,lessolubilitésdusulfatedeplombdansl'eauetdansunesolutionaqueused'acidesulfurique.2/Etudethermodynamiqueendécharge2.a/Donnerl'équationdesdeuxréactionssedéroulantaupôle+etaupôle-del'accumulateurendécharge,entenantcomptedesespècesprépondérantes.Identifierl'anodeetlacathode.2.b/Schématiserlacirculationdetouslesporteursdechargelorsdufonctionnementendéchargedel'accumulateurauplomb.2.c/MontrerquelepotentielredoxstandardducouplePbSOk(s)/Pb(s)vaut-0,36V.2.c/Exprimerlatensionàvide(fém)decegénérateur,enprenantencomptelaprécipitationdesionsPb2+.Commentercettevaleursachantqu'unebatteriedevoituredélivreengénéral12V.3/EtudethermodynamiqueenrechargeQuellessontlesréactionsd'électrolysesedéroulantaupôle+etaupôle-?Identifieranodeetcathode.4/Tensionlimitederechargedel'accumulateurLacourbeintensité-potentielsuivantereprésenteladensitédecourantJoudensitédecourant,mesuréeparunitédesurface(enAm/0)d'uneélectrodedeplomb,enfonctiondupotentielE(enV)imposéàcettemême
TDR2/R3-Cinétiqueélectrochimique9RPC-LycéeBaimbridge-Mars2018A.MOMINélectrode.L'électrodeenplombplongedansunesolutionaqueusedésaérée(sansdioxygènedissous)d'acidesulfuriqueà5molL/6.J (A/m
E(V) +1+2 -0,9+0,4+1,8Onadmetquelessurtensionsd'électrodesrendentlesionssulfateethydrogénosulfatenon-électroactifs.4.a/Quesignifiecettedonnée?4.b/Ecrireleséquationsdesréactionsélectrochimiquescorrespondantàlapartie(ab)d'unepart,etau-delàdupointfd'autrepart.Commenterl'alluredecesportionsdecourbe.Quepeut-ondiredescouplesredoximpliquéssurélectrodedeplomb?4.c/Ecrirel'équationde réactionélectrochimiquecor respondant àlapartie(cd)de lacourbe intensité-potentiel.4.d/Aquelleconditionsurla surtensionducoupl ePbSOk(s)/Pb(s)lefonctionn ementdel'accumulateurest-ilpossibleenrecharge?LadensitédecourantJchutebrutalementaupointd(oùlepotentiels'appelle"potentieldeFlade»),etdevientquasi-nullesurlapartiedecourbe(ef).Cephénomènes'appellepassivationdel'électrode.4.e/Sachantqueledioxydedeplombestuntrèsmauvaisconducteurélectronique,expliquerlephénomèneàl'originedececomportement.4.f/LepotentieldeFladeest-ilunegrandeurthermodynamiqueoucinétique?4.g/Endéduiredeuxraisonspourlesquellesilestnécessairedenepasdépasserunetensionlimiteetuncourantlimite(d'environ4Apourunebatteriedevoiture)lorsdelachargedel'accumulateur,sicelui-ciestscellé.Donnéesà298K:���°(O0(g)/H0O(l))=1,23V���°(H#/H0O(l))=0V���°(PbO0(s)/Pb0#)=1,69V���°(Pb0#/Pb(s))=-0,13V���(PbSOk)=2,53×10/{|ℱln10≈0,06V
quotesdbs_dbs2.pdfusesText_4[PDF] cours electrochimie s5 pdf
[PDF] electrocinetique exercices corrigés gratuit
[PDF] electrostatique et electrocinétique rappel de cours et exercices corrigés de physique
[PDF] electrocinétique mpsi cours
[PDF] resumé d'un cours d'électrocinétique
[PDF] electrocinetique mpsi pdf
[PDF] electrocinetique exercices corrigés pdf s2
[PDF] électrode de travail électrochimie
[PDF] électrode de référence ag/agcl
[PDF] potentiel d'électrode définition
[PDF] pont salin
[PDF] potentiel électrode de référence ag/agcl
[PDF] electrode 1ere espece
[PDF] électrode au chlorure d'argent
