 Exercices sur lélectrolyse
Exercices sur lélectrolyse
corrigé à l'anode oxydation des ions chlorures. 2 Cl- donne Cl. 2. + 2e- à la cathode réduction de l'eau. 2 H. 2. O + 2e- donne H. 2. + 2HO-. Danger !!! dans le
 Série électrolyse
Série électrolyse
Série électrolyse. Exercice 1 : Électrolyse de l'eau. Dans un électrolyseur on introduit 200 mL d'eau et 50 mL d'acide sulfurique ; on coiffe chaque électrode.
 electrolyse-et-synthese-de-leau-1.pdf
electrolyse-et-synthese-de-leau-1.pdf
EXERCICE 3: On réalise l'électrolyse de l'eau. 1) On recueille à la cathode 80 cm3 de gaz. Quel est son nom ? Comment peut-on l'identifier ?
 transformations-forcees-electrolyse-exercices-non-corriges-1.pdf
transformations-forcees-electrolyse-exercices-non-corriges-1.pdf
L'objectif de cette partie de l'exercice est d'étudier l'argenture d'une plaque de cuivre par électrolyse. Données : Recopier sur la feuille de rédaction
 Corrigé : Travaux Dirigés de la série 4 Exercice n°1 1-lélectrolyse d
Corrigé : Travaux Dirigés de la série 4 Exercice n°1 1-lélectrolyse d
Corrigé : Travaux Dirigés de la série 4. Exercice n°1. 1-l'électrolyse d'une solution de sulfate de cuivre CuSO4 : a- les Réactions de réduction possibles
 EXERCICE IV
EXERCICE IV
I-6- Donner le bilan de l'électrolyse et préciser la constante d'équilibre K′. mol-1 . 1 Faraday = 96500 C
 Conversion dénergie : piles et électrolyses
Conversion dénergie : piles et électrolyses
27 mar. 2022 Vous pouvez lire la page Wikipedia « pile à combustible » à ce sujet. 1/11 ... Exercice 6 : Électrolyse de l'alumine oral CCINP PSI
 PSI* 2020 – 2021 TD CHIMIE N°3 ELECTROLYSE Exercice 1
PSI* 2020 – 2021 TD CHIMIE N°3 ELECTROLYSE Exercice 1
ELECTROLYSE. Exercice 1 : Electrolyse du sulfate de cobalt (e3a PSI 2012 - extrait). Données nécessaires à la résolution de ce problème : - Potentiels
 DS no8 Piles accumulateurs & électrolyse Exercice 1 – La pile sous
DS no8 Piles accumulateurs & électrolyse Exercice 1 – La pile sous
%20accu%20%26%20e%CC%81lectrolyse-Complet.pdf
 Exercices Cinétique électrochimique – Courbes intensité-potentiel
Exercices Cinétique électrochimique – Courbes intensité-potentiel
Correction en vidéo. Page 4. Usage personnel uniquement. 4. Exercice n° 2 : Électrolyse d'une solution d'ions cuivrique. On souhaite réaliser l'électrolyse d'
 EXERCICE IV
EXERCICE IV
I-7- Calculer les quantités des produits de l'électrolyse au bout d'une heure. I-8- Quelle a été l'intensité moyenne du courant pendant l'heure qu'a duré l'
 Corrigé : Travaux Dirigés de la série 4 Exercice n°1 1-lélectrolyse d
Corrigé : Travaux Dirigés de la série 4 Exercice n°1 1-lélectrolyse d
Corrigé : Travaux Dirigés de la série 4. Exercice n°1. 1-l'électrolyse d'une solution de sulfate de cuivre CuSO4 : a- les Réactions de réduction possibles
 Série électrolyse
Série électrolyse
Exercice 1 : Électrolyse de l'eau. Dans un électrolyseur on introduit 200 mL d'eau et 50 mL d'acide sulfurique ; on coiffe chaque électrode.
 Thème : Piles et électrolyses Fiche 4 : Piles et électrolyses
Thème : Piles et électrolyses Fiche 4 : Piles et électrolyses
Exercice n°4. On réalise simultanément l'électrolyse d'une solution de bromure de cuivre (II) (Cu2+. (aq) + 2 Br-. (aq)) dans un premier tube en U et.
 Liaisons chimiques (6 points) Deuxième exercice : Réalisation de la
Liaisons chimiques (6 points) Deuxième exercice : Réalisation de la
Troisième exercice : Électrolyse de l'eau (6 points). Le schéma ci-dessous représente Corrigé. Barème. Premier exercice : Liaisons chimiques (6 points).
 electrolyse-et-synthese-de-leau-1.pdf
electrolyse-et-synthese-de-leau-1.pdf
Exercice d'application. Au cours d'une électrolyse de l'eau on a recueilli 120 ml d'un gaz à la cathode. 1-de quel gaz s'agit-il ?
 Conversion dénergie : piles et électrolyses
Conversion dénergie : piles et électrolyses
Correction TD 26 : Conversion d'énergie : piles et électrolyses. Blaise Pascal PT 2020-2021. Exercice 2 : Pile argent-zinc.
 ( ) Na Cl +
( ) Na Cl +
L'objectif de cette partie de l'exercice est d'étudier l'argenture d'une plaque de cuivre par électrolyse. Données : Recopier sur la feuille de rédaction
 DS no8 Piles accumulateurs & électrolyse Exercice 1 – La pile sous
DS no8 Piles accumulateurs & électrolyse Exercice 1 – La pile sous
%20accu%20%26%20e%CC%81lectrolyse-Complet.pdf
 Exercices Séquence n°10 Des synthèses forcées
Exercices Séquence n°10 Des synthèses forcées
EXERCICE 1 : Transformation spontanée ou forcée ? On réalise l'électrolyse d'une solution de bromure de cuivre (Cu2+. (aq) + 2 Br–.
 Electrolyse : Cours et Exercices corrigés-PDF - F2School
Electrolyse : Cours et Exercices corrigés-PDF - F2School
Electrolyse : Cours et Exercices corrigés PDF L'électrolyse (une transformation forcée) est un phénomène chimique lié au passage du courant électrique
 [PDF] Exercices sur lélectrolyse - F2School
[PDF] Exercices sur lélectrolyse - F2School
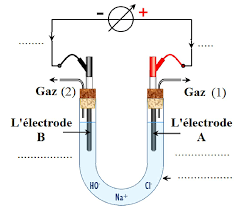
exercice 1: électrolyse d'une saumure préparation Cl 2 Une saumure est une solution concentrée de chlorure de sodium Les électrodes sont inattaquables A
 [PDF] Série électrolyse - AlloSchool
[PDF] Série électrolyse - AlloSchool
Exercice 1 : Électrolyse de l'eau Dans un électrolyseur on introduit 200 mL d'eau et 50 mL d'acide sulfurique ; on coiffe chaque électrode
 [PDF] transformations-forcees-electrolyse-exercices-non-corriges-1pdf
[PDF] transformations-forcees-electrolyse-exercices-non-corriges-1pdf
L'objectif de cette partie de l'exercice est d'étudier l'argenture d'une plaque de cuivre par électrolyse Données : Recopier sur la feuille de rédaction le
 [PDF] Corrigé : Travaux Dirigés de la série 4 Exercice n°1 1-lélectrolyse d
[PDF] Corrigé : Travaux Dirigés de la série 4 Exercice n°1 1-lélectrolyse d
1 Corrigé : Travaux Dirigés de la série 4 Exercice n°1 1-l'électrolyse d'une solution de sulfate de cuivre CuSO4 : a- les Réactions de réduction
 [PDF] PSI* 2020 – 2021 TD CHIMIE N°3 ELECTROLYSE Exercice 1
[PDF] PSI* 2020 – 2021 TD CHIMIE N°3 ELECTROLYSE Exercice 1
Exercice 1 : Electrolyse du sulfate de cobalt (e3a PSI 2012 - extrait) Données nécessaires à la résolution de ce problème : - Potentiels standard à 298 K :
 Electrolyse exercices de chimie de terminale S correction ts09chc
Electrolyse exercices de chimie de terminale S correction ts09chc
1)- Exercice 11 page 224 Le bilan de l'électrolyse d'une solution aqueuse de chlorure d'étain II
 [PDF] electrolyse-et-synthese-de-leau-1pdf - WordPresscom
[PDF] electrolyse-et-synthese-de-leau-1pdf - WordPresscom
Exercice d'application Au cours d'une électrolyse de l'eau on a recueilli 120 ml d'un gaz à la cathode 1-de quel gaz s'agit-il ?
 [PDF] EXERCICE IV - Toupty
[PDF] EXERCICE IV - Toupty
I-6- Donner le bilan de l'électrolyse et préciser la constante d'équilibre K? REPONSES A L'EXERCICE I I-1- Equation-bilan : Zn + Br2 ? Zn2+ + 2 Br-
Série électrolyse Exercice 1 : -dessous. I = 0,4 A et on laisse 1. solution et écrire les équations de réaction qui peuvent se produire aux électrodes. 2. Indiquer le déplacement des porteurs de charge, noter les produits 3. Calculer les volumes de dioxygène et de dihydrogène obtenus dans les tubes à essais. Données : volume molaire à 25 °C : Vm = 24 L.mol1 ; NA = 6,02.1023 mol1 ; e = 1,6.1019 C. Couples ox/red : SO42(aq)/SO2(aq) ; S2O82(aq)/SO42(aq) ; O2(g)/H2O ; H+(aq)/H2(g). Exercice 2 : Elaboration du zinc par électrolyse (La Réunion, Juin 2003) Données et approximations pour les calculs : Masse molaire du zinc 65,4 g·mol-1 6D -1 Masse volumique du zinc 7,14 g·cm-3 7 Ń-3 Constante de Faraday 9,65·104 C·mol-1 105 C·mol-1 6D 8 36 48 E105 et 8 × 48 × 36 = 14·103 une solution de sulfate de zinc e sulfurique. Les ions sulfate ne participent pas aux réactions électrochimiques. On observe A. Etude de la transformation 1) Quelles sont les réactions susceptibles de se produire sur chaque électroqui est oxydé en dioxygène ? On donne les couples oxydant réducteur : Zn2+(aq)/Zn(s), H+(aq)/H2(g) et O2(g)/H2O(l). polarité et le sens de déplacement des espèces chargées. Zn2+(aq) + H2O(l) = Zn(s) + O2(g) + 2 H+(aq). -u forcée ? Pourquoi ? Quelle vérification théorique proposeriez-vous ? B. Exploitations 3,5 V80 kA. Après 48 h de fonctionnement, le x Q transportée dans cet électrolyseur ? 2) Pr : H. Attoch
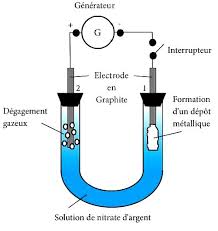
3) En fait, on obtient une quantité de zinc inférieure à celle attendue. Pourquoi ? le produit est de 80 % et le volume molaire est de 24 L·mol-1x et le volume v de dioxygène v ? Exercice 3 : Mise en forme des alliages moulés Un minerai de cuivre contient de l'argent. Après différents traitements, il reste du cuivre brut contenant de l'argent dont on veut connaître la proportion. Pour cela, on procède à une électrolyse à anode soluble du cuivre brut, avec cathode en graphite. 1. Compléter le schéma figurant sur l'annexe, qui sera rendue avec la copie, en précisant le sens de déplacement des électrons, le nom des électrodes et l'emplacement du bloc de cuivre brut. Au début de l'expérience, les masses des deux électrodes sont identiques et valent m0 = 5,000 g. On sait que seul le cuivre subit l'électrolyse ; l'argent se dépose au fond de la cuve. 2. Ecrire les demi-équations rédox se produisant aux électrodes en précisant laquelle traduit une oxydation et laquelle traduit une réduction. Indiquer le nom de l'électrode siège de l'oxydation de l'élément cuivre. 3. L'électrode de cuivre brut est totalement dissoute en 3036 secondes. Sachant que l'intensité du courant est I = 5,000 A, calculer la masse de cuivre pur formé. 4. En déduire la teneur en argent du cuivre brut. Données - Masse molaire: M(Cu) = 63,50 g·mol1. - Nombre d'Avogadro : N = 6,022×1023 mol1. - Valeur absolue de la charge de l'électron : e = 1,602×1019 C. Exercice 4: D'après concours Manipulateur d'électroradiologie médicale de Caen 2006 On réalise l'électrolyse d'une solution de nitrate d'argent (Ag+ (aq); NO3- (aq)) selon le montage ci-dessous. Les deux électrodes inattaquables en graphite sont reliées à un générateur de tension continue permettant de faire circuler un courant d'intensité I. Lorsque l'interrupteur est fermé, on observe un dégagement gazeux sur l'électrode 2 et la formation d'un dépôt métallique sur l'électrode 1. L'électrolyse dure 15 minutes, l'intensité du courant est maintenue constante et égale à 0,5 A. 1. Sur le schéma, représenter le sens de circulation des porteurs de charges et préciser leurs noms (dans la solution et dans les fils de connexion). 2. Quelle est la nature du dépôt observé sur l'électrode 1 ? En déduire la demi-équation se produisant à cette électrode. Cette électrode est-elle l'anode ou la cathode ? Justifier. 3. Écrire la demi-équation se produisant à l'électrode 2. 4. En déduire le bilan de cette électrolyse. 5. Calculer la quantité de matière d'électrons échangés lors de cette électrolyse. 6. Quelle est la masse de dépôt métallique déposée sur l'électrode 1? 7. Quel est le volume de gaz recueilli à l'électrode 2? Données : Couples Ox/Red : O2(g)/H2O(l); H+ (aq)/H2(g) et Ag+ (aq)/Ag(s). Vm = 24 L.mol-1; M(Ag) = 107,9 g . mol-1; e = 1,6 · 10-19 C; 1F = 9,65 · 104 C.mol-1 Pr : H. Attoch
quotesdbs_dbs12.pdfusesText_18[PDF] tp electrolyse de l'eau correction
[PDF] electrolyse et synthèse de l'eau exercices
[PDF] production de dihydrogène spé physique correction
[PDF] tp électrolyse
[PDF] ece electrolyse
[PDF] tp electrolyse de l'eau sulfate de sodium
[PDF] production de dihydrogène par électrolyse correction
[PDF] tp spé physique électrolyse de l'eau correction
[PDF] electrolyse soude caustique
[PDF] electrolyse du chlorure de sodium fondu
[PDF] electrolyse nacl piscine
[PDF] electrolyse du chlorure de sodium corrigé
[PDF] cours sur l'électrolyse
[PDF] cellule galvanique et électrolytique
