 electrolyse-et-synthese-de-leau-1.pdf
electrolyse-et-synthese-de-leau-1.pdf
EXERCICE 3: On réalise l'électrolyse de l'eau. 1) On recueille à la cathode 80 cm3 de gaz. Quel est son nom ? Comment peut-on l'identifier ?
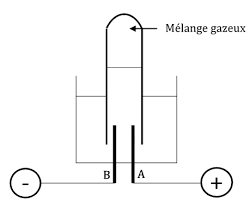 theme : les reactions chimiques titre de la leçon :electrolyse et
theme : les reactions chimiques titre de la leçon :electrolyse et
Le volume du dioxygène est la moitié de celui du dihydrogène. EXERCICE 3. Indiqueparmi les équations suivantes celle qui correspondà la synthèse de l'eau. 1.
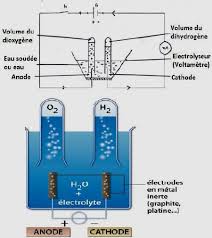 Électrolyse et synthèse de leau
Électrolyse et synthèse de leau
Exercice résolu. Lors d'une expérience sur l'électrolyse de l'eau on a recueilli 480cm3 de dihydrogène. 1- Sur quelle électrode recueillit-on le gaz
![[PDF] ANNALES SCIENCES PHYSIQUES 3ème [PDF] ANNALES SCIENCES PHYSIQUES 3ème](https://pdfprof.com/PDFV2/GoBo/Images68/17_68018_5_.png) [PDF] ANNALES SCIENCES PHYSIQUES 3ème
[PDF] ANNALES SCIENCES PHYSIQUES 3ème
Chapitre 6 : L'électrolyse et la synthèse de l'eau. Chapitre 7 : Les alcanes eau + soude. I. I. Page 34. 33. II/ EXERCICE (02 points). 1) Equilibrer l' ...
 STRUCTURE DE LA MOLECULE DEAU 1- Électrolyse de leau 1.1
STRUCTURE DE LA MOLECULE DEAU 1- Électrolyse de leau 1.1
les proportions du mélange détonnant sont : deux(2) volumes du dihydrogène pour un (1) volume du dioxygène. La synthèse est un phénomène inverse de l'
 CHIMIE 3e 1. LEAU FICHE PÉDAGOGIQUE
CHIMIE 3e 1. LEAU FICHE PÉDAGOGIQUE
Expérience. Réaliser l'électrolyse de l'eau. ¼ h. IV Synthèse de l'eau. 2 H2 + O2 → 2 H2O.
 Fascicule SCIENCES PHYSIQUES
Fascicule SCIENCES PHYSIQUES
Le schéma ci-dessous est une partie du dispositif expérimental de l'électrolyse de l'eau. Exercice 7 Synthèse d'un ester. Un chimiste synthétise un ester à ...
 Untitled
Untitled
LEÇON 1 : Electrolyse et synthèse de l'eau (2 séances). EXEMPLE DE SITUATION • Faire des exercices d'application sur les conversions d'unités d'énergie.
 Electrlyse et synthèe de leau - exercice
Electrlyse et synthèe de leau - exercice
Lors d'une expérience sur l'électrolyse de l'eau on a recueilli 480cm3 de dihydrogène. 1- Sur quelle électrode recueillit-on le gaz dihydrogène?
 SYNTHESE DES PRINCIPES COMPTABLES ET METHODES D
SYNTHESE DES PRINCIPES COMPTABLES ET METHODES D
31 déc. 2017 -. Et les produits issus de l'électrolyse : soude
 electrolyse-et-synthese-de-leau-1.pdf
electrolyse-et-synthese-de-leau-1.pdf
EXERCICE 3: On réalise l'électrolyse de l'eau. 1) On recueille à la cathode 80 cm3 de gaz. Quel est son nom ? Comment peut-on l'identifier ?
 Électrolyse et synthèse de leau
Électrolyse et synthèse de leau
L'électrolyse contient uniquement de l'eau. le circuit étant fermé on n'observe rien ; l'eau est faiblement conductrice du courant électrique.
 EPREUVE DE PHYSIQUE CHIMIE
EPREUVE DE PHYSIQUE CHIMIE
EXERCICE 1 (8 Points). A- on réalise l'expérience de l'électrolyse de l'eau dihydrogène/de synthèse de l'eau/est explosive/un volume de dioxygène.
 ANNALES SCIENCES PHYSIQUES 3ème
ANNALES SCIENCES PHYSIQUES 3ème
Chapitre 6 : L'électrolyse et la synthèse de l'eau Conseils pour la résolution d'un exercice ... Recenser les données connues dans l'exercice ;.
 ELECTROLYSE ET SYNTHESE DE LEAU
ELECTROLYSE ET SYNTHESE DE LEAU
EXERCICE 1. 1) Qu'est-ce que l'électrolyse de l'eau? 2) Définir la synthèse de l'eau. 3) Faire le schéma annoté de l'expérience montrant l'électrolyse de
 Untitled
Untitled
EXERCICE 1 8 points. PHYSIQUE-CHIMIE a) une électrolyse de l'eau ; b) une synthèse de l'eau ; une décomposition de l'eau.
 Thème 1 : Leau Chapitre 3 : Eau et énergie Séance n° 10
Thème 1 : Leau Chapitre 3 : Eau et énergie Séance n° 10
L'électrolyse de l'eau est l'une des voies de synthèse du dihydrogène. Elle est envisagée pour utiliser les surplus de production d'électricité. Les
 Exercices Séquence n°10 Des synthèses forcées
Exercices Séquence n°10 Des synthèses forcées
En déduire l'équation d'oxydo-réduction de la réaction d'électrolyse. EXERCICE 5 : Synthèse du dichlore par électrolyse. Industriellement l'eau de Javel est
 RECUEIL DEXERCICES 2S
RECUEIL DEXERCICES 2S
2) L'électrolyse de l'eau est un phénomène chimique. 3) La synthèse de l'eau est un phénomène physique. 4) L'eau de Kirène est un corps pur.
 [PDF] electrolyse-et-synthese-de-leau-1pdf - WordPresscom
[PDF] electrolyse-et-synthese-de-leau-1pdf - WordPresscom
EXERCICES PROPOSES SUR ELECTROLYSE ET SYNTHESE DE L'EAU EXERCICE N°1 1) Définis :-Électrolyse de l'eau e t Synthèse de l'eau 2) Un groupe d'élèves de la
 CHIMIE Troisième : Lélectrolyse et la synthèse de leau - Exercice
CHIMIE Troisième : Lélectrolyse et la synthèse de leau - Exercice
CHIMIE Troisième : L'électrolyse et la synthèse de l'eau Exercice 2 Une éprouvette contient 120 cm 3 de dihydrogène et 50 cm 3 de dioxygène : on
 [PDF] Électrolyse et synthèse de leau - ACCESMAD
[PDF] Électrolyse et synthèse de leau - ACCESMAD
L'électrolyse de l'eau permet d'obtenir du dihydrogène à la cathode du dioxygène à l'anode le volume du dihydrogène est le double du volume du dioxygène VH2=
 Exemple des exercices: Electrolyse et synthèse de leau
Exemple des exercices: Electrolyse et synthèse de leau
12 fév 2016 · Electrolyse et synthèse de l'eau Exercice 1 1) Qu'est-ce que l'électrolyse de l'eau ? 2) Définir la synthèse de l'eau
 3ÈME/CHIMIE : EXERCICES PROPOSÉS SUR LELECTROLYSE
3ÈME/CHIMIE : EXERCICES PROPOSÉS SUR LELECTROLYSE
9 mai 2020 · EXERCICE N°1 1) Définis :-Électrolyse de l'eau e t Synthèse de l'eau 2) Un groupe d'élèves de la classe de 3ème décide de réaliser
 Exo de Synthèseetelectrolyse de Leau PDF Substances chimiques
Exo de Synthèseetelectrolyse de Leau PDF Substances chimiques
Electrolyse et synthèse de l'eau produits obtenus Exercice 1 6) On a obtenu 96 cm3 de produit obtenu à la cathode : 1) Qu'est-ce que l'électrolyse de l'eau
 Bepc Electrolyse Eau PDF Industrie chimique - Scribd
Bepc Electrolyse Eau PDF Industrie chimique - Scribd
Exercices Exercice : BEPC Session : Chapitre : Electrolyse et Synthèse de l'eau Durée : Coefficient : Exercice 1 : Complétez les phrases :
 Electrolyse : Cours et Exercices corrigés-PDF - F2School
Electrolyse : Cours et Exercices corrigés-PDF - F2School
Electrolyse : Cours et Exercices corrigés PDF L'électrolyse (une transformation forcée) est un phénomène chimique lié au passage du courant électrique
 [PDF] EPREUVE DE PHYSIQUE CHIMIE - PMFA
[PDF] EPREUVE DE PHYSIQUE CHIMIE - PMFA
EXERCICE 1 (8 Points) A- on réalise l'expérience de l'électrolyse de l'eau Recopie le numéro de l'affirmation et réponds par Vrai ou Faux
 [PDF] transformations-forcees-electrolyse-exercices-non-corriges-1pdf
[PDF] transformations-forcees-electrolyse-exercices-non-corriges-1pdf
L'objectif de cette partie de l'exercice est d'étudier l'argenture d'une plaque de cuivre par électrolyse Données : Recopier sur la feuille de rédaction le
Objectif
L'électrolyse de l'eau est l'une des voies de synthèse du dihydrogène. Elle est envisagée pour
utiliser les surplus de production d'électricité. Les électrolyseurs transforment l'énergie électrique
en énergie chimique. L'objectif est d'étudier leur fonctionnement et de déterminer le rendement de
la transformation d'énergie.Documents à disposition
Document 1 : Récepteurs et générateurs électriques pages 1 et 2 Document 2 : Électrolyse, quelques définitions Document 3 : Définition d'un indicateur coloréUn indicateur coloré est une espèce chimique dont la couleur varie en fonction du pH de la solution dans laquelle il se
trouve.Les indicateurs colorés sont surtout utilisés pour réaliser des dosages acido-basiques ou pour indiquer un domaine de pH
d'une solution. Le couple acide/base présent dans cet indicateur coloré est noté HIn/In-.Document 4 : Vidéo, électrolyse de l'eau
Document 5 : Couleurs prises par le BBT en fonction du pH du milieu qui le contientDocument 6 : Solution acide et solution basique
Une solution aqueuse est acide si elle contient plus d'ions oxonium H3O+ que d'ions hydroxyde HO- Une solution aqueuse est basique si elle contient plus d'ions hydroxyde HO- que d'ions oxonium H3O+I. Caractéristique d'un électrolyseur
L'objectif est de déterminer si l'électrolyseur se comporte comme un générateur ou un récepteur électrique et d'exprimer la
loi d'ohm U =f(I) à ses bornes.1.Montage teinte acide : jaune
teinte sensible : verte teinte basique : bleueConsignes :
- Réaliser le montage ci-dessus, sans allumer le générateur ni les multimètres, et appeler le professeur pour vérification ; - Placer 200 mL de solution de sulfate de sodium à 0,50 mol.L-1 dans la cuve de l'électrolyseur ; - Ne pas placer les tubes à essais lors de l'étude de l'électrolyseur.2.Etude de l'électrolyseur
- Régler le générateur de tension sur U = 0,0 V. Augmenter alors doucement la tension U en la contrôlant sur le voltmètre
et observer les électrodes dans l'électrolyseur. a) À partir de quelle tension U' observe-t-on la mise en fonctionnement de l'électrolyseur ? Quelle est intensité I' en mA correspondante ? Noter vos observations.b) Compléter le tableau suivant en faisant varier la tension U aux bornes du générateur et en relevant l'intensité I du
courant électrique traversant l'électrolyseur :U (V)0,03,04,05,06,07,08,09,010,011,012,0
I (mA)
- Lorsque les mesures sont réalisées, laisser la tension aux bornes du générateur à la valeur
U = 12,0 V et éteindre le générateur. Dans toute la suite du TP, cette valeur de tension ne sera plus modifiée.
c) Dans LibreOffice, tracer la caractéristique U = f(I).d) Définir les termes récepteur, générateur, passif et actif à l'aide du document 1. D'après la caractéristique,
l'électrolyseur est-il un générateur ou un récepteur électrique ? Est-il actif ou passif ?
e) Modéliser la partie linéaire de la caractéristique et afficher l'équation du modèle. Noter cette équation. En déduire la
valeur de la force contre électromotrice (f.c.e.m) E' de l'électrolyseur ainsi que celle de sa résistance interne r'.
II. Fonctionnement de l'électrolyseur
1.Étude qualitative
• Ajouter quelques gouttes de bleu de bromothymol (BBT) dans les deux tubes, notés tube 1 et tube 2, et en utilisant le
bécher, les remplir avec la solution de sulfate de sodium.• Les fermer avec un morceau de papier filtre, les retourner dans la cuve de l'électrolyseur et les
fixer au-dessus des électrodes avec les pinces à disposition.• Allumer le générateur (U = 12,0 V réglée précédemment) en déclenchant un chronomètre et laisser débiter le générateur
pendant exactement Δt = 5,0 min. a) Noter la valeur de l'intensité I0 du courant électrique. b) Noter les teintes des solutions dans les tubes 1 et 2. Que traduit le changement de couleur de la solution contenue dans le tube 1 et 2 ?Quels ions sont formés dans chacun des tubes ?
On s'aidera des documents 5 et 6 ci-dessus.
c) Au bout de Δt = 5,0 min, arrêter le générateur et relever les volumes V1et V2 des gaz formés respectivement dans les
tubes 1 et 2. Dans quelle proportion sont les valeurs de ces volumes ?• Rallumer le générateur et l'arrêter lorsque le tube 1 est complètement rempli de gaz.
d) Quel est le sens conventionnel du courant électrique I dans un circuit ? Le représenter sur le schéma.
e) En déduire le sens de déplacement des électrons dans le circuit extérieur à l'électrolyseur. Le représenter sur le
schéma.f) Sur quelle électrode, (1) ou (2) se produit l'oxydation ? La réduction ? Justifier en utilisant le sens de déplacement des
électrons. Identifier alors l'anode et la cathode de l'électrolyseur. Lorsque le tube 1 est rempli de gaz, allumer une allumette puis soulever le tube 1. Le retourner rapidement devant la flamme de l'allumette.Lorsque le tube 2 est rempli, soulever le tube 2, puis le retourner devant une buchette incandescente.
g) Noter les observations pour chacune des expériences. En déduire la nature du gaz dans chacun des tubes.
Les couples redox de l'eau sont : H2O(l) / H2(g) et O2(g) / H2O(l)h) Déduire des questions a) à g) la demi-équation électronique qui se produit à l'anode et à la cathode.
i) En déduire l'équation de la réaction qui décrit le fonctionnement global de l'électrolyseur sachant que la réaction
suivante est totale : H+(aq) + HO-(aq) r H2O(l) j) Les volumes respectifs (V1et V2) des deux gaz obtenus sont proportionnels aux quantités desgaz formés. Les volumes mesurés sont-ils cohérents avec l'équation de cette réaction ?
k) Pourquoi a-t-on utilisé une solution aqueuse de sulfate de sodium et non de l'eau pure pour réaliser l'électrolyse de
l'eau ?l) Quels sont les porteurs de charge responsables du passage du courant électrique dans la solution ? Dans quel sens se
déplacent-ils ?2.Étude quantitative : détermination du rendement de l'électrolyseur
a) Compléter le document ci-dessous, qui représente le diagramme énergétique de l'électrolyseur :
b) Exprimer les grandeurs suivantes en fonction de E', U, I0, r' et Δt, puis les calculer : • l'énergie électrique Wereçue (1) par l'électrolyseur • l'énergie QJoule perdue (2)Montrer que l'énergie utile (3) produite Wu a pour expression: Wu= E'×I0×Δt puis la calculer.
c) Définir le rendement énergétique noté (êta) et le calculer.ELECTROLYSE DE L'EAU
Liste du matériel
iElectrolyseur (fils de platine) i1 voltmètre -1 ampéremètre -5 fils de connexion
igénérateur de tension variable elc ichronomètre ipotence + 2 pincesi2 tubes gradués verre i1 éprouvette graduée 100 mL ibuchette - allumettes iBBT iSolution sulfate de sodiumC = 0,50 mol/L ; 300 mL/gpe
quotesdbs_dbs35.pdfusesText_40[PDF] tp électrolyse
[PDF] ece electrolyse
[PDF] tp electrolyse de l'eau sulfate de sodium
[PDF] production de dihydrogène par électrolyse correction
[PDF] tp spé physique électrolyse de l'eau correction
[PDF] electrolyse soude caustique
[PDF] electrolyse du chlorure de sodium fondu
[PDF] electrolyse nacl piscine
[PDF] electrolyse du chlorure de sodium corrigé
[PDF] cours sur l'électrolyse
[PDF] cellule galvanique et électrolytique
[PDF] comparaison pile et electrolyse
[PDF] cellule électrochimique ? trois électrodes
[PDF] rendement faradique électrolyse
