 CONTROLE n°1 : CHIMIE
CONTROLE n°1 : CHIMIE
Exercice n° 1 : (3 points). Indique VRAI ou FAUX pour chaque affirmation: 1- Le diamètre d'un atome est égal à celui de son noyau. ……………… 2- L'électron d'un
 Troisième - Les ions au quotidien - Exercices - Devoirs
Troisième - Les ions au quotidien - Exercices - Devoirs
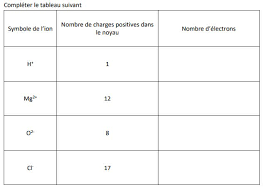
2°- On considère l'ion magnésium Mg2+ . a. Combien possède-t-il de charges Troisième générale - Physique Chimie - Année scolaire 2022/2023 https ...
 Fiche de révision de 3eme en physique chimie - DNB
Fiche de révision de 3eme en physique chimie - DNB
a) Atomes molécules et ions. Un atome est constitué d'un noyau autour duquel La molécule contient 2 atomes de carbone
 Physique chimie
Physique chimie
En s'ionisant l'atome de magnésium Mg perd deux électrons. Donner la formule de l'ion magnésium. Page 14. Exercice n°3
 Troisième - Constitution des atomes - Exercices - Devoirs
Troisième - Constitution des atomes - Exercices - Devoirs
De son noyau ? 4. Quel est le numéro atomique de cet atome ? Quel est son symbole chimique ? Exercice 2 corrigé disponible.
 Fiche de révision de 3eme en physique chimie - DNB
Fiche de révision de 3eme en physique chimie - DNB
a) Atomes molécules et ions. Un atome est constitué d'un noyau autour duquel La molécule contient 2 atomes de carbone
 Fiche dexercices sur les acides bases et pH (fiche n°11)
Fiche dexercices sur les acides bases et pH (fiche n°11)
3) Indique si le soda est acide basique ou neutre en justifiant. 4) Indique quels sont les ions du pH majoritaires dans ce soda. Exercice 2. Range les éléments
 DNB Epreuve de Physique-Chimie (30 min)
DNB Epreuve de Physique-Chimie (30 min)
atome électron
 Chapitre 5 : Atomes et ions I –Latome 1. Histoire de latome Activité
Chapitre 5 : Atomes et ions I –Latome 1. Histoire de latome Activité
II – Les ions. Question : toutes les eaux minérales ont-elles le même goût La solution de chlorure de sodium est une solution d'eau salée. Exercices. Page ...
 Chimie Générale (Chimie 1)
Chimie Générale (Chimie 1)
23 déc. 2020 radioactives sont des ions hélium (He2+) (atomes d'hélium ayant perdu 2 électrons). Lors de son expérience il bombarde une feuille d'or de ...
 Fiche de révision de 3eme en physique chimie - DNB
Fiche de révision de 3eme en physique chimie - DNB
Un ion est un atome ou groupe d'atomes qui a perdu ou gagné un ou plusieurs électrons. Il y a donc des : • Ions positifs appélés CATIONS : Atome ou groupe d'
 CONTROLE n°1 : CHIMIE
CONTROLE n°1 : CHIMIE
Exercice n° 1 : (3 points). Indique VRAI ou FAUX pour chaque affirmation: 1- Le diamètre d'un atome est égal à celui de son noyau. ……………… 2- L'électron d'un
 Fiche de révision de 3eme en physique chimie - DNB
Fiche de révision de 3eme en physique chimie - DNB
Un ion est un atome ou groupe d'atomes qui a perdu ou gagné un ou plusieurs électrons. Il y a donc des : • Ions positifs appelés CATIONS : Atome ou groupe d'
 Fiche dexercices sur les acides bases et pH (fiche n°11)
Fiche dexercices sur les acides bases et pH (fiche n°11)
3) Indique si le soda est acide basique ou neutre en justifiant. 4) Indique quels sont les ions du pH majoritaires dans ce soda. Exercice 2. Range les éléments
 longueur datait =
longueur datait =
18/04/21. Troisième: Ions. Atomes -. Univers . Protectorat Saint-Joseph – Aulnay Sous-Bois – Physique-Chimie – Troisième – Cours ... Exercice n°2.
 Chapitre 5 Réactions avec les solutions acides Exercices Correction
Chapitre 5 Réactions avec les solutions acides Exercices Correction
17 mars 2020 Exercices. Correction. Exercice 2 : Fer et acide chlorhydrique ... L'équation se lit : un atome de zinc (Zn) réagit avec deux ions hydrogène ...
 Exercices de révisions : Physique-chimie
Exercices de révisions : Physique-chimie
Initialement le système chimique contient 30 mol de diiode et 5
 Chapitre 7. Latome Exercices supplémentaires
Chapitre 7. Latome Exercices supplémentaires
2. Proposer plusieurs compositions possibles de l'ion hydrogène H+ . Page 3. Physique Chimie
 EXERCICES RATTRAPAGE SECONDE EXERCICES
EXERCICES RATTRAPAGE SECONDE EXERCICES
Prévoir la formule chimique de l'ion monoatomique issu de cet atome. 2. De quel atome cet ion est-il isoélectronique ? Ex 9 – Stabilité du néon et ions
 Chapitre 2 : Les ions dans notre quotidien
Chapitre 2 : Les ions dans notre quotidien
21 déc. 2020 d'un seul atome. II. Comment détecter des ions ? ... Saint-Joseph – Aulnay-Sous-Bois – Troisième – Physique-chimie ... Exercice n°2.
EXERCICES RATTRAPAGE SECONDE
Ex 1 Ecrire des configurations électroniques
1.2. ܪ
3. ème colonne de la 3ème période. Ecrire sa configuration électronique
Ex 2 Placer un atome dans la classification
Un atome a pour configuration électronique : 1s22s22p4. Quelle est sa position dans le tableau périodique ?
Ex 3 Compter les électrons de valence
1. Un atome a pour configuration électronique 1s22s22p63s23p3. -t-il sur sa couche externe ?
2. ème colonne de la 2ème -t-il sur sa couche
externe ?Ex 4 Famille chimique
: 1s22s22p3. Il est situé dans la période suivante. Quelle est sa configuration électronique ?Ex 5 oatomique
Le chlorure de sodium est composé des ions Cl- et Na+. Donner la configuration électronique de ces deux ions.
Ex 61. Donner sa configuration électronique
2. Celle-ci respecte-t- ?
Ex 7 Ex 8 1.2. De quel atome cet ion est-il isoélectronique ?
Ex 9 Stabilité du néon et ions monoatomiquesLe sel de mer est majoritairement composé de chlorure de sodium NaCl. Il contient également du chlorure de
magnésium de formule MgCl21. Donner les structures électroniques des atomes Mg et Cl
2. En déduire les charges des ions magnésium et chlorure
3. possèdent-ils sur leurs couches externes ?
Données :Numéro atomique des éléments : Mg(Z=12) ; Na(Z=11) ; Cl(Z=17) PROPRIETES PHYSIQUES DE LA MATIERE CHAPITRE 7EXERCICES
Ex 10 Cinq minutes chrono !!
: 8 éléctrons / lacune/ charges formelles / électronégativité/ électrons / polaire/apolaire/ses
liaisons/b./a./a./b./a.Ex 11-
On considère les éléments de la deuxième ligne du tableau périodique.1. Repérer ces éléments dans le tableau périodique et
correspondants2. Etablir le schéma de Lewis de chacun des atomes de ces éléments
Ex 12 Attribuer à un atome son schéma de Lewis Choisir parmi les représentations suivantes le schéma de Lewis de Ex 13On considère les éléments suivants appartenant à la 17ème colonne du tableau périodique : F ; Cl ; et Br
Construire les schémas de Lewis des
(1s1) Ex 1422s22p3)
Choisir parmi les représentations suivantes le schéma de Lewis de cette molécule : Ex 15Les éléments oxygène O et chlore Cl appartiennent respectivement à la 16ème et à la 17ème période du tableau
périodique. A partir de leurs schéma de Lewis, justifier les charges portés par les ions oxyde a et chlorure b
Ex 16Les éléments lithium Li, sodium Na et potassium K appartiennent tous à la première colonne de la classification
périodique. Ils se trouvent en abondance dans les océans sous forme ionique. Établir les schémas de Lewis des ions stables issus des trois atomes correspondants.Ex 17 Lacune électronique
1. À partir de la configuration électronique de
H (1s1), déterminer le schéma de +
2. Justifier la présence de la lacune dans le schéma de Lewis de la molécule
de chlorure Ex 18 Prévoir le nombre de liaisons covalentes On donne le numéro atomique de certains atomes :1. Donner la structure électronique de chaque atome
2. En déduire le nombre de liaisons covalentes que ces atomes peuvent établir. Justifier
Atome Hélium : He Carbone : C Fluor : F Néon : Ne Silicium : Si Argon : ArNuméro atomique 2 6 9 10 14 18
Structure
électronique 1s2 1s22s22p2 1s22s22p5 1s22s22p6 1s22s22p63s23p2 1s22s22p63s23p6Liaisons covalentes
(règle octet et duet) 0 2 1 0 4 0 Ex 19 Prévoir le nombre de doublets non liantsLa formule semi--dessous :
1. Donner la
2. Etablir en justifiant la formule de Lewis de cette molécule
1. 1s22s22p63s23p4 et 1s1
2.Ex 20 Autour de quelques molécules simples
H2O, de dioxyde de carbone CO2 et de méthane CH4H (Z=1) ; C (Z=6) ; N (Z=7) ; O (Z=8).
Configuration électronique des atomes :
Il possède 1 électron de valence et doit former 1 liaison covalente pour respecter la règle du duet.
La molécule de dioxyde de carbone contient électrons de valence, soit 8 doublets. Parmi ces 8
La molécule de méthane contient électrons de valence, soit 4 doublets. Ces 4 doublets sont des
Ex 21 -
3.La solution
elle, contient des ions OH et des ions NH4+. 1. 2. 3. 4+Il possède 1 électron de valence et doit former 1 liaison covalente pour respecter la règle du duet.
Schéma de Lewis :
Il possède 1 électron de valence et doit former 1 liaison covalente pour respecter la règle du duet.
doublets. Parmi ces 4 doublets, un est une liaison covalente pour respecter la règle du duet au niveau de
Schéma de Lewis :
Il possède 1 électron de valence et doit former 1 liaison covalente pour respecter la règle du duet.
covalentes et possède électrons de valence, au lieu des 5 habituelles. Il est donc représenté avec une
Schéma de Lewis :
Ex 22 1. Le dioxyde de carbone CO2 est aussi présent dans 2 est 2. 1.Il possède électrons de valence soit 5 doublets au total. Les 2 doublets qui ne sont pas des liaisons
Schéma de Lewis :
Il possède électrons de valence soit 6 doublets au total. Les 4 doublets qui ne sont pas des liaisons
Schéma de Lewis :
2. Configuration électronique des atomes :
Il possède 1 électron de valence et doit former 1 liaison covalente pour respecter la règle du duet.
La molécule de dioxyde de carbone possède électrons de valence, soit 8 doublets parmi minimiser la répulsion électrostatique entre elles. La géométrie est linéaire.Schéma de Lewis :
Schéma de Lewis :
Les doublets non liants sont sujets aux interactions électrostatiques au même titre que les liaisons covalentes,
donnant lieu à un schéma de répulsion électrostatique similaire à celui de molécules comportant 4 liaisons simples.
Schéma de Lewis :
en compte cette géométrie. Ex 23Les schémas de Lewis des molécule-
- gène et de chlorure de méthanoyleEx 24 Acide hypochloreux
comme agent nettoyant de la peau. Établir sa représentation de Lewis et donner la géométrie de cette molécule.
Il possède 1 électron de valence et doit former 1 liaison covalente pour respecter la règle du duet.
Schéma de Lewis :
atome central, engendrant une répulsion électronique des liaisons covalentes. Sa géométrie est donc coudée.
liaison .Ex 25 Peinture
les peintures acryliques. Ils sont particulièrement visqueux, adhérents et élastiques -contre :1. Ecrire la formule brute de la molécule
2.3. Déterminer la formule de Lewis de cette molécule
4. Donner la géométrie autour de chaque atome de carbone
1. C3H4O2
2. H : 1s1 ; C : 1s22s22p2 ; O : 1s22s22p4
3.4. Triangulaire plane
Ex 26Le chlorosilane est un gaz utilisé lors de la préparation de silicium très pur destiné à
contre :Etablir la géométrie de la molécule
La molécule est tétraédrique :
Ex 27 Interpréter la polarisation des liaisons1. Expliquer pourquoi les liaisons C-O, C-F et C-Li sont polarisées
2. Pour chacune de ces liaisons polarisées, préciser sur chaque atome si la charge partielle qui apparait est positive
ou négative 2.Ex 28 Molécules simples et polarité
1. Établir le schéma de Lewis de la molécule de dihydrogène H2. Préciser si cette molécule est polaire.
2. Établir le schéma de Lewis de la molécule de dioxygène O2. Préciser si cette molécule est polaire
3. H+. En quoi cet ion est-il particulier ?
4. -il connaître la géométrie de cette molécule pour
déterminer si elle est polaire ou non ?1. Apolaire
2. Apolaire
3. possède une lacune
4. Sans la géométrie, le barycentre des charges positives et négatives seraient confondus
Ex 29 Rechercher des liaisons polarisées
Le modèle de la molécule de 2-chloroéthanol, HO-CH2-CH2-Cl, est donné ci-contre :
1. Expliquer pourquoi les liaisons C-O, C-Cl et O-H de
cette molécule sont polarisées2. Ecrire la formule de Lewis de la molécule et préciser
pour les atomes 1, 2 et 3 si la charge partielle qui apparait est positive ou négative1. Les électronégativités des atomes sont différentes
2. Ex 30Parmi les deux molécules dont les modèles sont fournis, laquelle est une molécule polaire ? Justifier.
Ex 31 Adrénaline
Jokichi Takamine (1854-1922), biochimiste et industriel, découvrit en 1901 la première hormone pure jamais surrénale. Il la nomma adrenalin (qui signifie près du rein). Son modèle moléculaire est représenté ci-contre : 1. - dessus, établir la formule brute de la molécule2. À partir de leurs configurations électroniques,
préciser le nombre de liaisons formées par chacunés dans cette molécule (C,
H, O et N).
3. En déduire la représentation de Lewis de cette molécule.
4. Numérotez vos atomes et justifier la géométrie de chaque atome dans la molécule.
Données :
Numéros atomiques des atomes : H (Z=1) ; C (Z=6) ; N (Z=7) ; O (Z=8).Il possède 1 électron de valence et doit former 1 liaison covalente pour respecter la règle du duet.
doublets dont 29 sont des liaisons covalentes (avec 3 doubles liaisons dans le cycle à 6 carbones), et 7 sont
Schéma de Lewis :
Ex 32 Un bronzage artificiel
La dihydroxyacétone (ou DHA) est utilisée dans la formulation des autobronzants. Elle donne un hâle brun par
réaction photochimique. On donne ci-dessous la représentation de Lewis et le modèle moléculaire de la molécule de
DHA :1. Interpréter la représentation de Lewis de la molécule
2.1. Dans la représentation de Lewis
forment respectivement 1, 4 et 2 liaison(s) covalente(s).ا duet ب
possèdent aucun doublet non liant. + 4 = 8). Ils sont bien entourés de 4 doublets liants. tet (6 + 2 = 8). Ils sont bien entourés de 4 doublets : 2 doublets non liants et 2 doublets liants.2. entouré de quatre doublets liants engagés dans quatre liaisons simples. Ils adoptent
donc une disposition tétraédrique. La géométrie est donc tétraédrique autour de cet atome de carbone.
x sont engagés dans une liaison double. Ilsadoptent donc une disposition triangulaire. La géométrie est donc triangulaire plane autour de cet atome de carbone.
deux doublets non doublets entre eux, la géométrie de la molécule est donc coudée autour de cet atome.Ex 33 Pollution
La pollution par les ions nitrate NO3 et les ions nitrite NO2 dans nos co NO2 géométrie. 1. 2. 3. 4.Données :
Numéro atomique des atomes : H (Z=1) ; C (Z=6) ; N (Z=7) ; O (Z=8). Ex 341. Établir la structure de Lewis de la molécule de dichlore.
2. Établir la structure de Lewis des ions chlorure, hypochlorite et hydroxyde
3. Pourquoi est-HO au lieu de OH ?
La molécule de dichlore est constituée de 2 atomes de chlore dotés chacun de 7 électrons de valence, elle forme
covalente chacun. Les 6 doublets restants sont non liants et répartis équitablement autour de chaque atome.
Schéma de Lewis :
2. Ion chlorure :
Schéma de Lewis :
Ion hypochlorite :
non liants et répartis équitablement autour de chaque atome.électrons de valence contre 6 habituellement. En conséquence, il porte une charge négative, en accord avec le fait
Ion hydroxyde :
Configuration électronique des atomes :
Il possède 1 électron de valence et doit former 1 liaison covalente pour respecter la règle du duet.
électrons de valence contre 6 habituellement. Il porte une charge négative, en accord avec le fait que
Ex 35 - Géométrie et polarité en qcm
a) due à la répulsion entre les atomes O et H. b) b. due à la répulsion entre les liaisons covalentes. c) d) d. responsable du caractère polaire de cette molécule.7H16, est une molécule :
a) polaire. b) apolaire. c) possédant des liaisons covalentes peu polarisées.3. La molécule de dioxyde de carbone CO2 possède deux liaisons C=0 polarisées. Cette molécule est donc :
a) apolaire car elle a un nombre pair de liaisons polarisées. b) polaire car elle possède deux liaisons polarisées c)Ex 36 Un additif en peinture
1. Interpréter la représentation de Lewis de la molécule à
2. Justifier la géométrie de la molécule autour des atomes
(1), (2), (3) et (4)Données : H (Z=1), C (Z=6), N (Z=7) et O (Z=8)
1. 1s1 Atome de carbone : 1s22s22p2
1s22s22p3 Ato1s22s22p4
1) = Atome de carbone C : il manque (8 4) = 4 électrons pour obtenir5) = 3 électrons pour obtenir un octet
6) = 2 électrons pour obtenir
deux. Dans la représentation de Lewis proposée, ces conditions sont satisfaites. Il lui manque donc 2 électrons, soit un doublet non liant. Il lui manque donc 4 électrons, soit deux doublets non liants.2. Atome de carbone (1) : il est lie à quatre atomes et ne porte aucun doublet non liant.
Atome de carbone (2) : il est lie à trois atomes et ne porte aucun doublet non liant. liant. non liants.Atome (1) : les quatre doublets liants adoptent une disposition tétraédrique, la géométrie est donc tétraédrique autour
de cet atome de carbone.Atome (2) : les doublets adoptent une disposition triangulaire, la géométrie est donc triangulaire plane autour de cet
atome de carbone.Atome (3) : les doublets liants et le doublet non liant adoptent une disposition triangulaire du fait de la répulsion entre
tous lesAtome (4) : les deux doublets liants et les deux doublets non liants adoptent une disposition tétraédrique ; la géométrie
Ex 37 Formaldéhyde
Le méthanal est un aldéhyde de formule brute : CH2O. En solution aqueuse, il est appelé formol et sert en médecine comme conservateur de certains échantillons biologiques. Son modèle moléculaire est le suivant :1. Établir sa représentation de Lewis
2.3. Quelle liaison covalente est polarisée au sein de cette molécule ? Justifier
1. Configuration électronique des atomes :
Il possède 1 électron de valence et doit former 1 liaison covalente pour respecter la règle du duet.
La molécule de formaldéhyde possède électrons de valence, soit 6 doublets parmilesquels 2 sont des liaisons covalentes simples pour respecter la règle du duet au niveau des atomes
Schéma de Lewis :
Ex 38 Į-aminé
Į-aminés les plus présents dans les
protéines. Les acides aminés possèdent une fonction amine 2 et une fonction acide carboxylique .1. À partir du modèle moléculaire, établir la formule de Lewis de
2. Préciser la géométrie observée
fonction acide carboxylique. 3. fonction amine4. Préciser les charges partielles présentes sur cette molécule.
Données
Numéros atomiques des atomes : H (Z=1) ; C (Z=6) ; N (Z=7) ; O (Z=8).Configuration électronique des atomes :
1 électron de valence, doit former 1 liaison covalente pour respecter la règle du duet.
niveau des atomes de carbone sont respectées. Les 5 doublets restant sont non liants et répartis entre les atomes
Schéma de Lewis :
les uns sur les autres. sont agencés selon une géométrie trigonale plane. charges partielles suivantes :Ex 39 Le tétrachlorure de carbone
Le tétrachlorure de carbone, de formule brute CCl4, est unequotesdbs_dbs10.pdfusesText_16[PDF] 2 exercices sur les fonctions exponentielles Terminale Mathématiques
[PDF] 2 exercices, DM de Math 4ème Mathématiques
[PDF] 2 exercise de math sur les puissances et le developpement 2nde Mathématiques
[PDF] 2 exo du DM 4ème Mathématiques
[PDF] 2 exos de maths 2nde Mathématiques
[PDF] 2 exos le 1er jeans le 2em pull silvouplais c'est pour demain =/ 5ème Mathématiques
[PDF] 2 g de sel PDF Cours,Exercices ,Examens
[PDF] 2 grandes aires de départ et d'arrivée des migrants dans le monde PDF Cours,Exercices ,Examens
[PDF] 2 inéquations 3ème Mathématiques
[PDF] 2 inéquations, delta= -3 1ère Mathématiques
[PDF] 2 Les Formes de Restauration 2nde Autre
[PDF] 2 matérieux de construction architecturale 3ème Arts plastiques
[PDF] 2 minis exercices PGCD 3ème 3ème Mathématiques
[PDF] 2 minis phrases ? traduire Terminale Anglais
