 RESUME DU COURS DE PHYSIQUE CHIMIE 3ème CHIMIE
RESUME DU COURS DE PHYSIQUE CHIMIE 3ème CHIMIE
Tous les matériaux toutes les substances sont constitués d'atomes. La taille de l'atome est de l'ordre du dixième de nanomètre (0
 PHYSIQUE CHIMIE Extrait de cours Physique-Chimie
PHYSIQUE CHIMIE Extrait de cours Physique-Chimie
Page 1. PHYSIQUE CHIMIE. Troisième. - Premier trimestre -. Extrait de cours Physique-Chimie. Page 2. Cours de physique-chimie. Troisième. Physique Chimie - page
 Ce document est téléchargé sur le site de http
Ce document est téléchargé sur le site de http
On dit que l'œil est trop « cours » du fait d'un cristallin pas assez ✓ Guide du professeur de PC en 3è. ✓ Fascicule PC 3è SACRE CŒUR ET M. DIAO. Page 46 ...
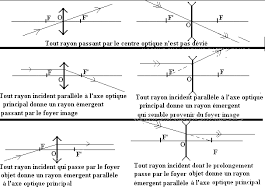
 Les lentilles minces
Les lentilles minces
cours-exercices-devoir-de-. 3e.html cours de physique troisième : Page 1. Cours de physique 3e conçu par I.R.E.M.P.T : DEPARTEMENT DE PHYSIQUE - CHIMIE. Pour ...
 Guide de lenseignant sciences physiques 4e et 3e
Guide de lenseignant sciences physiques 4e et 3e
· Les volumes horaires prennent en compte les séances de cours de travaux pratiques et d'exercices. V2 . GuidE d'EXEcution dE la classE dE QuatriEME. V.2.1
 PHYSIQUE-CHIMIE- TECHNOLOGIE
PHYSIQUE-CHIMIE- TECHNOLOGIE
devra construire au cours de la mise en œuvre de la situation d'apprentissage considérée. la 3ème pupille vaut 4 π etc… puisque les pupilles sont.
 Untitled
Untitled
PHYSIQUE - CHIMIE 3ème. 2H. 64. 7%. Page 7. 7. IV- CORPS DU PROGRAMME EXEMPLE DE SITUATION : Au cours d'une séance de Travaux Pratiques dans la classe de 3ème ...
 Fiche de révision de 3eme en physique chimie - DNB
Fiche de révision de 3eme en physique chimie - DNB
Fiche de révision de 3eme en physique chimie - DNB. 1/ Chimie : organisation Autre définition : C'est la ligne tracée par un objet au cours de son mouvement.
 Fiche de révision de 3eme en physique chimie - DNB
Fiche de révision de 3eme en physique chimie - DNB
C'est souvent la trajectoire la plus simple. Définition de la trajectoire : C'est l'ensemble des positions occupées par un objet au cours du temps. Autre déf :
![[PDF] ANNALES SCIENCES PHYSIQUES 3ème [PDF] ANNALES SCIENCES PHYSIQUES 3ème](https://pdfprof.com/PDFV2/GoBo/Images1/17_918_2_.png) [PDF] ANNALES SCIENCES PHYSIQUES 3ème
[PDF] ANNALES SCIENCES PHYSIQUES 3ème
dihydrogène en fin de réaction après refroidissement. PHYSIQUE (10pts). A Questions de cours (55pts). 1. Quelles sont les unités du système international
 ANNALES SCIENCES PHYSIQUES 3ème
ANNALES SCIENCES PHYSIQUES 3ème
dihydrogène en fin de réaction après refroidissement. PHYSIQUE (10pts). A Questions de cours (55pts). 1. Quelles sont les unités du système international
 Fascicule-de-PC-3eme-BEYE.pdf
Fascicule-de-PC-3eme-BEYE.pdf
Exercice 8 : Au cours d'EPS un élève de masse 70 kg s'élève d'une hauteur h = 5 m sur une corde.
 Couverture Cours dété_sans devoirs_générique_18-séparées.indd
Couverture Cours dété_sans devoirs_générique_18-séparées.indd
Physique Chimie. 3e. Physique. Chimie Le cours de révision est composé de trois dossiers. ... 3ème. Science Physiques Chimie. Reprodu. Reproduction.
 Fiche de révision de 3eme en physique chimie - DNB
Fiche de révision de 3eme en physique chimie - DNB
Fiche de révision de 3eme en physique chimie - DNB Définition de la trajectoire : C'est l'ensemble des positions occupées par un objet au cours du temps.
 GUIDE PEDAGOGIQUE SCIENCES PHYSIQUES 3ème
GUIDE PEDAGOGIQUE SCIENCES PHYSIQUES 3ème
3ème. Avec l'appui du projet USAID/Éducation de Base. Avril 2010 Utiliser les acquis du cours sur les lentilles dans la résolution de problèmes.
 Guide de lenseignant sciences physiques 4e et 3e
Guide de lenseignant sciences physiques 4e et 3e
· Les volumes horaires prennent en compte les séances de cours de travaux pratiques et d'exercices. V2 . GuidE d'EXEcution dE la classE dE QuatriEME. V.2.1
 guide dusage des programmes physique et chimie
guide dusage des programmes physique et chimie
Guide d'usage de Sciences Physiques – 4ème et 3ème physique/chimie et environnement de l'élève (agriculture santé
 ADEM_FASCICULE_PC_3eme_
ADEM_FASCICULE_PC_3eme_
Fascicule SCIENCES PHYSIQUES – 3ème v10.17 interdépendante offrent à l'élève des occasions de consolider les acquis du cours et d'évaluer.
 optique-cours-lentilles.pdf
optique-cours-lentilles.pdf
RÉSUMÉ DU COURS. IMAGE FORMÉE PAR UNE LENTILLE MINCE CONVERGENTE. Convention: Dans cet exposé la lumière est supposée se déplacer de la gauche vers la
 © Cours Pi Paris & Montpellier www.cours-pi.com
© Cours Pi Paris & Montpellier www.cours-pi.com
Ce Cours comme tous les autres que nous proposons de la Petite Section de E) Conversion des signaux sonores. Devoirs n°8 & 9. Physique-Chimie. 3ème ...
 Accueil - Sénégal Education
Accueil - Sénégal Education
Accueil - Sénégal Education
1/ Chimie : organisation et transformation de la matière
a) Atomes, molécules et ions bougent des électrons. Une molécule est constituée de plusieurs atomes.Modèle de
Nom Carbone Hydrogène Oxygène Azote
Symbole C H O N
Quasiment toute la masse est contenue dans le noyau.La taille du noyau -15 m -10 m un noyau est
environ 100 lacunaire : entre les électrons et le noyau, il y a du vide. Un atome est électriquement neutre : il y a donc autant de protons (chargés +) que Les atomes (et noyaux) sont représentés par un symbole : Les 118 atomes différents sont classés dans le tableau périodique des éléments par numéro atomique Z croissant : 18 colonnes, 7 lignes.Atome Nombre de
protons (Z)Nombre
Nombre de
neutronsCarbone
126C 6 6 12 - 6 = 6
Sodium
2311Na 11 11 23 11 = 12
atomeMolécule
C2H6O A X Z protons nucléons (protons + neutrons)La molécule contient 2 atomes de
Electrons : chargés ʹ
Protons : chargés +
Neutrons : charge 0
atome de Bore : Z = 5 (5 protons) ; 5 électrons ; 6 neutronsUn . Il y a
donc des : Ions positifs appélés CATIONS PERDU des électrons. Ex : Fe2+, Fe3+, Al3+ Ions positifs appélés ANIONS : Atom des électrons. Ex : Cl-, F-, SO42- Per- nb de charges " + » nb de charges " - » aluminium (III) Al3+ perte de 3 e- 13 10 fer(III) Fe3+ perte de 3 e- 26 23 fer (II) Fe2+ perte de 2 e- 26 24 chlorure Cl- - 17 18 b) Identification des ionsUne solution est toujours électriquement neutre : il y a autant de charges positives que de charges
négatives. Une solution ionique : (ion + + ions -)Exemples : sulfate de cuivre II : (Cu2+ + SO42) Chlorure de fer III (Fe3+ + 3 Cl-)
de couleurs.Ion Chlorure
Cl-Cuivre
Cu2+Fer II
Fe2+Fer III
Fe3+ Zinc Zn2+Aluminium
Al3+Réactif
utilisé nitrate (Ag+ +NO3)Soude ou hydroxyde de sodium (Na+ + HO-)
Précipité
obtenu BleuVert kaki
marron blanc blancExemples :
Les réactions chimiques qui ont lieu
entre le réactif et la solution sont :Cu2+ + 2 HO- Cu(OH)2
Ag+ + Cl- AgCl
Zn2+ + 2 HO- Zn(OH)2
Un précipité est un solide
Perte de 2 électrons
Atome de magnésium Mg
électriquement NEUTRE
12 électrons ʹ
12 protons +
12 neutrons 0
Ion magnésium Mg2+
10 électrons ʹ
12 protons +
12 neutrons 0
Gagne 1 électron
Atome de fluor F
électriquement NEUTRE
9 électrons ʹ
9 protons +
10 neutrons 0
Atome de fluor F-
électriquement NEUTRE
10 électrons ʹ
9 protons +
10 neutrons 0
Blanc qui noircità la lumière
Il y a des ions Cl-
Il y a des ions Cu2+
Solution de chlorure de cuivre II Cu2+ + 2 Cl-)
Il y a des ions Cl-
Il y a des ions Zn2+
Solution de chlorure de zinc Zn2+ + 2 Cl-)
c) pH : solutions acides et basiquesUne solution est acide
hydrogène H+ Une solution est basique si son pH est compris entre 7,01 et 14. La basicité est due à ion hydroxyde HO-Une solution très acide (pH proche de 0) et une solution très basique (pH proche de 14) sont dangereuses :
On mesure le pH avec :
Du papier pH
Un indicateur coloré acido-basique comme le jus de chou rouge, qui change de couleur en fonction du pH.
Un pH-mètre
Remarque :
d) Réaction entre un acide et une base hydrique (H + + Cl- de sodium (Na + + HO-), une réaction chimique a lieu et dégage beaucoup de chaleur.H+ + HO- H2O
e) Réaction entre un acide et un métal Un métal est un bon conducteur thermique et électrique. Il est recyclable. Produits corrosifsProduitsécotoxiquesProduits irritants2 H+ + Fe = H2 + Fe2+
Dihydrogène explosif : quand on approche une allumette : détonation" POP »2 H+ + Zn = H2 + Fe2+
6 H+ + 2 Al = 3 H2 + 2 Al3+
: RIEN Les ions qui ne réagissent pas sont dits spectateurs : on ne les écrit Lors de la réaction entre un acide et un métal, Les ions hydrogène H+ pour donner du dihydrogène gazeux H2 - Il y a conservation de la masse du signe " = ») - Il y a conservation des charges électriques (il y a autant de + et de de chaque côté). f) Autres transformations chimiques : A chaque fois, il faut veiller à la conservation des atomes de chaque côté du " = ».Combustion du carbone : C + O2 = CO2
Combustion du méthane : CH4 + 2 O2 = CO2 + 2 H2O Combustion du propane : C3H8 + 5 O2 = 3 CO2 + 4 H2O Combustion : C2H6O+ 3 O2 = 2 CO2 + 3 H2O me de banane : C5H12 O + C2H4O2 = C7H14O2 + H2O g) Masse volumique (pas au programme du DNB 2017)Exemple :
Un matériau appelé Hassium est un des plus dense sur Terre.. Un morceau de volume V= 1200 cm3 = 1,2 L a une
ǒ3 et kg/m3
ǒ40,8 g/cm3 = 40 800 kg/m3
h) Différents états de la matière mǒ x V
m = ǒ x Vǒ = m
V V = m en kg ou g en m3 ou cm3 en kg/m3 ou g/cm3Etat Solide Liquide gazeux
du modèle molécule Compact et ordonné Compact et désordonné Dispersé et très désordonnéMolécules Liées, quasi immobiles
et rapprochéesUn peu liées, mobiles et
très rapprochéesNon liées, éloignées, en
mouvement rapideVolume propre, une
forme propre Volume propre i) Atmosphère terrestre mélange de plusieurs gaz : sa composition est78% de diazote N2 : on arrondira à 80 % soit 4/5.
21% de dioxygène O2: on arrondira à 20% soit 1/5.
: le dioxyde de carbone CO2 le dihydrogène H2 Le dioxygène O2 est un gaz indispensable à la respiration et aux - (1 litre deau pèse 1 kg) j) Différence entre transformation physique, transformation chimique, mélange - Une transformation physique est la passage de la matière . Il y a juste un Atomes et molécules ne changent pas. Ex : vaporisation, solidification,- Une transformation chimique est le passage d'une espèce chimique à une nouvelle espèce chimique.
Les espèce chimiques de départ, appelées REACTIFS, se transforment en nouvelles espèces chimiques
appelées PRODUITS. Le phénomène permettant cette transformation chimique est appelé réaction
chimique. Exemples : décomposition, synthèses, oxydations, précipitations, certaines dissolutions. - Un mélange est juste une mise en commun de deux corps ensemble. Ex : huile + vinaigre. k) Différence entre transformation physique, transformation chimique, mélangeTests caractéristiques
Gaz Test
Dihydrogène
H2Détonation à
allumetteDioxyde de carbone
CO2Eau de chaux qui se
troubleEteint une flamme de
bougieDichlore Cl2 Gaz de couleur verte
qui pueDioxygène O2 Ravive une flamme ou
une braise (liquide ou gaz)Eau H2O
Sulfate de cuivre
anhydre qui devient bleu2/ Energie
est un concept abstrait qui quantifie . transfère et se transforme.Unité officielle (SI) : le Joule (J).
a) renouvelables : Soleil, eau, chaleur de la Terre (géothermie), vent, biomasse non- renouvelables son o Sources fossiles : pétrole, gaz, charbon. o Source nucléaire : Uranium. : potentielle de position , cinétique, électrique, lumineuse , chimique, thermique, mécanique, nucléaire, musculairePétrole, gaz, charbon Energie chimique
Uranium Energie nucléaire
Vent Energie cinétique (ou éolienne)
Soleil Energie lumineuse ( ou solaire)
Chaleur de la Terre Energie thermique (ou
géothermique)Biomasse Energie chimique
Eau Energie cinétique ( ou
hydraulique) b) Ex : pile qui alimente une lampe Ex : dynamo qui alimente une lampe ie chimique enénergie électrique
c)Il existe plusieurs façons de t :
LeLe transfert thermique par :
Conduction : sans transport de matière, du corps chaud vers le corps froid. Convection : avec transport de matière, entre des fluides chauds et froids. Rayonnement : par des ondes électromagnétiquesénergie électrique
d)Les : On fait tourner une turbine (avec de
alternateur.Un alternateur aimant + une bobine.
Un alternateur est un convertisseur
énergie électrique
nucléaire et 19,1 % (eau, vent, bois, déchets, soleil) provient de sources able pour fabriquer de la vapeurUn alternateur produit une tension
alternative (alternativement + et -). variable (qui change tout le temps). En conséquence, la tension délivrée par EDF qui arrive dans nos maisons a la forme suivante. - Alternative : car elle est alternativement + et - Périodique : car elle se répète identiquement dans le temps. - Variable : car elle change tout le temps - Sinusoïdale arrondiePériode T :
Fréquence f = 1/T
Umax maximale.
Pour la tension du secteur (prise de courant) :
- Fréquence f = 50 Hz - Période T = 20 ms - Tension maximale Umax - tension efficace mesurée avec un voltmètre en alternatif Ueffquotesdbs_dbs22.pdfusesText_28[PDF] ligne phrase paragraphe ce1
[PDF] distinguer ligne et phrase ce1
[PDF] texte paragraphe phrase cycle 3
[PDF] donner lheure en anglais
[PDF] lheure en anglais exercices
[PDF] apprendre lheure en anglais
[PDF] quelle heure est il en anglais
[PDF] exercice sur lheure en anglais 6ème
[PDF] toutes les heures en anglais
[PDF] exercices heure anglais ? imprimer
[PDF] difference age couple moyenne
[PDF] la différence d'age dans un couple texte argumentatif
[PDF] lage du mariage dans la bible
[PDF] se marier avec une femme plus agée islam
