 Sans titre
Sans titre
Règles du duet et de l'octet. Atome. Numéro atomique Z ils vérifient la règle de l'octet. ... Quelle règle respecte-t-il dans une molécule ?
 Schéma de Lewis
Schéma de Lewis
Règle du Duet. L'atome d'hydrogène possède 1 électron de valence et cherche à atteindre la configuration électronique de valence de l'atome d'hélium (He) à
 1. Les règles du duet et de loctet
1. Les règles du duet et de loctet
On dit aussi qu'ils présentent une grande inertie chimique. B. Règle du duet. ? Au cours de leurs transformations chimiques les atomes caractérisés par Z ? 4
 Thème 1 : La matière
Thème 1 : La matière
chacun des atomes de respecter la règle du duet ou de l'octet et donc de s'entourer de deux ou huit électrons. 1- La liaison covalente :.
 Compétence C3 Japplique les règles du duet et de loctet pour
Compétence C3 Japplique les règles du duet et de loctet pour
J'applique les règles du duet et de l'octet pour rendre compte des charges des ions monoatomiques usuels. Exercice 1. On donne la structure électronique
 rappels seconde molecules
rappels seconde molecules
On peut alors définir deux règles : 1- La règle du duet : Les atomes dont le numéro atomique est proche de celui de l'Hélium Z=2 ont
 LES MOLECULES: REPRESENTATION CORRECTION
LES MOLECULES: REPRESENTATION CORRECTION
b) Règle de l'octet: les atomes cherchent à acquérir la structure électronique externe en octet des gaz rares. Règle du duet: les atomes de numéro atomique
 1 Théorie de Lewis
1 Théorie de Lewis
Exception : H ne s'entoure que de 2 électrons : règle du duet. Premiers exemples : considérons les atomes H O et Cl. Leurs confi-.
 Rédiger un exercice
Rédiger un exercice
Un atome créera autant de liaisons qu'il lui manque d'électrons pour respecter la règle du duet ou de l'octet. 3) Quelles sont les différentes liaisons de
 Règle du duet et de loctet - Nanopdf
Règle du duet et de loctet - Nanopdf
Règle du duet et de l'octet. Pourquoi le sodium donne l'ion Na. + ? Pourquoi les atomes s'assemblent pour former toujours les mêmes molécules ?
 I- Règles du DUET et de l’OCTET (K) (L) - AlloSchool
I- Règles du DUET et de l’OCTET (K) (L) - AlloSchool
Ce sont les règles du duet et de l’octet que l’on peut écrire 3-Énoncé des règles la règle du « duet » la règle de l’« octet » Les éléments de numéro atomique (Z?5) proche de celui de l’hélium adoptent la structure électronique (K)2 Ils ont alors deux électrons sur leur couche externe
 Structure électronique d un atome Règles du duet et de l octet
Structure électronique d un atome Règles du duet et de l octet
II – Règles du duet et de l’octet (rappel de 2°) Pour devenir stable les éléments adoptent la structure du gaz noble le plus proche soit en perdant soit en gagnant un ou plusieurs électrons Si le gaz noble le plus proche est l’hélium on applique la règle du duet
 Les règles du duet et de l’octet - CanalBlog
Les règles du duet et de l’octet - CanalBlog
1 Les règles du duet et de l’octet A Remarques a Transformations subies par les atomes Lorsque les atomes subissent des transformations (transformation en ion monoatomique ou lorsque qu'ils établissent des liaisons avec d'autres atomes) ils le font de façon à saturer leur couche externe b Atomes chimiquement stables
 Searches related to regle du duet PDF
Searches related to regle du duet PDF
(duet ou octet) 3 Justifier soigneusement à partir de la structure électronique et des règles du « duet » et de l’octet + du tableau périodique le nombre de liaison(s) que peuvent faire les atomes : H (hydrogène) ; C (carbone) ; O (oxygène) ; Cl (chlore) ; et N (azote) EXERCICES D’ENTRAINEMENT de NIVEAU ACCEPTABLE
Seconde - TP Chimie n°6 Eric DAINI - Lycée Paul Cézanne - Aix en Provence - http://labotp.org
LES MOLECULES: REPRESENTATION
CORRECTION
I REPRESENTATION DE LEWIS DES MOLECULES
1) Les atomes
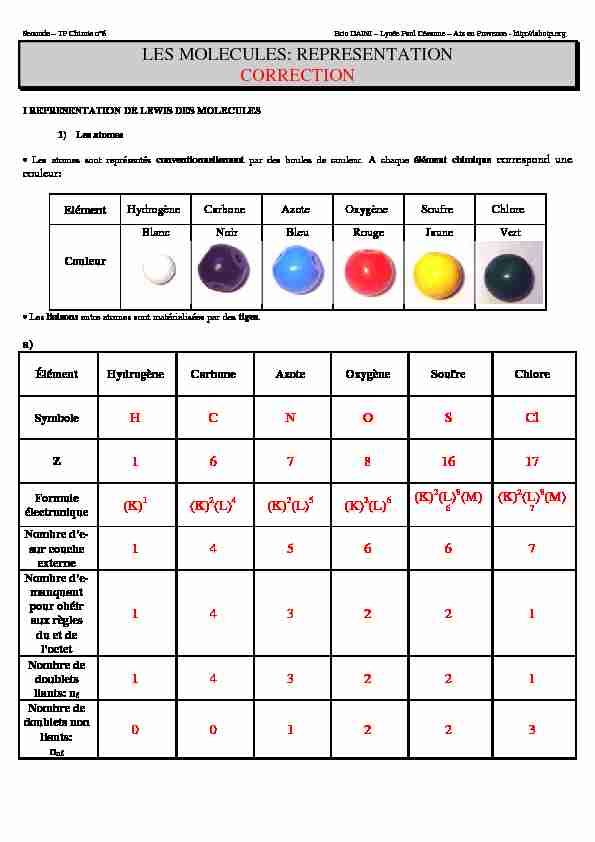
· Les atomes sont représentés conventionnellement par des boules de couleur. A chaque élément chimique
correspond une couleur:Elément
Hydrogène Carbone Azote Oxygène Soufre ChloreCouleur
Blanc Noir
Bleu Rouge Jaune Vert
· Les liaisons entre atomes sont matérialisées par des tiges. a) Élément Hydrogène Carbone Azote Oxygène Soufre ChloreSymbole H C N O S Cl
Z 1 6 7 8 16 17
Formule
électronique (K)1 (K)2(L)4 (K)2(L)5 (K)2(L)6 (K)2(L)8(M)
6 (K)2(L)8(M)
7Nombre d"e-
sur couche externe1 4 5 6 6 7
Nombre d"e-
manquant pour obéir aux règles du et de l"octet1 4 3 2 2 1
Nombre de
doublets liants: n llll 1 4 3 2 2 1Nombre de
doublets non liants: n nllll0 0 1 2 2 3
Seconde - TP Chimie n°6 Eric DAINI - Lycée Paul Cézanne - Aix en Provence - http://labotp.org
b) Règle de l"octet: les atomes cherchent à acquérir la structure électronique externe en octet des gaz rares.
Règle du duet: les atomes de numéro atomique voisin de celui de l"hélium (Z = 2) cherchent à acquérir la structure électronique
externe en duet de l"hélium.c) Ajout au tableau de la ligne indiquant le nombre d"électrons manquant sur la couche externe de l"atome pour
obéir aux règles du duet ou de l"octet.2) Les molécules
· Une molécule est une association électriquement neutre d"atomes. a) La molécule d"éthanol C2H6O molécule contient:
2 atomes de carbone
6 atomes d"hydrogène
1 atome d"oxygène
b) La molécule d"eau H2O contient:
2 atomes d"hydrogène
1 atome d"oxygène
La molécule de dioxyde de carbone CO
2 contient:
1 atome de carbone
2 atomes d"oxygène
3) Liaison covalente
a) Ajout au tableau de la ligne indiquant le nombre de doublets liants noté n llll b) Ajout au tableau de la ligne indiquant le nombre de doublets non liants noté n nl l l l de chaque atome.4) Représentation de Lewis d"une molécule
II ETUDE DE QUELQUES MOLECULES
1) Etude de molécules simples
a) Dihydrogène H 2: n t = 1 + 1 = 2 donc nd = 2 /2 = 1 doublet pour la molécule H2Atome H: n
l = 1 nnl = 0 chaque atome d"hydrogène réalise un doublet liant et ne possède pas de doublet non liant.Schéma de Lewis:
H H H H
Chaque atome d"hydrogène est entouré d"un doublet d"électrons et satisfait donc à la règle du duet. b) Dichlore Cl 2: n t = 7 + 7 = 14 donc nd = 14 /2 = 7 doublets pour la molécule Cl2Atome Cl: n
l = 1 nnl = 3 chaque atome de chlore réalise un doublet liant et trois doublets non liants.Schéma de Lewis:
Cl Cl Cl Cl Chaque atome de chlore est entouré de quatre doublets d"électrons et satisfait donc à la règle de l"octet. c) Chlorure d"hydrogène: HCl.éthanol eau
dioxyde de carboneModèle compact
Modèle éclaté
Seconde - TP Chimie n°6 Eric DAINI - Lycée Paul Cézanne - Aix en Provence - http://labotp.org
nt = 1 + 7 = 8 donc nd = 8 /2 = 4 doublets pour la molécule HClAtome H: n
l = 1 nnl = 0Atome Cl: n
l = 1 nnl = 3Schéma de Lewis:
H Cl H Cl L"atome H vérifie vérifie la règle du duet et l"atome Cl vérifie la règle de l"octet. d) Eau H 2O n t = 2 ´ 1 + 6 = 8 donc nd = 8 /2 = 4 doublets pour la molécule H2OAtome H: n
l = 1 nnl = 0Atome O: n
l = 2 nnl = 2Schéma de Lewis:
H O H H O HAmmoniac NH
3 n t = 5 + 3 ´ 1 = 8 donc nd = 8 /2 = 4 doublets pour la molécule NH3Atome H: n
l = 1 nnl = 0Atome N: n
l = 3 nnl = 1Schéma de Lewis:
H N H H N H H H e) Dioxygène O 2 : n t = 6 + 6 = 12 donc nd = 12 /2 = 6 doublets pour la molécule O2Atome O: n
l = 2 nnl = 2Schéma de Lewis:
O O O O Chaque atome d"oxygène est entouré de deux doublets liants et deux doublets non liants donc la règle de l"octet est satisfaite.Diazote N
2 : n t = 7 + 7 = 14 donc nd = 14 /2 = 7 doublets pour la molécule N2Atome N: n
l = 3 nnl = 1Schéma de Lewis:
N N N N Chaque atome d"azote est entouré de trois doublets liants et un doublet non liant donc la règle de l"octet est satisfaiteDihydrogène Chlorure d"hydrogène Eau
Ammoniac
Dioxygène
Diazote Dichlore
Seconde - TP Chimie n°6 Eric DAINI - Lycée Paul Cézanne - Aix en Provence - http://labotp.org
2) Molécules contenant l"élément carbone
a) Méthane CH 4: n t = 4 + 4 ´ 1 = 8 donc nd = 8 /2 = 4 doublets pour la molécule CH4Atome H: n
l = 1 nnl = 0Atome C: n
l = 4 nnl = 0Schéma de Lewis:
H H H C H H C H H HL"atome de carbone établit 4 liaisons covalentes simples et satisfait à la règle de l"octet.
b) Ethylène C 2H4: n t = 2 ´ 4 + 4 ´ 1 = 12 donc nd = 12 /2 = 6 doublets pour la molécule C2H6Atome H: n
l = 1 nnl = 0Atome C: n
l = 4 nnl = 0Schéma de Lewis:
H H H H H C C H H C C H Chaque atome de carbone établit deux liaisons simples et une liaison double: donc4 doublets. Il satisfait à la règle de l"octet.
c) Dioxyde de carbone CO 2: n t = 4 + 2 ´ 6 = 16 donc nd = 16 /2 = 8 doublets pour la molécule CO2Atome O: n
l = 2 nnl = 2Atome C: n
l = 4 nnl = 0Schéma de Lewis:
O C O O C O
L"atome de carbone établit 2 liaisons covalentes doubles, donc 4 doublets. Il satisfait à la règle de l"octet. d) Acide cyanhydrique HCN: n t = 1 + 4 + 5 = 10 donc nd = 10 /2 = 5 doublets pour la molécule HCNAtome H: n
l = 1 nnl = 0Atome C: n
l = 4 nnl = 0Atome N: n
l = 3 nnl = 1Schéma de Lewis:
H C N H C N
L"atome de carbone établit 1 liaison covalente triple et une liaison simple: donc 4 doublets. Il satisfait à la règle de l"octet.Seconde - TP Chimie n°6 Eric DAINI - Lycée Paul Cézanne - Aix en Provence - http://labotp.org
III ETUDES DE QUELQUES MOLECULES ORGANIQUES
a) Le méthanal: CH 2O n t = 4 + 2 ´ 1 + 6 = 12 donc nd = 12 /2 = 6 doublets pour la molécule CH2OAtome H: n
l = 1 nnl = 0Atome C: n
l = 4 nnl = 0Atome O: n
l = 2 nnl = 2Schéma de Lewis:
HH C O
b) La méthylamine: CH 5N n t = 4 + 5 ´ 1 + 5 = 14 donc nd = 14 /2 = 7 doublets pour la molécule CH5NAtome H: n
l = 1 nnl = 0Atome C: n
l = 4 nnl = 0Atome N: n
l = 3 nnl = 1Schéma de Lewis:
HH C N H
H H
c) Le méthanol: CH 4O n t = 4 + 4 ´ 1 + 6 = 14 donc nd = 14 /2 = 7 doublets pour la molécule CH4OAtome H: n
l = 1 nnl = 0Atome C: n
l = 4 nnl = 0Atome O: n
l = 2 nnl = 2Schéma de Lewis:
HH C O H
H d) Perchlo: C 2Cl4 n t = 2 ´4 + 4 ´ 7 = 36 donc nd = 36 /2 = 18 doublets pour la molécule C2Cl4Atome Cl: n
l = 1 nnl = 3Atome C: n
l = 4 nnl = 0Schéma de Lewis:
Cl Cl
Cl C C Cl
e) Phosgène: COCl 2 n t = 4 + 6 + 2 ´ 7 = 24 donc nd = 24 /2 = 12 doublets pour la molécule COCl2Atome Cl: n
l = 1 nnl = 3Atome C: n
l = 4 nnl = 0Atome O: n
quotesdbs_dbs30.pdfusesText_36[PDF] co2
[PDF] quel quelle qu elle pdf
[PDF] exercices quel quelle quelle cm2 ? imprimer
[PDF] quel est lintérêt de lhistoire
[PDF] pourquoi avons nous interet a etudier l'histoire
[PDF] pourquoi avons nous intérêt ? étudier l histoire
[PDF] using their arms
[PDF] pourquoi étudie t on l'histoire
[PDF] legs
[PDF] pourquoi étudier l'histoire
[PDF] hands and feet.
[PDF] mathématiques tout-en-un pour la licence - niveau l1 pdf
[PDF] quelle est l'importance de l'histoire
[PDF] schéma de latome de chlore
