La coordinence d'un atome central dans une molécule ou un cristal est le nombre d'atomes, molécules ou ions voisins les plus proches dans les trois directions de l'espace et reliés à cet atome central. Elle s'appelle aussi le nombre de... Wikipédia
[PDF] francais professionnelle cours
[PDF] diderot dénonce l esclavage
[PDF] correction des exercices du manuel scolaire tunisi
[PDF] livre math 1ere année secondaire tunisie pdf
[PDF] exercice courrier administratif
[PDF] note administrative exemple corrigé
[PDF] depannage pc pdf
[PDF] seigneurie au moyen age
[PDF] définition seigneurie
[PDF] formule brute de l'indigo
[PDF] les bonhommes allumettes jacques martel
[PDF] comment lire un sismogramme
[PDF] logique mathématique 2eme informatique
[PDF] question tags exercices
[PDF] sujet de dissertation sur la civilisation
[PDF] diderot dénonce l esclavage
[PDF] correction des exercices du manuel scolaire tunisi
[PDF] livre math 1ere année secondaire tunisie pdf
[PDF] exercice courrier administratif
[PDF] note administrative exemple corrigé
[PDF] depannage pc pdf
[PDF] seigneurie au moyen age
[PDF] définition seigneurie
[PDF] formule brute de l'indigo
[PDF] les bonhommes allumettes jacques martel
[PDF] comment lire un sismogramme
[PDF] logique mathématique 2eme informatique
[PDF] question tags exercices
[PDF] sujet de dissertation sur la civilisation

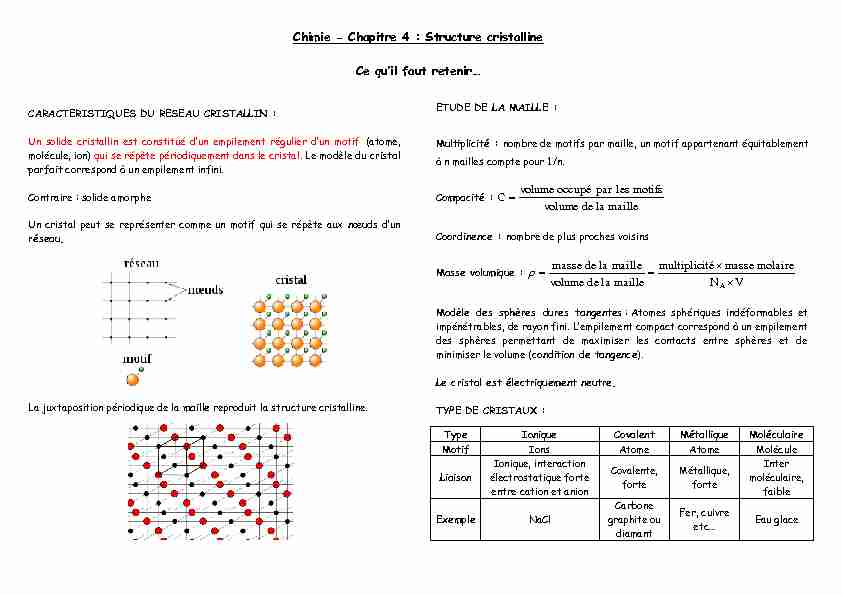
Chimie - Chapitre 4 : Structure cristalline
CARACTERISTIQUES DU RESEAU CRISTALLIN :
(atome, molécule, ion) qui se répète périodiquement dans le cristal. Le modèle du cristal parfait correspond à un empilement infini.Contraire : solide amorphe
Un cristal peut se représenter comme un motif qui se répète aux réseau. La juxtaposition périodique de la maille reproduit la structure cristalline.ETUDE DE LA MAILLE :
Multiplicité : nombre de motifs par maille, un motif appartenant équitablementà n mailles compte pour 1/n.
Compacité :
mailleladevolume motifslesparoccupévolumeCCoordinence : nombre de plus proches voisins
Masse volumique :
VN molairemassetémultiplici mailleladevolume maillelademasse A u U Modèle des sphères dures tangentes : Atomes sphériques indéformables et impénétrables, de rayon fini. des sphères permettant de maximiser les contacts entre sphères et de minimiser le volume (condition de tangence).Le cristal est électriquement neutre.
TYPE DE CRISTAUX :
Type Ionique Covalent Métallique MoléculaireMotif Ions Atome Atome Molécule
Liaison
Ionique, interaction
électrostatique forte
entre cation et anionCovalente,
forteMétallique,
forte Inter moléculaire, faibleExemple NaCl
Carbone
graphite ou diamantFer, cuivre
Eau glace
SITES :
Un assemblage, même compact, ne peut : C < 1 et laisse donc apparaître des zones non occupées par les atomes : les sites interstitiels.
Exemples : Site octaédrique : Site tétraédrique : Chapitre 5 :Systèmes cristallins
Chapitre 5 :Systèmes cristallins