circulent de la demi pile à l’aluminium vers la demi pile au nickel et les anions en sens inverse Exercice n°2 1) Les électrons circulent dans le sens contraire du courant électrique
| Previous PDF | Next PDF |
 [PDF] Piles et électrolyses - Studyrama
[PDF] Piles et électrolyses - Studyrama
Fiche Corrigés Thème : Piles et Exercice n°1 1) fig 2 5 2) Fiche Corrigés 5 ) Dans une pile, l'anode s'enrichit en électrons, ici par la réaction Al(s) = Al3+
 [PDF] Piles et électrolyses - Studyrama
[PDF] Piles et électrolyses - Studyrama
Exercice n°1 (aq) + 2 Al(s) peut rendre compte de la transformation de la pile On réalise simultanément l'électrolyse d'une solution de bromure de cuivre (II)
 [PDF] DS no8 Piles, accumulateurs & électrolyse Exercice 1 – La pile sous
[PDF] DS no8 Piles, accumulateurs & électrolyse Exercice 1 – La pile sous
cherchent encore) `a fabriquer des piles de plus en plus performantes On se propose dans cet exercice d'étudier quelques ca- Corrigé du DS no8 Piles
 [PDF] Oxydoréduction – corrigé des exercices Table des - WordPresscom
[PDF] Oxydoréduction – corrigé des exercices Table des - WordPresscom
En effet, pour que la pile fonctionne, il faut des ions dans le pont salin, donc dans le bouchon Seul le vinaigre contient des ions en solution, puisqu'il s'agit d'acide
 [PDF] Electrochimie Exercice n° 1 :
[PDF] Electrochimie Exercice n° 1 :
On réalise la pile Daniell en utilisant : - un bécher renfermant 100cm3 d'une solution molaire de sulfate de cuivre dans laquelle plonge une plaque de cuivre ; un
 [PDF] EXERCICE IV
[PDF] EXERCICE IV
I-7- Calculer les quantités des produits de l'électrolyse au bout d'une heure I-8- Quelle a été l'intensité moyenne du courant pendant l'heure qu'a duré l'
 [PDF] Épreuve de Chimie Chimie Premier exercice - SSCC SIOUFI
[PDF] Épreuve de Chimie Chimie Premier exercice - SSCC SIOUFI
Deuxième exercice : Réalisation de la pile Magnésium - Chrome (8 points) Le schéma ci-dessous représente le montage expérimental de l'électrolyse de l'eau Chimie Corrigé Barème Premier exercice : Liaisons chimiques (6 points) 1
 [PDF] Cours
[PDF] Cours
La pile Daniell est schématiquement constituée de deux Courant d'électrolyse Kadri, M Chater A Cours et exercices corrigés de chimie générale à
 [PDF] CORRIGE
[PDF] CORRIGE
25 mar 2016 · Partie I-‐ Les piles à combustibles à oxyde solide Le principe de la pile à combustible consiste à utiliser du dihydrogène pour stocker et
 pdf Thème : Piles et électrolyses Fiche 4 : Piles et électrolyses
pdf Thème : Piles et électrolyses Fiche 4 : Piles et électrolyses
circulent de la demi pile à l’aluminium vers la demi pile au nickel et les anions en sens inverse Exercice n°2 1) Les électrons circulent dans le sens contraire du courant électrique
 Thème : Piles et électrolyses Fiche 4 : Piles et électrolyses
Thème : Piles et électrolyses Fiche 4 : Piles et électrolyses
Déterminer le sens du courant électrique et le sens de déplacement des porteurs de charge dans la pile et hors de la pile Exercice n°2 On réalise une pile avec les couples Au 3+
 Correction Conversiond’énergie: pilesetélectrolyses
Correction Conversiond’énergie: pilesetélectrolyses
Correction TD 24 : Conversion d’énergie : piles et électrolyses Blaise Pascal PT 2021-2022 Exercice2:Pileargent-zinc 1 2 Structureetfonctionnementd’unepile; Capacité 1 Laf é m delapileestladifférenceentrelespotentielsredoxdesdeuxélectrodesquisontdonnésparlaloide Nernst Pourl’électroded’argent E Ag = E Ag+/Ag + 006logc= 076V
[PDF] exercices corrigés pourcentages 5ème
[PDF] exercices corrigés pourcentages 6ème
[PDF] exercices corrigés probabilités lois usuelles
[PDF] exercices corrigés produit de convolution
[PDF] exercices corrigés programmation assembleur 8086
[PDF] exercices corrigés programmation en c pdf
[PDF] exercices corrigés reaction chimique pdf
[PDF] exercices corrigés recherche opérationnelle
[PDF] exercices corrigés relation binaire pdf
[PDF] exercices corrigés relation fondamentale de la dynamique
[PDF] exercices corrigés repère dans le plan 3ème pdf
[PDF] exercices corrigés rmn terminale s
[PDF] exercices corrigés second degré 1ère s
[PDF] exercices corrigés second principe thermodynamique
En partenariat avec :
Fiche téléchargée sur www.studyrama.com
LE TALENT C'EST D'AVOIR ENVIE
CHIMIESérie SNº : 37004
Fiche Corrigés
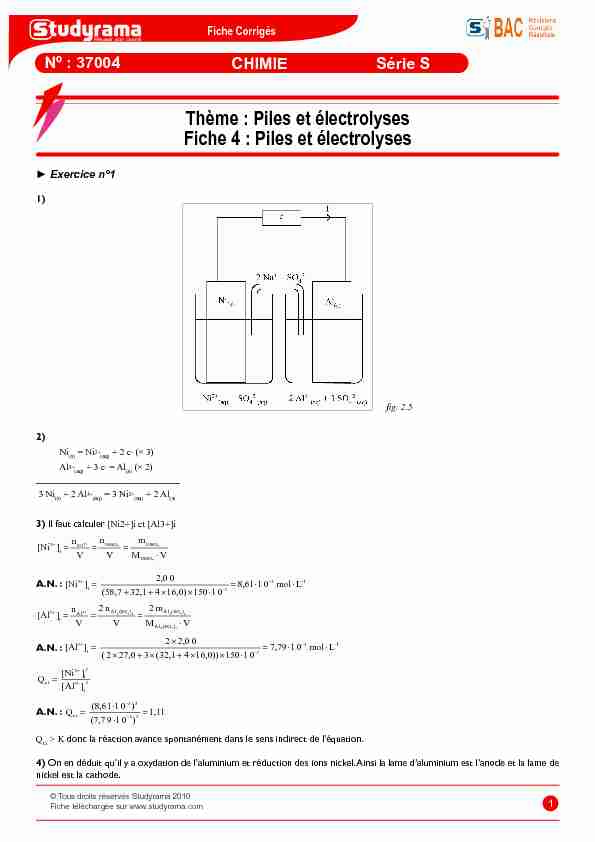
1) 2) Ni (s) = Ni2+(aq)
+ 2 e (× 3) Al3+(aq)
+ 3 e = Al (s) (× 2) __________________________ 3 Ni (s) + 2 Al3+(aq)
= 3 Ni2+(aq)
+ 2 Al (s) 3)Il faut calculer [Ni2+]i et [Al3+]i
A.N. :
12 3 - i2Lmol 0 18,610 115016,0) 432,1(58,70 0,2 ][Ni
VMm 2 Vn 2Vn ][Al
3423423423
)(SOlA )(SOlA )(SOlA lA i3A.N. :
12 3 - i3 Lmol 0 17,790 115016,0)) 432,1(327,02 (0 0,22 ][Al 2 i33 i2 ir, ][Al][Ni QA.N. : 1,11)0 19 7,7()0 11 6,8( Q
2232ir, Q donc la réaction avance spontanément dans le sens indirect de l'équation. 4)
On en déduit qu'il y a oxydation de l'aluminium et réduction des ions nickel. Ainsi la lame d'aluminium est l'anode et la lame de
nickel est la cathode. 2En partenariat avec :
Fiche téléchargée sur www.studyrama.com
LE TALENT C'EST D'AVOIR ENVIE
CHIMIESérie SNº : 37004
Fiche Corrigés
5) Dans une pile, l'anode s'enrichit en électrons, ici par la réaction Al (s) = Al3+(aq)
+ 3 e , donc il s'agit de la borne -. La cathode s'appauvrit en électrons, ici par la réaction Ni2+(aq)
+ 2 e = Ni (s) , donc il s'agit de la borne +. 6)Hors de la pile, le courant électrique circule de la borne + vers la borne -, donc de la demi pile au nickel vers la demi pile à
l'aluminium. Les électrons circulent en sens inverse : de la demi pile à l'aluminium vers la demi pile au nickel. Dans la pile, les cations
circulent de la demi pile à l'aluminium vers la demi pile au nickel et les anions en sens inverse.
1)Les électrons circulent dans le sens contraire du courant électrique, donc de la demi pile au cuivre vers la demi pile à l'or. Dans
la pile les anions vont de la demi pile à l'or vers la demi pile au cuivre et les cations dans l'autre sens.
2)Les électrons arrivent sur l'électrode d'or, ils y sont donc transformés, il y a réduction :
Au3+(aq)
+ 3 e = Au (s) Les électrons sont libérés sur l'électrode de cuivre, donc il y a oxydation : Cu (s) = Cu2+(aq)
+ 2 e L'équation de fonctionnement de la pile dans le sens direct est : 3 Cu (s) + 2 Au3+(aq)
= 3 Cu2+(aq)
+ 2 Au (s) L'anode est l'électrode de cuivre et la cathode est l'électrode d'or. 3) 2 i33 i2 ir, ][Au][Cu QA.N. :
2- 2131ir,