 pH-métrie
pH-métrie
principalement utilisée en pH-métrie Son principe de fonctionnement repose sur la différence de concentration en ions oxonium (H 3 O+) existant de part et d'autre d'une membrane de verre très fine (environ 0,1 mm), qui génère un potentiel électrique, appelé potentiel de membrane Celui-ci est
 Déterminer la composition d’un système
Déterminer la composition d’un système
III 2 2 Par pH-métrie Principe et mise en œuvre Si la réaction support du titrage met en jeu des espèces acides et basiques, on peut observer des variations de pH dans le milieu En utilisant une électrode qui mesure le pH on peut tracer la représentation de ces variations en fonction du volume de réactif titrant ajouté
 Principe des dosages en Terminale S - LeWebPédagogique
Principe des dosages en Terminale S - LeWebPédagogique
deux méthodes en terminale : la pH-métrie et la conductimétrie Méthode pH-métrique Cette méthode s'utilise dans le cas où la réaction support du titrage est une réaction acido-basique (réaction avec échange de protons) Dans ces conditions, la mesure du pH en fonction du volume de solution titrante est de la forme : 0 2 4 6 8 10 12
 Dosage dun acide fort par une base forte
Dosage dun acide fort par une base forte
pH-métrie : on suit l’évolution du pH au cours de la réaction colorimétrie : on utilise un indicateur coloré Exemples d’indicateurs colorés : Indicateur Teinte Zone de virage Teinte Hélianthine Rouge 3,1 - 4,4 Jaune Bleu de bromothymol Jaune 6,0 - 7,6 Bleu Phénol-phtaléine Incolore 8,2 - 10,0 Rose
 Chapitre 16 CONTRÔLE DE LA QUALITÉ PAR DOSAGE Activité 2
Chapitre 16 CONTRÔLE DE LA QUALITÉ PAR DOSAGE Activité 2
Titrage par pH-métrie Doc 3 Un titrage par pH-métrie peut être envisagé lorsque la réaction de titrage est une réaction acido-basique On peut suivre le titrage à l'aide d'un pH-mètre On trace le graphe du pH du mélange des solutions en fonction du volume de la solution titrante versée La brusque variation du pH permet de repérer
 INSTRUMENTATION & PIPETAGE
INSTRUMENTATION & PIPETAGE
Matériel : pH-mètre, électrodes, solutions étalons Supports : › Guide pH (remis aux stagiaires) › Support écrit des présentations › Principe et fonctionnement d’une électrode de pH › Grands principes de la mesure du pH › Paramètres influençant la mesure du pH › Bonnes pratiques de calibrage › Structure d’une
 Analyse Chimique & Physique-SM-S3
Analyse Chimique & Physique-SM-S3
Elle est principalement utilisée en pH-métrie Son principe de fonctionnement repose sur la différence de concentration en ions hydroniums (H3O+) existant de part et d'autre de la membrane de verre, qui génère un potentiel électrique, appelé potentiel de membrane Celui-ci est proportionnel au pH de la solution aqueuse dans
 Contrôle de qualité par dosage
Contrôle de qualité par dosage
Principe Soit la réaction avec les coefficients Titrage par pH-métrie Le volume équivalent est repéré par pH E V (mL) Title: Cours - controle qualité
 capes/agrégation physique/chimie - Dunod
capes/agrégation physique/chimie - Dunod
2 6 Hydrolyse du chlorure de tertiobutyle suivie par pH-métrie : influence de la température et énergie d’activation 41 2 7 Exemple d’une catalyse homogène : l’estérification 46 3 Questions autour des expériences 48 4 Réponses aux questions 49 3 Aspects thermodynamiques de la transformation chimique 54 1 Concepts théoriques 55
 Spé CHIMIE TP C7 : Titrage direct et indirect de l’aspirine
Spé CHIMIE TP C7 : Titrage direct et indirect de l’aspirine
a Principe du titrage Après avoir écrasé et dissous un comprimé d'aspirine dans de l'eau distillée, on va titrer un extrait de la solution obtenue par une solution d'hydroxyde de sodium de concentration connue Le dosage est suivi par pH-métrie La masse d'aspirine contenue dans le comprimé est déduite de ce titrage b
[PDF] ph suc intestinal
[PDF] Ph-Ch Masse de Cuivre dans une pièce
[PDF] phaedra act 2 scene 5
[PDF] phaedra jean racine full text
[PDF] phagocytes
[PDF] phagocytose
[PDF] phalène bouleau sélection naturelle
[PDF] phalène du bouleau animation
[PDF] phalène du bouleau exercice
[PDF] phalène du bouleau mutation
[PDF] phalène du bouleau svt seconde
[PDF] phalène du bouleau svt ts
[PDF] phalène du sureau
[PDF] phalène papillon de nuit
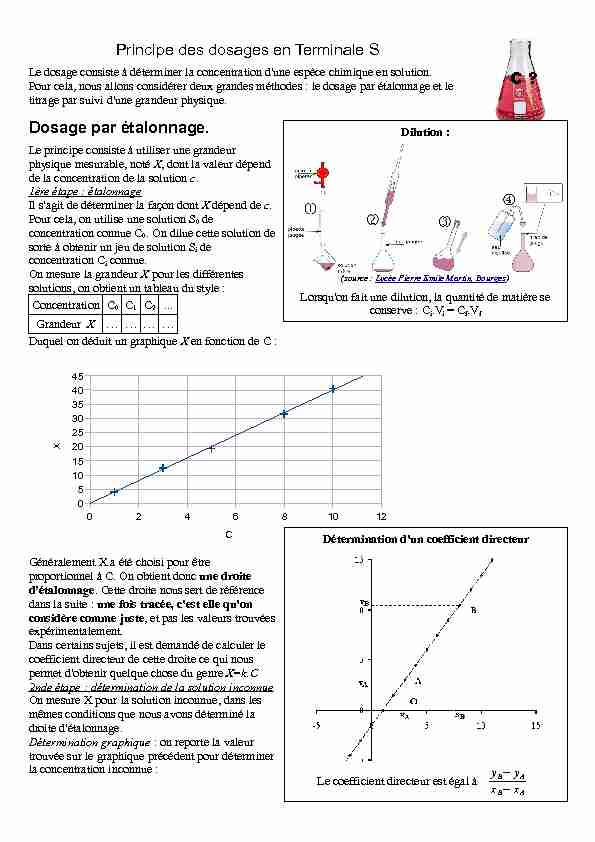
Principe des dosages en Terminale S
Le dosage consiste à déterminer la concentration d'une espèce chimique en solution. Pour cela, nous allons considérer deux grandes méthodes : le dosage par étalonnage et le titrage par suivi d'une grandeur physique.Dosage par étalonnage.
Le principe consiste à utiliser une grandeur
physique mesurable, noté X, dont la valeur dépend de la concentration de la solution c.1ère étape : étalonnage
Il s'agit de déterminer la façon dont X dépend de c.Pour cela, on utilise une solution S0 de
concentration connue C0. On dilue cette solution de sorte à obtenir un jeu de solution Si de concentration Ci connue.On mesure la grandeur X pour les différentes
solutions, on obtient un tableau du style :ConcentrationC0C1C2...
Grandeur X............
Duquel on déduit un graphique X en fonction de C : Généralement X a été choisi pour être proportionnel à C. On obtient donc une droite d'étalonnage. Cette droite nous sert de référence dans la suite : une fois tracée, c'est elle qu'on considère comme juste, et pas les valeurs trouvées expérimentalement. Dans certains sujets, il est demandé de calculer le coefficient directeur de cette droite ce qui nous permet d'obtenir quelque chose du genre X=k.C2nde étape : détermination de la solution inconnue
On mesure X pour la solution inconnue, dans les
mêmes conditions que nous avons déterminé la droite d'étalonnage.Détermination graphique : on reporte la valeur
trouvée sur le graphique précédent pour déterminer la concentration inconnue :024681012051015202530354045 CXC ?Dilution :
(source : Lycée Pierre Emile Martin, Bourges) Lorsqu'on fait une dilution, la quantité de matière se conserve : Ci.Vi = Cf.VfDétermination d'un coefficient directeur
Le coefficient directeur est égal à yB-yA
xB-xAPar le calcul :
Si à l'étape précédente, on a déterminé la valeur de k telle que X=k.C, on détermine C en écrivant C=X/k.
Mise en oeuvre
Type de dosageGrandeur mesuréeCas d'utilisation SpectrophotométriqueAbsorbanceLorsque l'espèce chimique recherchée colore la solutionConductimétriqueConductance ou conductivitéLorsque l'espèce chimique recherchée est un ion
Titrage
Cette fois-ci on utilise une réaction de support du titrage. L'espèce chimique dont on veut déterminer la concentration est appelée espèce à titrer, l'espèce chimique qui réagit avec est l'espèce titrante. La réaction support du titrage est : espèce à titrer + espèce titrante → Produits. Faire un titrage c'est déterminer l'équivalence à savoir le moment où l'on a introduit les réactifs dans les proportions stoechiométriques. Pour cela on étudie deux méthodes en terminale : la pH-métrie et la conductimétrie.Méthode pH-métrique
Cette méthode s'utilise dans le cas où la réaction support du titrage est une réaction acido-basique (réaction avec échange de protons). Dans ces conditions, la mesure du pH en fonction du volume de solution titrante est de la forme :024681012051015202530354045CXValeur mesurée
Concentration inconnue
Titrage :
montage expérimental (source wikipedia) La détermination de l'équivalence se fait alors en utilisant la méthode des tangentes parallèles. Ceci nous permet de déterminer les coordonnées du pointéquivalent (VE, pHE).
Remarque : l'allure de la courbe obtenue nous permet d'expliquer le choix d'un indicateur coloré.Titrage conductimétrique
Cette méthode s'utilise dans le cas où l'espèce chimique à titrer est un ion. On mesure la conductance G ou la
conductivité σ en fonction du volume de solution titrante versé. Pour expliquer la variation de la conductance ou de la conductivité en fonction du volume, il faut s'interroger sur les ions présents en solution durant le titrage. Considérons le titrage des ions chlorures d'une solution de Chlorure de potassium par une solution de nitrate d'argent. La réaction support du titrage est :Ag+(aq) + Cl-(aq) → AgCl(s)
EtatinitialAvant équivalenceÀ
l'équivalenc eAprès l'équivalenceIons présents
en solutionK+ Cl-K+Cl- ↓
NO3- ↑K+
NO3- ↑K+
Ag+ ↑
NO3- ↑
ConductanceG ↓ car NO3-
conduit moins bien que Cl- G ↑ par l'ajout des ions Ag+ et NO3-Détermination de la concentration
Une fois l'équivalence obtenue, on écrit le fait qu'à l'équivalence, la quantité d'espèce chimique titrante
introduite est égale à la quantité d'espèce chimique titrée. Quelque chose comme n0 = nE où n0 est la quantité
d'espèce chimique titrée introduite initialement et nE la quantité d'espèce chimique titrante introduite à
l'équivalence. En exprimant ces grandeurs en fonction des concentrations et des volumes, on obtient quelque
chose du genre : C0.V0=C.VE d'où C0=C.VE/V0.Exemple d'animation présentant un titrage pH-métrique : titrage_ph source : culture Sciences Chimie - eduscolsource : cap concours
Graphe obtenu lors d'un titrage conductimétriquequotesdbs_dbs2.pdfusesText_2