 Projet de programme de sciences physiques en baccalauréat
Projet de programme de sciences physiques en baccalauréat
agiter fortement pour assurer la dissolution de l’acide ascorbique Laisser reposer 30 minutes - Ajuster au trait de jauge On obtient en fait une solution trouble mais l’excipient restant en solution ne perturbe pas le dosage CONSEILS Tracer la courbe pH = f(V) ; V est le volume de soude, afin de vérifier la pertinence des points choisis
 DOSAGE D’UNE SOLUTION D’A IDE AS OR IQUE PAR
DOSAGE D’UNE SOLUTION D’A IDE AS OR IQUE PAR
On neutalise l’acide ascobi ue (NaOH)pa une solution alcaline, l’hydoxyde de sodium ou soude de concentration molaire égale a C B = 0,05 mol L-1 Lors de ce dosage, le volume à l’éuivalence est epéée pa un changement de couleu de l’indicateu coloé (La phénol-phtaléine de l’incoloe au ose pâle) 2- Protocole opératoire
 TP N°6 : DOSAGE EN RETOUR DE LA VITAMINE C
TP N°6 : DOSAGE EN RETOUR DE LA VITAMINE C
Acide phosphorique à 5 ; V=20 mL Empois d’amidon Eau distillée Boîte de comprimés de vitamine C 500 mg Données : La vitamine C, ou acide ascorbique , a pour formule brute C 6H8O6 et sa formule semi-développée est : Elle est présente dans les oranges, les citrons, les fruits et les légumes frais Elle protège du scorbut
 Exercice avec correction: dosage dun comprimé de vitamine C
Exercice avec correction: dosage dun comprimé de vitamine C
Elle sait que la vitamine C est l'acide ascorbique I - Dosage : Delphine décide de procéder à un dosage par une solution de soude (ou hydroxyde de sodium) pour vérifier l'indication de masse de l'acide ascorbique Elle prépare tout d'abord un volume V0=200,0 mL de solution aqueuse avec la totalité du comprimé Soit S la solution obtenue
 L’ACIDE ASCORBIQUE ET SON UTILISATION EN TANT QU ADDITIF DANS
L’ACIDE ASCORBIQUE ET SON UTILISATION EN TANT QU ADDITIF DANS
Parmi ceux-ci, l’acide ascorbique qui est une vitamine (vitamine C) qui a la propriété d’être fortement réductrice Cette molécule agit sur l’oxygène par oxydoréduction grâce à sa fonction ène-diol et se transforme en acide déhydroascorbique (figure 3) qui a la même activité biologique que l’acide ascorbique
 acide ascorbique ascorbate
acide ascorbique ascorbate
Il permettra de déterminer la quantité d’acide ascorbique 2) titrage rédox L’acide ascorbique et l’ascorbate se comportent identiquement du point de vue de l’oxydo-réduction : le dosage rédox permet donc de doser simultanément les deux espèces On les fait réagir avec du diiode en excès connu
 CAPTATION NUMERIQUE AP TS / LES DOSAGES PAR TITRAGE / HLIMOUSIN
CAPTATION NUMERIQUE AP TS / LES DOSAGES PAR TITRAGE / HLIMOUSIN
cas 1 : dosage d’une solution aqueuse d’acide acétique CH 3 COOH par la soude ( hydroxyde de sodium Na+ (aq) + HO-(aq)) cas 2 : dosage d’une solution aqueuse d’acide ascorbique C 6 H 8 O 6 par la soude cas 3 : dosage d’une solution d’ammoniac NH 3(aq) par l’acide chlorhydrique ( H 3 O + (aq) + Cl-(aq)) Pour chacun des trois cas
 Cette épreuve est constituée de trois exercices Elle
Cette épreuve est constituée de trois exercices Elle
Exercice III : Dosage de la vitamine C ou acide ascorbique ( 6,5 points ) La vitamine C ou lacide ascorbique de formule C 6 H 8 O 6 est vendue en pharmacie sous forme de comprimés on cherche à retrouver dans cet exercice les valeurs de la masse m de vitamine C dans un comprimé et du pKa du couple acide/base correspondant
 Dosages par titrage direct 10 Extraits de sujets corrigés du
Dosages par titrage direct 10 Extraits de sujets corrigés du
Masse molaire de l’acide tartrique, noté H 2 A : M(H 2 A) = 150 g mol-1 En présence d’empois d’amidon, le diiode donne à une solution aqueuse une teinte violet foncé Les ions iodure I –, les ions sulfate SO 4 2– et le dioxyde de soufre en solution sont incolores 1 Dosage du dioxyde de soufre dans le vin
[PDF] dosage de l'acide ascorbique par iodométrie
[PDF] densité roche unité
[PDF] densité du granite
[PDF] densite roche
[PDF] densité des roches de la croute continentale
[PDF] densité péridotite
[PDF] propriété de pythagore triangle rectangle
[PDF] distance entre deux points maths
[PDF] comment calculer le rayon de courbure d'une lentille de contact
[PDF] lentille convergente schéma
[PDF] calcul distance epicentre station
[PDF] calcul distance épicentrale
[PDF] localisation de l'épicentre d'un tremblement de terre exercice physique
[PDF] exercice détermination de l'épicentre d'un séisme
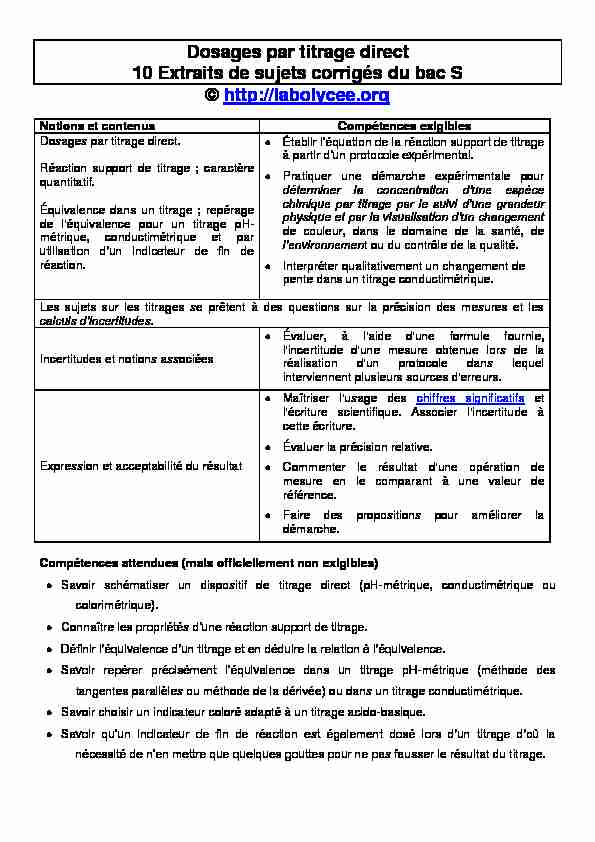
Dosages par titrage direct
10 Extraits de sujets corrigés du bac S
© http://labolycee.org
Notions et contenus Compétences exigibles
Dosages par titrage direct.
Réaction support de titrage ; caractère
quantitatif.Équivalence dans un titrage ; repérage
de l'équivalence pour un titrage pH- métrique, conductimétrique et par réaction.à part
Pratiquer une démarche expérimentale pour de couleur, dans le domaine de la santé, de t ou du contrôle de la qualité.Interpréter qualitativement un changement de
pente dans un titrage conductimétrique. Les sujets sur les titrages se prêtent à des questions sur la précision des mesures et lesIncertitudes et notions associées
Évaluer, à l'aide d'une formule fournie, l'incertitude d'une mesure obtenue lors de la réalisation d'un protocole dans lequel interviennent plusieurs sources d'erreurs.Expression et acceptabilité du résultat
Maîtriser l'usage des chiffres significatifs et l'écriture scientifique. Associer l'incertitude à cette écriture.Évaluer la précision relative.
Commenter le résultat d'une opération de mesure en le comparant à une valeur de référence.Faire des propositions pour améliorer la
démarche. Compétences attendues (mais officiellement non exigibles)Savoir schématiser un dispositif de titrage direct (pH-métrique, conductimétrique ou
colorimétrique).Connaître l
-métrique (méthode des tangentes parallèles ou méthode de la dérivée) ou dans un titrage conductimétrique. Savoir choisir un indicateur coloré adapté à un titrage acido-basique. usser le résultat du titrage. en autonomie, les étapes nécessaires à la par exemple).MÉTHODE :
- (placée dans la burette).- différencier le volume titré (prélèvement) du volume de la solution dont on cherche la
on !)- noter si la solution a été diluée avant le titrage : la concentration trouvée sera donc celle
de la solution fille et il faudra la multiplier par le facteur de dilution pour trouver la concentration
de la solution mère. étape indispensable à la résolution du problème)Mettre des indices aux grandeurs utilisées dans les relations (Vtitré, VE, V1, Vsolution, n(A)titré,
n(B)versé, CA mais pas V, n ou C tout court) Comme toujours, vérifier la cohérence de vos résultats. Les corrigés sont rédigés par les professeurs Ces corrigés sont accessibles gratuitement et sans inscription sur http://labolycee.org Contacts : https://twitter.com/Labolycee ; https://www.facebook.com/labolycee/ ; labolycee@labolycee.org Extrait 1 Bac S Antilles Guyane Session de remplacement 09/2013 http://labolycee.org EXERCICE 2 UN EXEMPLE DE CHIMIE VERTE : LA SYNTHÈSE DE LIBUPROFÈNEACCÈS CORRECTION
Troisième partie
ibuprofène 400 mg » : - on sépare la molécule active des excipients pa - ntenant une solution aqueuse +(aq) + HO(aq)) de concentration molaire apportée cb = 0,20 mol.L-1. Letitrage est suivi par pH-métrie (les courbes obtenues sont tracées dans le document 3 ci-après).
3.1. Réaliser un schéma du mont
3.3. On rentre dans un tableur-grapheur les différentes valeurs du pH mesurées en fonction du
volume Vb tés du tableur- grapheur pour dériver le pH par rapport à Vb, la grandeur obtenue est notée b dpH dV . Les courbes tracées suite au titrage pH-métrique sont pH = f(Vb) et b dpH dV = g(Vb) (document 8).3.3.1. Parmi les courbes 1 et 2, quelle est celle qui représente pH = f(Vb) et celle qui
représente b dpH dV = g(Vb) ? Justifier.3.3.2. Déterminer la valeur du volume équivalent VE par une méthode de votre choix.
COOH. ACCÈS CORRECTION
3.6. Quelles caractéristiques doit posséder une réaction chimique
titrage ? nE(HOi3.10. Déduire des résulta
à la valeur attendue.
3.12. Parmi les indicateurs colorés acido-basiques proposés dans le tableau ci-après, quel est
celui qui est le mieux adapté au titrage précédent ? Justifier. Indicateur coloré Couleur acide Zone de virage Couleur basiqueVert de bromocrésol jaune 3,8 5,4 bleu
Phénolphtaléine incolore 8,2 10 rose
jaune 10,1 12,0 rouge-orangéDonnées :
: M(C13H18O2) = 206 g.mol-1.ACCÈS CORRECTION
Extrait 2 : Bac S 2013 Polynésie http://labolycee.orgEXERCICE I.
ACCÈS CORRECTION
européenne. Celle- tartrique dans le vin.Dans cet exercice,
Les parties 1 et 2 sont indépendantes.
Données :
Masses molaires atomiques :
Élément H C O N S
M (g/mol) 1,00 12,0 16,0 14,0 32,1
2A : M(H2A) = 150 g.mol-1.
foncé. Les ions iodure I, les ions sulfate SO42 et le dioxyde de soufre en solution sont incolores.1. Dosage du dioxyde de soufre dans le vin.
SO2(aq)
diiode aqueux I2(aq). Pour cela, il introduit dans un erlenmeyer, un volume V1 = (20,000,05) mL de vin blanc
également incolore.
La solution titrante, de concentration en diiode C2 = (1,000,01)×102 mol.L-1 est ensuite
E = (6,28
0,05) mL de solution de
diiode. I2(aq) + SO2(aq) + 2H2O(l) 2I(aq) + SO42(aq) + 4H+(aq) ivalence.1.2. Déterminer la concentration molaire C1 en dioxyde de soufre de ce vin et en déduire que sa
concentration massique Cmexp en dioxyde de soufre est égale à 0,201 g.L-1. mexp mexp C dont on admet que, dans les conditions de 222mexpE2 mexp E 2