 combustion prof - formation-energetiquefr
combustion prof - formation-energetiquefr
3 1 Le pouvoir comburivore Il désigne la quantité d’air strictement nécessaire et suffisante qu’il faut fournir pour assurer la combustion neutre de l’unité de combustible Notation : Va Unités : [m3(n) d’air / m3(n) de combustible] [m3(n) d’air / kg(n) de combustible]
 Combustion
Combustion
22 Le pouvoir comburivore Il désigne la quantité d’air strictement nécessaire et suffisante qu’il faut fournir pour assurer la combustion neutre de l’unité de combustible Notation : Va Unités : [m3 (n) d’air / m3 (n) de combustible] 3[m (n) d’air / kg (n) de combustible] [kg (n) 3d’air / m (n) de combustible] [kg (n) d’air
 ADEME Critt Bois - Fibois Mars 2002
ADEME Critt Bois - Fibois Mars 2002
2 5 1 Pouvoir comburivore (combustible solide ou liquide) 14 2 5 2 Pouvoir fumigène (combustible solide ou liquide) 14 3 Les normes françaises ou européennes 14 3 1 - La norme NF M 003-05 14 3 1 1 Principe 15 3 1 2 Appareillage 15 3 1 3 Mode opératoire 16 3 1 4 Expression des résultats 17 3 2 - Les normes européennes 18
 Cours de combustion 2ième partie Combustions réelles
Cours de combustion 2ième partie Combustions réelles
(valorisation chimique du combustible) 1°) Combustion neutre Calcul du pouvoir comburivore d’un combustible complexe Une mole de gaz carbonique consomme une mole d’oxygène pour se former, de même pour SO 2 Pour l’eau, il faut par contre une demi-mole d’oxygène La quantité d’oxygène
 Notions de combustion, de brûleurs et de fours à gaz pour les
Notions de combustion, de brûleurs et de fours à gaz pour les
de 2/0,21 pour 1, soit 9,52 environ De fait, le « pouvoir comburivore » ou « air stœchiométrique » des gaz nat est compris entre 8,9 et 9,7 m3/m3 selon leur type Le propane est un gaz liquéfiable et, dans les conditions courantes d’utilisa-tion, il ne peut pas être considéré comme parfait On préfère donc raisonner en masse
 Exercices d’application sur le chapitre « Diagramme d’Ostwald
Exercices d’application sur le chapitre « Diagramme d’Ostwald
Pouvoir comburivore m / kg de combustible 3 Pouvoir fumigène humide m / kg de combustible 3 Fioul domestique 10,8 10,2 P C I fioul : 41992 kJ / kg Loi des gaz parfaits : PV cste T = 1° question: Déterminer le débit nominal de fioul 2° question: Déterminer le volume d’air nécessaire à la combustion dans les conditions réelles de
 2 Notions sur la combustion - GR-EnAg
2 Notions sur la combustion - GR-EnAg
- de la mesure du débit de combustible - de la connaissance de la nature du combustible - de la richesse masse d’air = masse de combustible - Le lien entre Aet la richesse est évident : ds 1 1 φ = + m n 1 A φφφφ1 mélange riche φ 4
 4 Létude des réseaux gaz - Energétique
4 Létude des réseaux gaz - Energétique
gaz lorsque l‘eau venant du combustible est évacuée sous forme de vapeur Le PCS C‘est la quantité de chaleur produite par 1 m3 gaz, Pouvoir comburivore
[PDF] calcul energie de liaison thermodynamique
[PDF] energie libérée formule
[PDF] formule défaut de masse
[PDF] calcul de l'énergie libérée lors d'une réaction nucléaire
[PDF] masse molaire ethane
[PDF] masse molaire c2h6
[PDF] masse molaire c3h8
[PDF] masse d'un cylindre formule
[PDF] exercice masse volumique 4eme corrigé
[PDF] masse molaire propane
[PDF] masse molaire du dioxygene
[PDF] calculer la masse molaire de l'éthanol
[PDF] acétaldéhyde masse molaire
[PDF] masse molaire methanol
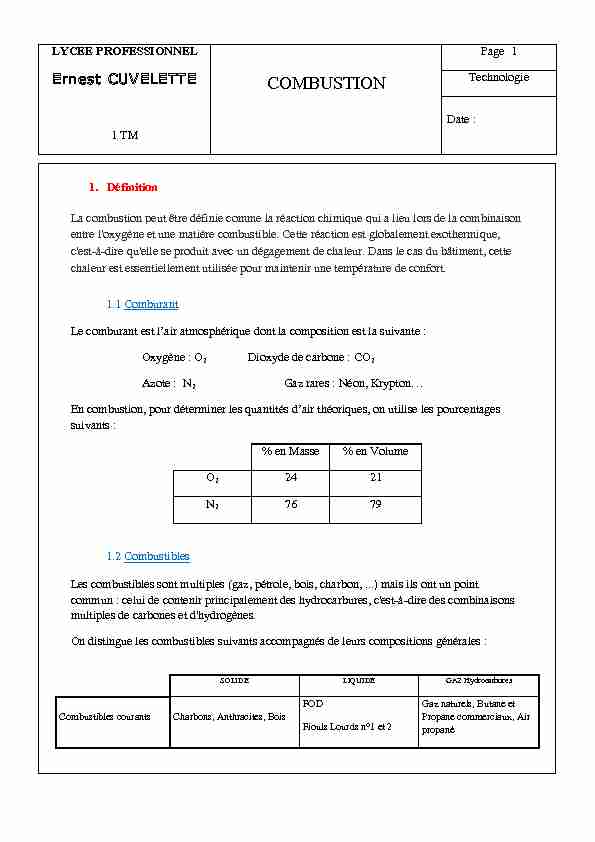
LYCEE PROFESSIONNEL Ernest CUVELETTE 1 TM COMBUSTION Page 1 Technologie Date : 1. Définition La combustion peut être définie comme la réaction chimique qui a lieu lors de la combinaison entre l'oxygène et une matière combustible. Cette réaction est globalement exothermique, c'est-à-dire qu'elle se produit avec un dégagement de chaleur. Dans le cas du bâtiment, cette chaleur est essentiellement utilisée pour maintenir une température de confort. 1.1 Comburant Le comburant est l'air atmosphérique dont la composition est la suivante : Oxygène : O2 Dioxyde de carbone : CO2 Azote : N2 Gaz rares : Néon, Krypton... En combustion, pour déterminer les quantités d'air théoriques, on utilise les pourcentages suivants : % en Masse % en Volume O2 24 21 N2 76 79 1.2 Combustibles Les combustibles sont multiples (gaz, pétrole, bois, charbon, ...) mais ils ont un point commun : celui de contenir principalement des hydrocarbures, c'est-à-dire des combinaisons multiples de carbones et d'hydrogènes. On distingue les combustibles suivants accompagnés de leurs compositions générales : SOLIDE LIQUIDE GAZ Hydrocarbures Combustibles courants Charbons, Anthracites, Bois FOD Fiouls Lourds n°1 et 2 Gaz naturels, Butane et Propane commerciaux, Air propané
LYCEE PROFESSIONNEL Ernest CUVELETTE 1 TM COMBUSTION Page 2 Technologie Date : 2. Physico-chimie de la combustion 2.1 Nombre de moles - Masse Molaire - Volume Molaire : Relations Désignations Unités n : Nombre de moles [mol] m : Masse du corps [g] M : Masse molaire du corps [g/mol] n : Nombre de moles [mol] V : Volume du corps [l] ou [m3] Vm : Volume molaire du corps [l/mol] A 0°C, sous la pression atmosphérique normale de 101325Pa, le volume molaire des gaz est égal à : 2.2 Caractéristiques chimiques des composants : NATURE DU CORPS SYMBOLE CHIMIQUE MASSE MOLAIRE [kg/kmol] OXYGENE O2 32 AZOTE N2 28 HYDROGENE H 1 CARBONE C 12 SOUFRE S 32 GAZ CARBONIQUE CO2 MONOXYDE DE CARBONE CO VAPEUR D'EAU H2O M
m n= m V V n=Vm = 22.4 litres/mol
LYCEE PROFESSIONNEL Ernest CUVELETTE 1 TM COMBUSTION Page 3 Technologie Date : Nous savons que la combustion d'un hydrocarbure (combustible) s'obtient en le faisant réagir avec l'oxygène (comburant). Par commodité et économie, plutôt que d'employer de l'oxygène pur, on utilise l'air qui en contient près de 21%. L'azote contenu dans l'air ne participe pas à la combustion. Carbone + oxygène gaz carbonique Hydrogène + oxygène eau Que l'on écrit chimiquement : C + (O2 +3.76 N2) CO2 + 3.76 N2 H2 + !! (O2 + 3.76 N2) H2O + 1.88 N2 Nous commencerons l'étude détaillée de la combustion des hydrocarbures par celle des gaz naturels, c'est-à-dire de leur principal constituant : le méthane. 3. Combustion neutre du méthane Ecrire, ci-dessous, l'équation bilan de la combustion complète du méthane (CH4). CH4 + 2 (O2 + 3.76 N2) CO2 + 2 H2O + 7.52 N2 3.1 Le pouvoir comburivore Il désigne la quantité d'air strictement nécessaire et suffisante qu'il faut fournir pour assurer la combustion neutre de l'unité de combustible. " Notation : Va " Unités : [m3(n) d'air / m3(n) de combustible] [m3(n) d'air / kg(n) de combustible]
LYCEE PROFESSIONNEL Ernest CUVELETTE 1 TM COMBUSTION Page 4 Technologie Date : " Relation : 2
N 2 OV V Va+=
Pour le méthane : Va = 2 + (2 x 3.76) = 9.52 m3(n) d'air / m3(n) de méthane 3.2 Les Pouvoirs Fumigènes C'est la quantité de fumées qui résulte de la combustion neutre de l'unité de combustible. Il existe deux types de pouvoirs fumigènes : • Le pouvoir fumigène SEC • Le pouvoir fumigène HUMIDE " Notation : Pouvoir fumigène SEC : Vfs Pouvoir fumigène HUMIDE :Vfh " Unités : [m3(n) de fumées (sec ou humide) / m3(n) de combustible] [m3(n) de fumées (sec ou humide) / kg(n) de combustible] Pouvoir Fumigène SEC Pouvoir Fumigène HUMIDE 22
CONV V +=Vfs
O Vfh 222HCON
V V V ++=
Pour le méthane : Vfs = 7.52 + 1 = 8.52 m3(n) de fumées sec / m3(n) de méthane Vfh = 7.52 + 1 + 2 = 10.52 m3(n) de fumées humide / m3(n) de méthane Avec : VO2 = Volume d'oxygène nécessaire VN2 = Volume d'azote
LYCEE PROFESSIONNEL Ernest CUVELETTE 1 TM COMBUSTION Page 5 Technologie Date : 3.3 Les proportions des constituants Elles représentent le rapport entre la quantité du constituant choisi et la quantité totale des fumées, découlant de la combustion neutre de l'unité de combustible. Ayant deux pouvoirs fumigènes, on définira donc, pour chaque constituant, deux pourcentages. Teneur en CO2 dans les fumées: " Notation : γ CO2 " Unité : [%] " Relations : 100
Vfh V ' et 100 Vf V 2 2 2 2 COCO COCO s Teneur en O2 dans les fumées: " Notation : γ O2 " Unité : [%] " Relations : 0 100 Vfh V ' et 0 100 Vfs V 2 2 2 2 OO OODans la combustion neutre il n'y a pas présence d'oxygène dans les fumées ! ! ! ! Pour le méthane : γCO2 = !!.!" x 100 = 11.74 % γ'CO2 = !!".!" x 100 = 9.51 %
LYCEE PROFESSIONNEL Ernest CUVELETTE 1 TM COMBUSTION Page 6 Technologie Date : 4. Combustion réelle. La combustion neutre ou (stoechiométrique) est la base des calculs théorique en combustion. Les résultats d'une combustion réelle, d'un combustible, vont permettre de la définir précisément, par comparaison avec les résultats de la combustion neutre. Ainsi, par rapport à la théorie, on pourra définir : • La combustion en excès d'air, • La combustion en défaut d'air. En pratique, c'est l'analyse des fumées sur site qui donnera les renseignements techniques nécessaires à la définition de la combustion réelle. 4.1 Le facteur d'air Généralement noté n, mais les analyseurs de combustion indiquent λ (lambda). C'est le rapport entre le volume d'air réel (R) qui passe dans le brûleur et le pouvoir comburivore (Va). n = !!" Exemple : Un brûleur au gaz consomme 11.88 m3(n) d'air par m3(n) de gaz. Son pouvoir comburivore est de 9.9 m3(n). Calculer son facteur d'air. n = !!.!!!.! n = 1.2 L'analyseur affichera 1.2 λ.
LYCEE PROFESSIONNEL Ernest CUVELETTE 1 TM COMBUSTION Page 7 Technologie Date : Si le facteur d'air : n = 1 : la combustion est neutre n > 1 : la combustion est en excès d'air n < 1 : la combustion est en défaut d'air. 4.2 Manque d'air Il n'y a pas assez d'air, donc d'oxygène. Que se passe-t-il ? Toutes les molécules de carbone ne sont pas oxydées, et cela entraine la formation d'autres produits, tels que le monoxyde de carbone et la suie. Le monoxyde de carbone (CO) est un gaz toxique (mortel selon la concentration et la durée d'exposition). La suie se dépose sur les surfaces d'échange de la chaudière entrainant son encrassement prématuré. 4.3 Excès d'air Pour éviter la formation de produits dangereux et toxiques, c'est-à-dire que pour être sûr que, dans tous les cas, toutes les particules du combustible soient oxydées, on ajoute une quantité d'air plus grande que nécessaire.
LYCEE PROFESSIONNEL Ernest CUVELETTE 1 TM COMBUSTION Page 8 Technologie Date : VALEURS PRATIQUES CO2 en % O2 en % Excès d'air CO* en ppm Indice de noircissement Gaz naturel 9 à 10 3.4 à 4.5 <10 Propane 12 3 13 <10 Fioul domestique 12 à 13 3.5 à 4.7 <10 0-1 *mesure du CO ambiant
quotesdbs_dbs2.pdfusesText_3