 Le CHLORURE DE SODIUM Comme un composé ionique est
Le CHLORURE DE SODIUM Comme un composé ionique est
Il faut donc trouver le nombre de Na+ et de Cl- dans le grain de sel Il faut trouver la longueur d’un ensemble constitué d’un ion Na+ et Cl- Nombre d’ions Na+ et Cl- Constitution d’un ion Na + Noyau : Na 11 23 Z=11 >>>> 11 protons A=23 >>>> 23-11 = 12 neutrons L’ion est chargé 1+ >>>>> 10 électrons masse d’un ion Na +
 Chapitre 3 : Les ions
Chapitre 3 : Les ions
3- a) Une solution aqueuse de chlorure de fer III, contient des ions chlorure (Cl-) et des ions fer III (Fe3+) 3- b) Sachant que les solutions aqueuses doivent respecter le principe d'électroneutralité, on en déduit qu'il doit y avoir trois fois plus d'ions chlorure que d'ions fer III dans la solution aqueuse de chlorure de fer III
 EXERCICE N°1 - AlloSchool
EXERCICE N°1 - AlloSchool
L’ion de fer III Atome de chlore Ion chlorure EXERCICE N° 6 : Le nombre d’électrons de l’ion de fer II est 24, la charge électrique de son noyau est : Qn=+41,6×10-19C 1) Calculer le nombre d’électrons de l’atome de fer 2) Quelle est la charge électrique des électrons de l’ion de fer en Colomb
 Thème Santé 2 Chapitre 1 : Des atomes aux ions
Thème Santé 2 Chapitre 1 : Des atomes aux ions
d-Combien y a-t-il d'électrons dans l'ion chlorure ? En déduire la charge totale du nuage électronique dans l'ion chlorure 18 électrons donc – 18 e 2nde Chap 1 Des atomes aux ions 3/6 Atome de chlore (Cl) Ion chlorure (Cl-) Gagne 1 électron +17e électron noyau +17e
 ENSEIGNEMENT SCIENTIFIQUE PREMIERE PARTIE 1 UNE LONGUE
ENSEIGNEMENT SCIENTIFIQUE PREMIERE PARTIE 1 UNE LONGUE
Déterminer le nombre de chacune des entités présentes dans la maille en respectant les règles de calcul vues Rayon d’un ion chlorure r(Cl- )= 0,181 nm
 CHIMIE chapitre 1 Atomes molécules ions 2 assp Activité 1
CHIMIE chapitre 1 Atomes molécules ions 2 assp Activité 1
Nom de l’atome Nombre d’e- Modèle de l’atome Nombre d’e- de la couche externe + Nombre électron manquant (nombre de trou) Couleur de la boule la représentant Oxygène 8 6 8-6=2 e 2 trous Carbone Hydrogène Azote Comment représente-t-on les molécules ? Vous allez aider Juliette à répondre à cette question
 3P1C1- Correction des exercices Énoncé disponible en dernière
3P1C1- Correction des exercices Énoncé disponible en dernière
Nombre Nom de protons Nombre Charge d'électrons 18 24 27 Formule Cu2+ Ion chlorure Ion Fer Il Ion cuivre Il 17 26 29 ion hydrogène : 1-1+ B/ - ion brome : Br- ; - ion nickel : Ni2 Ex 5 page 118 A/ Hugo a représenté correctement cet atome, car s'il y a 8 charges positives dans le noyau, il doit y avoir 8 charges négatives autour
 Exercices du chapitre 5 - Plus De Bonnes Notes
Exercices du chapitre 5 - Plus De Bonnes Notes
5- Le chlorure d’aluminium peut réagir avec un ion chlorure pour former un ion tétrachloroaluminate (III) de formule ???? ????4− Donner le schéma de Lewis de l’ion chlorure puis expliquer la formation de l’ion ???? ????4− à partir de chlorure d’aluminium 6- Justifier la géométrie tétraédrique de l’ion
[PDF] atome de chlore composition
[PDF] charge de l'ion chlorure
[PDF] structure électronique de l'ion chlorure
[PDF] ion chlorure cl-
[PDF] composition des atomes
[PDF] nombre de nucléons dans le cuivre
[PDF] nombre de protons dans le chlore
[PDF] atome de cuivre nombre d'électrons
[PDF] charge électrique proton
[PDF] charge électrique d'un noyau
[PDF] force électrique f=qe
[PDF] force de coulomb formule
[PDF] loi de coulomb formule
[PDF] q=n*e
Chapitre 3 : Les ionsNous avons vu lors du chapitre précédent, que le courant électrique dans les solutions aqueuses était dû à
un déplacement de petites particules de la taille d'un atome, chargées électriquement et appelées ion . Le
but de ce chapitre sera d'étudier ces petites particules. I) Qu'est-ce qu'un ion ? Comment interpréter sa formule ?1) Étude de l'ion chlorure :
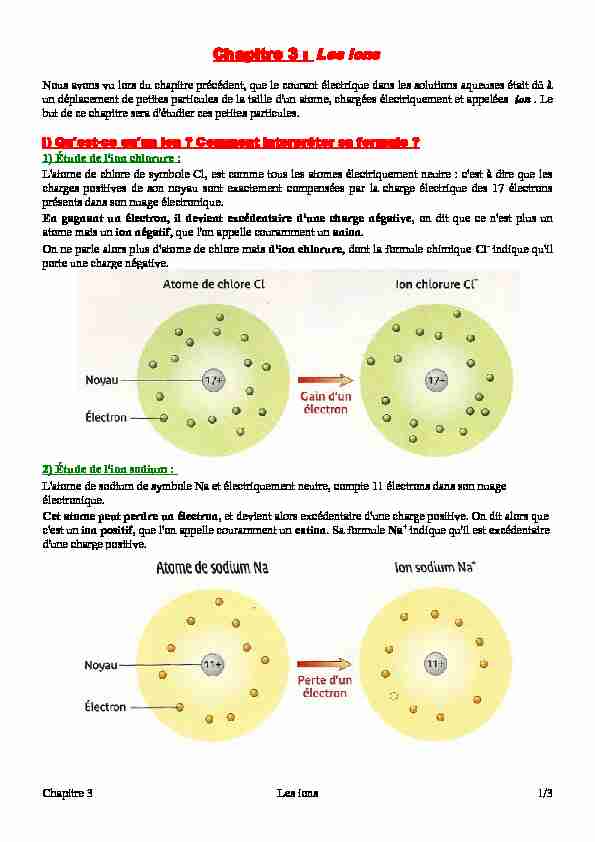
L'atome de chlore de symbole Cl, est comme tous les atomes électriquement neutre : c'est à dire que les
charges positives de son noyau sont exactement compensées par la charge électrique des 17 électrons
présents dans son nuage électronique.En gagnant un électron, il devient excédentaire d'une charge négative, on dit que ce n'est plus un
atome mais un ion négatif, que l'on appelle couramment un anion.On ne parle alors plus d'atome de chlore mais d'ion chlorure, dont la formule chimique Cl- indique qu'il
porte une charge négative.2) Étude de l'ion sodium :
L'atome de sodium de symbole Na et électriquement neutre, compte 11 électrons dans son nuageélectronique.
Cet atome peut perdre un électron, et devient alors excédentaire d'une charge positive. On dit alors que
c'est un ion positif, que l'on appelle couramment un cation. Sa formule Na+ indique qu'il est excédentaire
d'une charge positive.Chapitre 3Les ions1/3
Exemples :
A partir de leurs modèles schématisés ci-dessous, donne la formule chimique des ions cuivre, fer II et fer
fer III. On donne les formules des atomes : atome de cuivre : Cu ; atome de fer : FeL'ion cuivre possède 27 électronsL'ion fer II possède 24 électronsL'ion fer III possède 23 électrons
L'ion cuivre possède 29 charges positives dans son noyau et 27 électrons dans son nuage électronique. Il
est donc excédentaire de 2 charges positives, sa formule est donc Cu2+. L'ion fer II est également excédentaire de deux charges positives, sa formule est Fe2+. L'ion fer III est lui excédentaire de trois charges positives, sa formule est Fe3+.A retenir :
Les atomes et molécules sont électriquement neutres, mais en gagnant un ou plusieurs électrons ils se
chargent négativement et deviennent des ions négatifs ou anions.De même en perdant un ou plusieurs électrons ils se chargent positivement et deviennent alors des ions
positifs ou cations.La formule chimique de l'ion, est constituée du symbole de l'atome dont il dérive suivi en exposant du
nombre de charges positives (+) ou négatives (-) qu'il a en excès.Ainsi l'ion cuivre est un cation qui possède deux charges positives en excès : sa formule est Cu2+.
L'ion chlorure est un anion possédant un électron en excès : sa formule est Cl-.3) Quels sont les ions à connaître ?
Les ions suivants et leurs formules sont a mémoriserNom de
l'ionIon chlorureIon sulfate Ion sodiumIon cuivreIon zincIon fer IIIon fer IIIFormule Cl- SO42-Na+Cu2+Zn2+Fe2+Fe3+
II) Les ions en solutions aqueuses :
1) Ou trouve-t-on des ions ?
Étude du document 1
Réponses aux questions :
1- Pour être stable, la matière doit être neutre. C'est pour cela que les ions n'existent pas seuls dans la
nature. Il s'associent entre eux pour former des solides ioniques neutres.2- On ne peut alors trouver des ions que dans les solutions ioniques, ou les ions sont alors dissout dans un
solvant.3- a) Une solution aqueuse de chlorure de fer III, contient des ions chlorure (Cl-) et des ions fer III (Fe3+).
3- b) Sachant que les solutions aqueuses doivent respecter le principe d'électroneutralité, on en déduit
qu'il doit y avoir trois fois plus d'ions chlorure que d'ions fer III dans la solution aqueuse de chlorure de
fer III.Chapitre 3Les ions2/3
2) Que nous indiquent le nom et la formule d'une solution aqueuse ?
Étude du document 2
Réponses aux questions :
1- Le nom d'une solution aqueuse nous indique les ions présents dans la solution.
2- La formule chimique de la solution, en plus de nous indiquer les ions présents dans la solution, nous
informe sur la proportion des ions présents en solution.3- a) La formule de la solution de chlorure de sodium est (Na+ + Cl-)
3-b) La formule de la solution de sulfate de fer II est (Fe2+ + SO42-)
3-c) La formule de la solution de chlorure de fer III est (Fe3+ + 3Cl-)
III) Comment reconnaître la présence des ions dans les solutions aqueuses ?1) Par leur couleur en solution aqueuse :
Certaines solutions aqueuses ioniques sont colorées. Ce sont les ions qui sont responsables de la coloration des solutions. Ainsi les ions Cu2+ sont bleus en solution aqueuse, et les ions Fe3+ orangés.La couleur de la solution permet donc bien souvent de se faire une bonne idée sur l'ion qu'elle contient.
2) A l'aide de tests caractéristiques :
Voir TP chimie n°2 + le corrigé
Certains tests chimiques permettent de reconnaître la présence de certains ions en solution aqueuse.
Les tests suivants et leurs résultats sont à mémoriser. Une animation pour s'entraîner sur les tests de reconnaissance : cliquer ICI