 Activité enzymatique
Activité enzymatique
[PDF] Activité enzymatique esr cscmonavenir ca C et Activite enzymatique pdf
 3 Cinétique enzymatique - ESI
3 Cinétique enzymatique - ESI
[PDF] Cinétique enzymatique ESI esi umontreal ca ~badiaa cinetique enzyme pdf
 Méthodes de mesure des activités enzymatiques - Remedeorg
Méthodes de mesure des activités enzymatiques - Remedeorg
[PDF] Méthodes de mesure des activités enzymatiques Remede remede librairie e pdf
 étape de l influence de la température sur la catalase ? l aide de l
étape de l influence de la température sur la catalase ? l aide de l
[PDF] étape de l 'influence de la température sur la catalase ? l 'aide de l cdc qc ca actes arc bernard rafei actes ARC pdf
 L ACTIVITE ENZYMATIQUE
L ACTIVITE ENZYMATIQUE
[PDF] L 'ACTIVITE ENZYMATIQUEnadcou cegep rdl qc ca biogen labo laboenzyme pdf
 Activité enzymatique
Activité enzymatique
[PDF] Activité enzymatique esr csdccs edu on ca fiche etude Activite enzymatique pdf
 Action de la Température et du pH sur la Cinétique Enzymatique 1
Action de la Température et du pH sur la Cinétique Enzymatique 1
[PDF] Action de la Température et du pH sur la Cinétique Enzymatique fdanieau free cours bts ActionDeLaTemperatureEtDupH pdf
 tp4 effet de la temperature sur la phosphatase alcaline
tp4 effet de la temperature sur la phosphatase alcaline
[PDF] tp effet de la temperature sur la phosphatase alcalinefdanieau free cours bts A TP TPTempPhosphataseA pdf
 PLAN DE CORRECTION DU TP N° 3 ACTIVITE ENZYMATIQUE ET
PLAN DE CORRECTION DU TP N° 3 ACTIVITE ENZYMATIQUE ET
[PDF] PLAN DE CORRECTION DU T P N° ACTIVITE ENZYMATIQUE ET lycee marc bloch spip ac rouen PLAN DE CORRECTION DU T pdf
 enzyme : substance organique soluble qui catalyse une réaction
enzyme : substance organique soluble qui catalyse une réaction
Les enzymes ne sont plus fonctionnelles lorsque la température devient trop élevée l 'activité de l 'enzyme peut toujours avoir lieu si la structure géométrique n 'a En effet, si le pH change, il entraîne un changement d 'ionisation des acides
[PDF] volume triangle
[PDF] lecon sur les aires 6eme
[PDF] calculer l aire d une figure quelconque cm2
[PDF] exercices aire et périmètre secondaire 1
[PDF] calcul superficie terrain irrégulier
[PDF] calculer l'aire d'une figure quelconque cm2
[PDF] comment calculer le perimetre d'une figure quelconque
[PDF] périmètre aire volume exercices
[PDF] périmètre aire et volume
[PDF] qnh qfe conversion
[PDF] altitude vraie calcul
[PDF] calcul altitude pression
[PDF] mesurer amperage batterie avec multimetre
[PDF] mesurer intensite avec pince amperemetrique
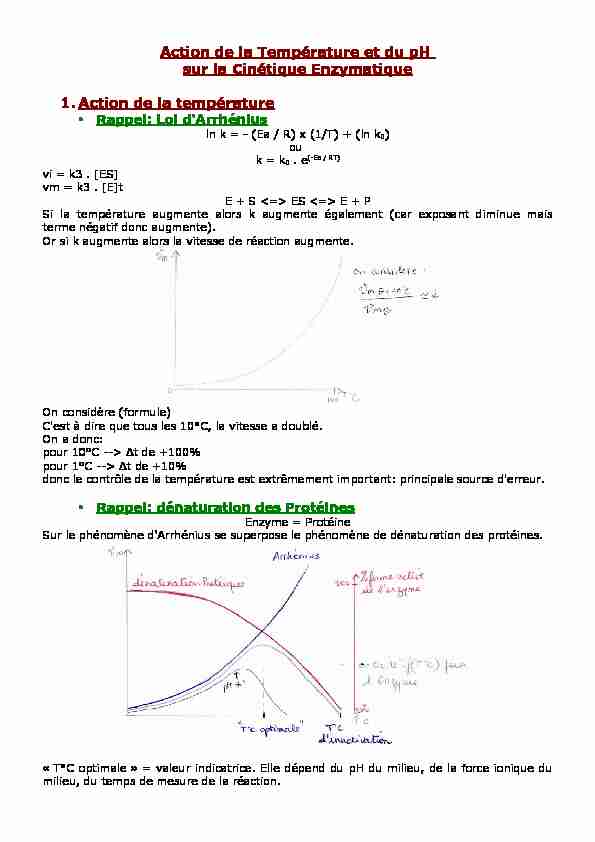
Action de la Température et du pH
sur la Cinétique Enzymatique1.Action de la température
•Rappel: Loi d'Arrhénius ln k = - (Ea / R) x (1/T) + (ln k0) ou k = k0 . e(-Ea / RT) vi = k3 . [ES] vm = k3 . [E]tE + S <=> ES <=> E + P
Si la température augmente alors k augmente également (car exposant diminue mais terme négatif donc augmente). Or si k augmente alors la vitesse de réaction augmente.On considère (formule)
C'est à dire que tous les 10°C, la vitesse a doublé.On a donc:
pour 10°C --> Δt de +100% pour 1°C --> Δt de +10% donc le contrôle de la température est extrêmement important: principale source d'erreur. •Rappel: dénaturation des ProtéinesEnzyme = Protéine
Sur le phénomène d'Arrhénius se superpose le phénomène de dénaturation des protéines.
" T°C optimale » = valeur indicatrice. Elle dépend du pH du milieu, de la force ionique du milieu, du temps de mesure de la réaction. --> mesure de Vm à 60°C, méthode des deux points(30sec d'écart). On note que pour de petites enzymes de 10 à 20KDa, on a des températures optimalesélevées (80 à 100°C). Par contre pour les enzymes à structure complexe de 100 à 500KDa,
on a des températures optimales faibles (40 à 50°C). Certains micro-organisme thermophiles ont des enzymes au températures optimales comprises entre 70 et 90°C. Ceci est d'intérêt industriel notamment pour les industries du génie protéique où l'on recherche des enzymes thermorésistantes.2.Influence du pH sur l'activité
•pH extrêmes --> très acides: dénaturation et précipitation --> très alcalin : dénaturation sans précipitation •Autres pH Le pH agit sur les groupement ionisables des protéines. Notamment des groupements des chaînes latérales -COOH où le pKA ~ 4 pour les Acides aspartique / glutamique.Également sur les groupements amines des chaînes latérales des acides aminés où le pKA
~ 6 pour l'immidazol, l'histidine.Au pH optimum, l'activité est maximale.
Pour la plus part des enzymes, le pH optimal se situe entre 6 et 8, il s'agit du pH optimal qd 2 groupes sont ionisés. Enzyme optimum à pH 2-3 acide: la pepsine; enzyme optimum à pH 10 alcalin: la phosphatase alcaline.Application:
Il faut mesurer Vm à pH optimum.
1Ex: Lactate + NAD+ <=> Pyruvate + NADH + H+
2 pH optimum = 7 R1 --> pH 8 R1 pH 8 diminue [H+] donc favorise le sens 1 R2 --> pH 6 R2 pH 6 augmente [H+] donc favorise le sens 2 Si on inactive l'enzyme vie un réactif d'arrêt alors on s'éloigne du pH otpimum. Les effets du pH peuvent se voir au niveau de l'enzyme: modification de l'ionisation d'ungroupement fonctionnel de l'enzyme; modification de la structure de la protéine;
modification du site de fixation du substrat; modification de la catalyse. Dès qu'il y a une modification de la fixation du substrat sur l'enzyme alors il y a modification du Km car il reflète l'affinité de l'enzyme pour son substrat. L'effet du pH peut également se voir au niveau du substrat: on obtient un substrat ionisable avec un des formes se fixatn sur l'enzyme.