 Détermination de la conductivité : méthode électrométrique
Détermination de la conductivité : méthode électrométrique
La conductivité d'une solution est la mesure de la capacité des ions à transporter le courant électrique. Ce passage du courant électrique s'effectue par la
 Conductivité dune solution
Conductivité dune solution
La conductivité (sous-entendu électrique) d'une solution rend compte de sa capacité à conduire un courant électrique. En chimie on la note souvent σ (sigma)
 Chapitre 4 : Propriétés électriques des solutions
Chapitre 4 : Propriétés électriques des solutions
La présence d'ions dans une solution lui confère des propriétés de conduction électrique. Sa conductivité σ est facteur de la mobilité des ions et la mesure de
 CONDUCTIVITE DES SOLUTIONS 1. Electrolytes et conductivité 1.1
CONDUCTIVITE DES SOLUTIONS 1. Electrolytes et conductivité 1.1
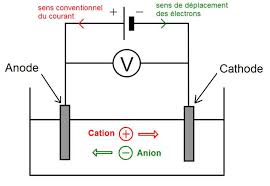
C'est une conductivité de type ionique. Les porteurs de charge sont les ions (anions cations) présents dans la solution. 1.2 Conductance d'une solution. La
 Chapitre 3: SOLUTIONS ELECROLYTIQUES
Chapitre 3: SOLUTIONS ELECROLYTIQUES
où ɣ représente la conductivité (inverse de la résistivité) de la solution. Déterminons ɣi pour un type d'ion i de valence Zi de concentration molaire CI et
 Fiche méthode : Mesurer la conductivité dune solution aqueuse
Fiche méthode : Mesurer la conductivité dune solution aqueuse
Mesure de la conductivité d'une solution : Avant et entre deux mesures réalisées dans des solutions différentes il faut immerger la sonde dans un bécher d'eau.
 Guide des mesures de conductivité
Guide des mesures de conductivité
Les principales applications d'une cellule à 2 pôles sont la mesure de la conductivité de l'eau pure de solutions aqueuses très diluées et de solutions non.
 Chapitre 3 Conductimétrie
Chapitre 3 Conductimétrie
Pour une solution suffisamment diluée (c ≤ 10.10-2 mol/L)
 MA. 303 – pH-con-tur : Détermination du pH de la conductivité et de
MA. 303 – pH-con-tur : Détermination du pH de la conductivité et de
Sep 18 2023 Le pH sert à déterminer la concentration des ions d'hydrogène qui se retrouve dans une solution. Plus communément
 Les solutions
Les solutions
9. CONDUCTIVITE DES ELECTROLYTES. 9.1 Mesure de la résistance d'un électrolyte. La cuve dans laquelle se trouve la solution occupe
 Conductivité Théorie et Pratique
Conductivité Théorie et Pratique
Le thème abordé est la mesure de la conductivité c'est-à-dire la capacité d'une solution à transporter un courant électrique. Des mesures fiables et exactes
 Conductivité dune solution
Conductivité dune solution
La conductivité (sous-entendu électrique) d'une solution rend compte de sa capacité à conduire un courant électrique. En chimie on la note souvent ? (sigma)
 CONDUCTIVITE DES SOLUTIONS 1. Electrolytes et conductivité 1.1
CONDUCTIVITE DES SOLUTIONS 1. Electrolytes et conductivité 1.1
1.1 Définition. Un électrolyte est une solution permettant le passage du courant. C'est une conductivité de type ionique. Les porteurs de charge sont les ions (
 Fiche méthode : Mesurer la conductivité dune solution aqueuse
Fiche méthode : Mesurer la conductivité dune solution aqueuse
Un conductimètre est un appareil électronique permettant de mesurer la conductivité d'une solution c'est-à- dire sa capacité à conduire le courant.
 Détermination de la conductivité : méthode électrométrique
Détermination de la conductivité : méthode électrométrique
La conductivité d'une solution est la mesure de la capacité des ions à transporter le courant électrique. Ce passage du courant électrique s'effectue par la
 Relation entre la concentration en NaCl dune solution et sa
Relation entre la concentration en NaCl dune solution et sa
Cette solution est étiquetée « solution mère ». TP Relation concentration et conductivité dans une solution aqueuse NaCl. Page 1 / 6. Page 2
 INFLUENCE DE LA CONDUCTIVITÉ ÉLECTRIQUE DE LA
INFLUENCE DE LA CONDUCTIVITÉ ÉLECTRIQUE DE LA
INFLUENCE DE LA CONDUCTIVITE ELECTRIQUE DE LA SOLUTION. NUTRITIVE SUR LA CROISSANCE ET LE DEVELOPPEMENT DE LA TOMATE. DE sERRE cuLTrvEE AvEC ou sANS Ecr
 Chapitre 3 Conductimétrie
Chapitre 3 Conductimétrie
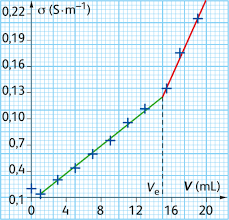
On mesure la valeur de la conductivité de la solution ? pour chaque volume V de solution titrante versée (tous les 1 mL) puis on trace la courbe de dosage ? =
 pH et CONDUCTIVITÉ
pH et CONDUCTIVITÉ
Le pH et la conductivité d'une solution de fontaine sont d'une importance majeure pour l'humidification des plaques. Page 2. QU'EST-CE QUE LE pH ? • Mesure l'
 Conductance et conductivité
Conductance et conductivité
Exercice 1 : La mesure de la conductivité d'une solution de chlorure de potassium + + ? de concentration C.
 [PDF] Conductance et conductivité - AlloSchool
[PDF] Conductance et conductivité - AlloSchool
Exercice 1 : La mesure de la conductivité d'une solution de chlorure de potassium + + ? de concentration C
 [PDF] Conductivité Théorie et Pratique - IGZ Instruments
[PDF] Conductivité Théorie et Pratique - IGZ Instruments
Le thème abordé est la mesure de la conductivité c'est-à-dire la capacité d'une solution à transporter un courant électrique Des mesures fiables et exactes
 [PDF] Conductivité en solution aqueuse
[PDF] Conductivité en solution aqueuse
La conductivité d'une solution est une fonction croissante de la concentration des ions qu'elle contient Considérons un électrolyte fort comme KCl et notons c
 [PDF] Travaux dirigés : Conductance et Conductivité
[PDF] Travaux dirigés : Conductance et Conductivité
3) Exprimer et calculer la conductivité de la solution en unité S I G =?x S/? ;?= ?/S x G = kxG = 075x102x 58x10-3 = 0435 S m-1
 [PDF] Chapitre 3 Conductimétrie
[PDF] Chapitre 3 Conductimétrie
La conductivité d'une solution électrolytique dépend : ? de la nature des ions présents dans la solution ; ? de leurs concentrations ; ? de la
 [PDF] CONDUCTIVITE DES SOLUTIONS 1 Electrolytes et conductivité 11
[PDF] CONDUCTIVITE DES SOLUTIONS 1 Electrolytes et conductivité 11
1 1 Définition Un électrolyte est une solution permettant le passage du courant C'est une conductivité de type ionique Les porteurs de charge sont les ions (
 [PDF] Fiche méthode : Mesurer la conductivité dune solution aqueuse
[PDF] Fiche méthode : Mesurer la conductivité dune solution aqueuse
Un conductimètre est un appareil électronique permettant de mesurer la conductivité d'une solution c'est-à- dire sa capacité à conduire le courant
 [PDF] Conductivité dune solution - mmelzani
[PDF] Conductivité dune solution - mmelzani
La constante de proportionnalité est notée ?o et rend compte du fait que chaque espèce d'ion se déplace plus ou moins facilement dans la solution (cf loi de
 [PDF] solution-de-exercices-de-la-conductance-et-la-conductivitc3a9pdf
[PDF] solution-de-exercices-de-la-conductance-et-la-conductivitc3a9pdf
1 2) La conductivité d'une partie d'une solution électrolytique dépend de la tension appliquée aux électrodes et au courant électrique qui passe dans le
 [PDF] La conductivité des solutions délectrolytes forts et faibles - CPH405
[PDF] La conductivité des solutions délectrolytes forts et faibles - CPH405
Sous sa forme pure l'eau est un très mauvais conducteur mais sa conductivité augmente rapidement lorsqu'on introduit des ions en solution En effet en