|
Cinétique enzymatique Dr SBENSAAD 2ème année pharmacie
III-Modèle de Michaelis-Menten : Hypothèse de l'équilibre : En 1913 Michaelis et Menten ont proposé une théorie générale de l'activité enzymatique dont l'idée |
|
Cinétique enzymatique
La cinétique enzymatique a pour but de déterminer les vitesses des réactions que l'enzyme catalyse et à mesurer son affinité pour les substrats Elle permet d' |
|
CINÉTIQUE ENZYMATIQUE
Dans leur publication MICHAELIS et MENTEN reconnaissaient l'importance des travaux de HENRI : Les expériences de HENRI sont particulièrement importantes parce |
|
Cours dEnzymologie
En 1913 Michaëlis et Menten (M M) ont établi l'équation d'une réaction de vitesse enzymatique qui permet de : - Décrire la cinétique (et donc la vitesse) d'une |
|
ENZYMOLOGIE
Plan Cinétique enzymatique ▫ Calcul de l'équation de Michaélis-Mention ▫ Détermination graphique de Km et Vmax (représentation V en fonction de S |
|
Introduction à la cinétique enzymatique
Nous remarquons que dans le modèle de Michaëlis-Menten l'hypothèse d'équilibre rapide entre les formes libres de l'enzyme du substrat et du complexe est plus |
|
La cinétique enzymatique
Etude de la cinétique Michaelis-Menten Lors d'une réaction enzymatique il y a deux étapes importantes La première est la formation d'un complexe enzyme |
|
LA CINETIQUE ENZYMATIQUE
L'EQUATION DE MICHAELIS MENTEN V REPRESENTATION GRAPHIQUE DE LINE WEAVER ET BURKE VI EXPRESSION DE L'ACTIVITE ENZYMATIQUE |
|
M1 Chimie des biomolécules (2021) Cinétique enzymatique
(C'est la démonstration de l'équation de Michaelis et Menten que l'on trouve dans la plupart des livres ) La constante d'équilibre de dissociation du complexe |
Comment déterminer km et Vmax ?
Elle présente deux points intéressants pour l'étude cinétique : La Vmax (vitesse maximum de réaction) et la KM.
La KM est la concentration en substrat pour laquelle on obtient une vitesse = Vmax/2 .
Elle s'exprime en molarité.
Elle correspond à l'inverse de l'affinité de l'enzyme pour son substrat.Comment vérifier que la cinétique est Michaelienne ?
Un moyen de le constater est de tracer 1 / Vi en fonction de 1 / [S].
Si la cinétique est michaelienne, on doit obtenir une droite.
On a tracé la corbe.
La cinétique est michaelienne, avec Vmax=75 nmol/L /min et Km=2,5.10-5M.Comment calculer la cinétique enzymatique ?
v = k x [S] Dans le cas de l'expérience B, la cinétique est linéaire, v est constante : La réaction est d'ordre zéro : réaction dont la vitesse ne dépend pas de la concentration des réactifs, la vitesse est donc constante.
- Km et activité enzymatique
La constante de Michaelis Km est la concentration en substrat pour laquelle la vitesse initiale de la réaction est à la moitié de la vitesse initiale maximale.
Cette constante est une concentration, elle a la même unité : mol.
|
M1. Chimie des biomolécules (2021) Cinétique enzymatique
loi de vitesse “de Michaelis et Menten” qui dépend de deux param`etres (vm et KM ) et décrit bien comment la vitesse de certaines réactions enzymatiques |
|
LA CINETIQUE ENZYMATIQUE
INTRODUCTION. II. LA VITESSE D'UNE REACTION ENZYMATIQUE. III. LA CONSTANTE DE MICHAELIS MENTEN. IV. L'EQUATION DE |
|
Enzymologie fondamentale
Chapitre 3 : Cinétique enzymatique à un seul substrat et inhibition L'équation de Michaelis-Menten est une expression mathématique décrivant les ... |
|
Untitled
cinétique enzymatique la deuxième développe la synthèse organique de deux molécules bioactives |
|
CINETIQUE ET ELECTROCINETIQUE DE LABSORPTION DU 2.4
ter prétations cinétiques l'une par la théorie enzymatique classiq de Michaelis-Menten 6 et l'autre par le récent formalisme élec-. |
|
Cinétique enzymatique à un seul substrat (Partie 1) CINETIQUE
-Dans le modèle de Michaelis Menten : La Kcat est une mesure de l'activité catalytique maximale de l'enzyme et de ce fait elle représente l'efficacité. |
|
Introduction à la cinétique enzymatique
Nous remarquons que dans le modèle de Michaëlis-Menten l'hypothèse d'équilibre rapide entre les formes libres de l'enzyme du substrat et du complexe est plus |
|
ENZYMOLOGIE
Cinétique enzymatique. ? Calcul de l'équation de Michaélis-Mention. ? Détermination graphique de Km et Vmax. (représentation V en fonction de S selon |
|
Le corrigé
cinétique d'une réaction. Modélisation de l'oxydation du glucose par le modèle de Michaelis-Menten. À 20 °C et en solution à pH tamponné égal à 7 |
|
Michaelis-Menten (steady-state) Kinetics The Michaelis-Menten
The Michaelis-Menten model for enzyme kinetics presumes a simple 2-step reaction: Step 1: Binding – the substrate binds to the enzyme Step 2: Catalysis – the substrate is converted to product and released (Note that enzymes not matching this reaction scheme may still show similar kinetics ) The Michaelis-Menten equation shows how the |
|
Henri Michaelis Menten et la cinetique enzymatique
Henri Michaelis Menten et la cinétique enzymatique 1 Introduction La plupart des réactions chimiques qui se déroulent dans le monde vivant en particulier dans les cellules sont catalysées par des enzymes Nous vous proposons d’explorer un modèle simple de cinétique enzymatique étudié pour la première fois par Victor Henri |
|
La cinétique enzymatique
La cinétique est l’étude des vitesses des réactions chimiques La cinétique enzymatique a pour but de déterminer les vitesses des réactions que l’enzyme catalyse et à mesurer son affinité pour les substrats Elle permet d'identifier et de décrire les mécanises des réactions biologiques |
Qu'est-ce que les enzymes michaeliennes ?
1. Les enzymes michaeliennes Les enzymes sont des catalyseurs biologiques, c’est-à-dire des molécules capables d’accélérer des réactions chimiques spécifiques et qui sont retrouvées dans leur état initial à l’issue de la réaction catalysée. Il existe différents mécanismes enzymatiques selon l’enzyme considérée.
Comment déterminer les paramètres cinétiques ?
Il existe bien entendu d’autres traitements mathématiques permettant d’améliorer la précision de la détermination de ces constantes et de nos jours les paramètres cinétiques sont déterminés par des méthodes de régression non-linéaires beaucoup plus efficaces mais qui sont moins accessibles.
Comment faire une étude cinétique ?
Pour faire une étude cinétique, il faut mesurer la vitesse instantanée de la réaction à différents moments en ayant choisi avec soin les conditions initiales. À partir des mesures on peut tracer des courbes représentant la cinétique de la réaction, ce qui permet de déterminer certaines valeurs caractéristiques.
Qu'est-ce que l'équation de Michaelis-Menten ?
Détermination de l’équation de Michaelis-Menten Au début du XX e siècle, Michaelis et Menten ont proposé un mécanisme réactionnel pour la transformation d’un substrat S en un produit P par une enzyme E. Ce mécanisme comporte deux étapes et fait intervenir un intermédiaire réactionnel : le complexe enzyme-substrat, noté ES.
| Michaelis-Menten (steady-state) Kinetics The Michaelis-Menten |
| Henri Michaelis Menten et la cinetique enzymatique |
| II-CINETIQUE ENZYMATIQUE |
| La Cinétique enzymatique À Un substrat |
| The Michaelis Menten kinetics of soil extracellular enzymes |
| Searches related to cinétique enzymatique michaelis menten filetype:pdf |
Comment vérifier que la cinétique est Michaelienne ?
. D'après l'équation de Michaelis, on peut en effet déduire que vi se rapproche asymptotiquement de vmax lorsque [S] augmente.
Comment déterminer km et Vmax ?
. Que l'on peut énoncer aussi ainsi : c'est la concentration en substrat qui conduit à un taux de saturation de 50% de l'enzyme.
Comment calculer l'activité enzymatique d'une enzyme ?
. L'enzyme catalyse la transformation de 3 x 10-5 mol de P/min pour 1 litre de milieu réactionnel.
. Or la concentration de l'enzyme est de 150 mg/ml donc dans 1 litre on a : 150 x 10-6 x 1000 = 0,15 g d'enzyme.
Comment calculer la vitesse enzymatique ?
. Elle s'exprime en mol/L/s et dépend en général du temps.
|
36 Cinétique enzymatique - ESI
Pour une concentration fixe de l'enzyme, un graphique de la vitesse initiale de réaction L'équation de Michaelis-Menten décrit la courbe cinétique de Vo-[S]: |
|
Cinétique Enzymatique
correspond à la vitesse maximale de la réaction enzymatique => Ce qui donne l' équation de Michaelis-Menten : V0=Vmax • I S I Km+ISI La représentation |
|
Cinétique enzymatique
8 oct 2009 · En réarrangeant l'équation de Michaelis – Menten, on remarque que la vitesse initiale est reliée linéairement à la concentration en substrat : |
|
Henri, Michaelis, Menten et la cinetique enzymatique - Grenoble
modèle simple de cinétique enzymatique, étudié pour la première fois par Victor Henri [1, 2], Leonor Michaelis et Maud Menten [3, 4] il y a plus d'un siècle |
|
LA CINETIQUE ENZYMATIQUE - Université de Constantine 3
INTRODUCTION II LA VITESSE D'UNE REACTION ENZYMATIQUE III LA CONSTANTE DE MICHAELIS MENTEN IV L'EQUATION DE |
|
Cours 3 : Conclusions - (LISM) CNRS UMR7255
Cours 4 : Cinétique enzymatique La vitesse Comment comprendre la cinétique des réactions enzymatiques Propriétes de l'équation de Michaelis- Menten |
|
ENZYMOLOGIE
Cinétique enzymatique ▫ Calcul de de Km et Vmax (représentation V en fonction de S selon Michaélis-Menton) Equation de Michaélis-Menten (1913) |
|
Enzymologie élémentaire - CHUPS Jussieu
19 jui 2002 · 4 2 Cinétique michaélienne Equation de Michaelis Menten les termes d' enzymologie : enzyme, substrat, produit, coenzyme, activateur, |
|
Cinétique Enzymatique Michaélienne 1 La réaction enzymatique
La cinétique chimique ne s'applique pas toujours à l'enzymologie • Hypothèse de Michaelis k1 k3 S + E ES E + P k2 complexe Enzyme - Substrat |
La Cinétique Enzymatique
Michaelis-Menten (s'exprime en mole) la valeur usuelle de Km se situent à des concentration faibles généralement entre 10-2 et 10 8 M Km définit l'affinité de l'enzyme par son substrat : plus Km est grande plus l'affinité de l'enzyme pour le substrat est faible et l'inverse Equation de Michaelis-Menten Soit [E T
Réacteurs enzymatiques et fermenteurs
3 constante de Michaelis et Menten Da nombre de Damköhler KS mol/m 3 constante d’inhibition par le substrat da m diamètre de l’agitateur L m épaisseur db m diamètre de bulle M kg masse de biocatalyseur dc m diamètre de cuve ou de colonne m exposant Deff m 2/s coefficient de diffusion effectif en phase solide mS s-1 coefficient de
Interactions médicamenteuses et cytochromes P450
Michaelis-Menten (13) Il s’agit de la concentration en substrat pour laquelle la vitesse de formation du métabolite est égale à la moitié de la vitesse maximale Ainsi, plus le Km du substrat sera faible, plus l’affinité pour l’enzyme sera élevée Le Ki (en µM) est la constante d’inhibition; elle est égale à la con -
RAPPORTS D’EXPERTS Champ 6 - pharmacologie des agents
d La cinétique de la phénytoïne est hautement saturable et décrite par une cinétique de Michaelis-Menten, la demi-vie donnée en exemple n’est qu’indicative: Vm≈400—600 mg/j, Km≈5,5—7 mg/l (phénytoïne totale), 0,55—0,7 mg/l (phénytoïne libre)
Kinetic mechanism of a recombinant Arabidopsis glyoxylate
controˆle l’activite´ enzymatique in planta Mots-cle´s: glyoxylate re´ductase, 3-hydroxyisobutyrate de´shydroge´nase, me´canisme cine´tique, succinique semialde´hyde re´ductase
| La Cinétique Enzymatique - ESI |
|
cinétique enzymatique - ESI
[PDF] cinétique enzymatique ESIesilrch esi umontreal ca Cinetique Cinetique%enzymatique pdf |
|
La Cinétique Enzymatique - ESI
[PDF] La Cinétique Enzymatique ESIesilrch esi umontreal ca a Cinetique%Enzymatique pdf |
|
36 Cinétique enzymatique - ESI
[PDF] Cinétique enzymatique ESI esi umontreal ca ~badiaa cinetique enzyme pdf |
|
Cinétique Enzymatique - ASSO-ETUD
[PDF] Cinétique Enzymatique ASSO ETUD asso etud unige ch aecb rapports cinetique aguper pdf |
|
Introduction ? la cinétique enzymatique
[PDF] Introduction ? la cinétique enzymatiqueplage desinvolte pagesperso orange d agora d cinetique pdf |
|
tdr47 #8212; #8212; #8212; #8212; #8212; Le modèle de Michaelis-Menten
[PDF] tdr Le modèle de Michaelis Menten pbil univ lyon R pdf tdr pdf |
|
Henri, Michaelis, Menten et la cinetique enzymatique - Grenoble
[PDF] Henri, Michaelis, Menten et la cinetique enzymatique Grenoble grenoble sciences pap ch michaelis menten pdf |
|
cinétique enzymatique - Grenoble Sciences
[PDF] cinétique enzymatique Grenoble Sciences grenoble sciences viennot sites pdf |
|
la cinetique enzymatique - Université de Constantine 3
[PDF] la cinetique enzymatique Université de Constantine univ constantine dz la%cintique%enzymatique%% pdf |
|
Cinétique enzymatique
L 'EQUATION DE MICHAELIS MENTEN V REPRESENTATION GRAPHIQUE DE LINE WEAVER ET BURKE VI EXPRESSION DE L 'ACTIVITE ENZYMATIQUE |
- cinétique enzymatique exercices corrigés
- cinétique enzymatique ? deux substrats
- cinétique enzymatique cours
- km et vmax
- cinétique enzymatique michaelienne
- activité enzymatique calcul
- cinétique enzymatique tp
- equation de michaelis menten pdf

Travaux diriges enonce enzymologie vitesse maximale constante
Source:https://planet-vie.ens.fr/sites/default/files/pages/mig/Figure%201%20-%20Concentration%20en%20produit%20au%20cours%20du%20temps%20pour%20une%20r%C3%A9action%20catalys%C3%A9e%20par%20une%20enzyme%20michaelienne.png

La cinétique des enzymes michaeliennes et l'équation de Michaelis
Source:https://i1.rgstatic.net/publication/321439430_Beyond_the_Michaelis-Menten_equation_Accurate_and_efficient_estimation_of_enzyme_kinetic_parameters/links/5a2696f40f7e9b71dd0c5b93/largepreview.png

PDF) Beyond the Michaelis-Menten equation: Accurate and efficient
Source:https://i1.rgstatic.net/publication/282596734_Michaelis-Menten_Kinetics/links/5b6c5f6445851546c9f93686/largepreview.png

PDF) Michaelis-Menten Kinetics
Source:http://biochimej.univ-angers.fr/Page2/COURS/4EnzymologieLicence/2Cours2/2FIGURES/3Formules/9LineweaverBurk.png
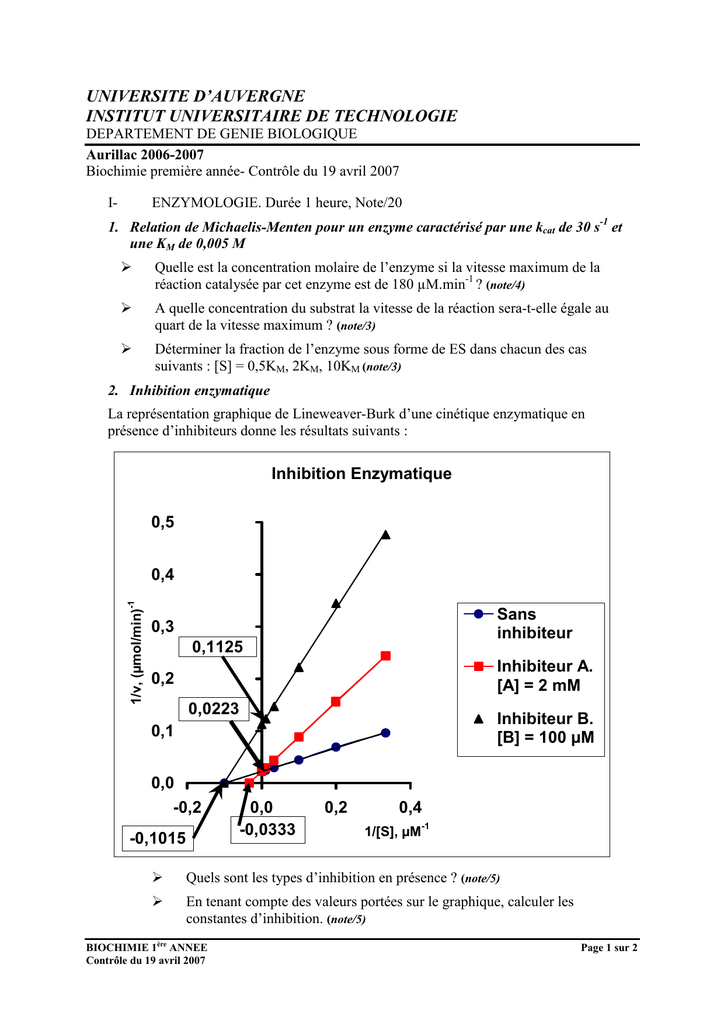
Cours equation henri michaelis menten briggs haldane constante
Source:https://s1.studylibfr.com/store/data/001030572_1-b5819c0924393085969cd81663f8a490.png

19 avril O7
Source:https://img.yumpu.com/46492218/1/500x640/la-cinactique-enzymatique-retour-a-la-page-daccueil.jpg
cinétique enzymatique michaelienne
Cinétique Enzymatique Michaélienne 1 La réaction enzymatique
- cinétique enzymatique michaelis menten
- enzyme michaelienne definition
- cinétique enzymatique exercices corrigés
- difference enzyme michaelienne et allosterique
- cinétique enzymatique tp
- cinétique allostérique
- enzyme michaelienne exemple
- km et vmax
cinétique enzymatique tp
Travaux pratiques de cinétique enzymatique
- compte rendu tp cinétique enzymatique
- onp molar extinction coefficient
- activité enzymatique beta galactosidase
- beta galactosidase onpg
- coefficient extinction molaire onp
- orthonitrophénol
- activité beta galactosidase
- etude de la b galactosidase
vitesse de réaction enzymatique
36 Cinétique enzymatique - ESI
- cinétique enzymatique pdf
- kcat enzyme
- cinétique enzymatique exercices corrigés
- kcat/km
- cinétique enzymatique michaelis menten
- km et vmax
- activité enzymatique calcul
- cinétique enzymatique michaelienne
km et vmax
La Cinétique Enzymatique - ESI
- kcat/km
- équation de michaelis menten démonstration
- km enzyme definition
- cinétique enzymatique exercices corrigés
- vitesse de réaction enzymatique
- kcat unité
- kcat enzyme
- cinétique enzymatique pdf