|
1 La spectrophotométriepdf
coefficient d'extinction molaire de l'espèce absorbante en solution Ce coefficient dépend de : •la nature de la substance •la longueur d'onde λ de la |
|
3 Spectroscopie UV-Visible LCMCP
Coefficient d'extinction molaire (L mol-1 cm-1) Trajet optique ou longueur de la cuve (cm) Concentration (mol L-1) Loi empirique : l'absorption dans le |
|
Ce document est le fruit dun long travail approuvé par le jury de
une bande d'absorption de faible intensité à 330 nm (figures 8) Les coefficients d'extinction molaire mesurés au maximum d'absorption dépendent de la |
|
CHAPITRE 2: LA SPECTROPHOTOMÉTRIE
ε : est le coefficient d'extinction molaire (coefficient d'absorption molaire); c'est une caractéristique de la substance étudiée à une longueur d'onde |
|
Chapitre II -Application de la spectroscopie UV-visible
Les deux formes absorbent vers 270-280 nm mais les coefficients d'extinction molaire des deux bandes sont très différents Dans la forme cétonique il s'agit de |
|
Chapitre III-Spectroscopie dabsorption dans lUV-visible
La plus connue est celle qui correspond à la bande carbonyle située entre 270 et 280 nm Le coefficient d'absorption molaire est faible Ethanal : max = 293 nm |
|
Hamlaoui 721pdf
La bande d'absorption est caractérisée par sa position en longueur d'onde (2 max) et par son intensité reliée au coefficient d'extinction molaire &max la |
|
La spectrophotométrie
ε est appelé coefficient d'absorption molaire (ou d'extinction molaire) ; ce coefficient dépend pour une substance donnée de la température T et de λ et |
|
Spectrophotométrie et loi de Beer-Lambert
- εest appelé coefficient d'extinction molaire ou coefficient d'absorption molaire de la molécule dosée il s'agit d'une valeur constante spécifique à |
|
Sujet
Coefficients d'extinction molaire de Hb et HbO en fonction de la longueur d'onde II Régulation de l'acidité du sang Le pH du sang humain varie dans un |
Comment calculer la valeur du coefficient d'absorption molaire ?
Est défini d'après la loi de Beer-Lambert-Bouguer par l'expression : ε = À /Cl où A est l'absorbance (sans unité), C la concentration de la substance (mol L-1) et l la longueur du trajet optique (cm).
Comment calculer C avec la loi de Beer-Lambert ?
La loi de Beer-Lambert donne la relation entre l'absorbance A et la concentration C : A = ε l C.
Pour déterminer la concentration d'une solution inconnue, on peut réaliser une échelle de teinte ou réaliser une courbe d'étalonnage.Quels sont les composés qui absorbent dans l'UV ?
L'absorption d'un photon dans le domaine UV-visible peut souvent être attribuée à des électrons appartenant à de petits groupes d'atomes appelés chromophores (C=C, C=O, C=N, C≡C, C≡N…).
La longueur d'onde d'absorption dépend de la nature des orbitales mises en jeu.- k est une constante pour une épaisseur de cuve donnée, une longueur d'onde donnée et un soluté donné.
|
ÿþC o n c o u r s d I n t e r n a t b l a n c G a l i e n
21 mars 2010 Le coefficient d'extinction molaire pour le NADHH+ est de 6 |
|
Isomérisation photosensibilisée par des colorants et photoréduction
1'isomCrisation de la forme cis de l'azo- benzene. Le coefficient d'extinction molaire du bleu de mCthylene 578 nm est 31 600 mol-' 1 cm-l. Nous avons |
|
Infinity™ Réactif Liquide Stable de LAmylase
Le coefficient d'extinction molaire du pNP dans ce système de réactifs à 410 nm. = 980 |
|
CHAPITRE I-spectroscopie dabsorption UV-visible
) et par son intensité reliée au coefficient d'extinction molaire εmax (A = εlC). La position du maximum d'absorption correspond à la longueur d'onde de la. |
|
Thème 4 – Chapitre 1 – Activité 1 - EXTRACTION DE LA VANILLINE
e : coefficient d'extinction molaire en L.mol-1.cm-1 l : longueur du trajet optique (cuve de mesure) en cm. C : concentration molaire de la substance |
|
III – C Le choix dun couple donneur-accepteur dépend de la
* la valeur du coefficient d'extinction molaire est donnée pour le pic d'absorption. Sur la base des caractéristiques décrites précédemment les |
|
Dosage en microplaque de lactivité enzymatique AChE du gammare
16 mai 2020 ε. = coefficient d'absorption molaire du TNB = 00136 mM-1 cm-1. ... optique et du coefficient d'absorption molaire utilisés pour l'expression en ... |
|
Cinétique de phototransformation de polluants organiques
11 avr. 2023 Les spectres d'absorption UV/Visible des composés sont présentés dans les figures 2 et 3 et les valeurs des coefficients d'absorption molaire ... |
|
EXERCICE RÉSOLU 2 - Suivi dune réaction par spectrophotométrie
En déduire la valeur du coefficient d'absorption molaire de CuY2‐ noté εY |
|
Thèse de doctorat
L'absorbance maximale utilisée est observée à la longueur d'onde de β78 nm et le coefficient d'extinction utilisé est de 096 L.g-1.cm-1. La masse molaire de la |
|
Untitled
concentration c de l'espèce absorbante à son coefficient d'extinction molaire e(^) et aux propriétés de la cuve. Définir chaque terme et en préciser |
|
Spectres dAbsorption UV-VIS - OECD iLibrary
May 12 1981 ... est caractérisée à la fois par le coefficient d'absorption molaire (coefficient d'extinction molaire) et par la largeur de la bande. |
|
ÿþC o n c o u r s d I n t e r n a t b l a n c G a l i e n
Mar 20 2010 Le coefficient d'extinction molaire pour le NADH |
|
Infinity™ Réactif Liquide Stable de LAmylase
Le coefficient d'extinction molaire du pNP dans ce système de réactifs à 410 nm. = 980 |
|
Première manipulation
En cette longueur d'onde ?iso les coefficients d'absorption molaires ?(?iso |
|
1. Théorie de Born-Oppenheimer. 2. Domaine de lU.V. 3. Loi de
de la cuve et à la concentration molaire volumique du composé. Le coefficient de proportionnalité s'appelle le coefficient d'extinction molaire ? : D = ? |
|
Épreuve expérimentale
où b est la longueur de la cuve et ? le coefficient d'absorption molaire. Les coefficients d'absorption molaires du bleu de bromothymol sous forme acide. |
|
Thème 4 – Chapitre 1 – Activité 1 - EXTRACTION DE LA VANILLINE
e : coefficient d'extinction molaire en L.mol-1.cm-1 l : longueur du trajet optique (cuve de mesure) en cm. C : concentration molaire de la substance |
|
Fiche E1- Pollution acide
et coefficient d'extinction molaire (L.mol-1.cm-1) et section efficace (cm2.molécule-1) de la molécule (efficacité d'absorption du rayonnement par la |
|
C Le choix dun couple donneur-accepteur dépend de la technique
* la valeur du coefficient d'extinction molaire est donnée pour le pic d'absorption. Sur la base des caractéristiques décrites précédemment les fluorophores |
|
TR00064 Introduction - Thermo Fisher Scientific
percent solution extinction coefficients (i e one must convert from 10 mg/ml units to 1 mg/ml concentration units) (A / ? percent) 10 = concentration in mg/ml The relationship between molar extinction coefficient (? molar) and percent extinction coefficient (? percent) is as follows: (? molar) 10 = (? percent) × (molecular |
|
Déterminer un coefficient d'extinction molaire Méthode - Kartable
(en mol-1 L cm-1) est le coefficient d’extinction molaire de l’espèce absorbante en solution Ce coefficient dépend de : •la nature de la substance •la longueur d’onde ? de la lumière •la nature du solvant •la température La loi de Beer-Lambert est additive (mais non la transmittance) |
|
Page : 1/ 8 Introduction aux techniques de luminescence et
Un coefficient d’extinction molaire ? (M-1 cm-1) le plus élevé possible C’est la capacité d’un fluorophore à absorber l’énergie apportée par un photon à une longueur d’onde Un rendement quantique (?) élevé C’est la capacité du fluorophore à ré-émettre sous forme de lumière l’énergie absorbée |
|
Thème 4 – Chapitre 1 – Activité 1
e: coefficient d’extinction molaire en L mol-1 cm-1 l : longueur du trajet optique (cuve de mesure) en cm C : concentration molaire de la substance absorbante dans le milieu de lecture en mol L-1 Les limites de validité de cette loi sont : - l’utilisation d’une lumière monochromatique ; |
Comment calculer un coefficient d'extinction molaire ?
L'expression littérale de varepsilon est : varepsilon = dfrac {A} {l imes C}. L'unité du coefficient d'extinction molaire sera L.mol -1 .cm -1 . On effectue l'application numérique, le résultat étant alors le coefficient d'extinction molaire de l'espèce considérée, pour la longueur d'onde donnée.
Qu'est-ce que le coefficient d'extinction molaire ?
?(?) (lettre grecque epsilon minuscule) est le coefficient d’extinction molaire, il dépend de la longueur d’ onde mais aussi du solvant, du soluté responsable de l’absorption, de la température et dans une moindre mesure de la pression. Son unité est le litre par mole et par centimètre (L. mol -1.cm-1)
Quels sont les rayonnements les plus utilisés dans la liaison chimique?
Les rayonnements les plus souvent utilisés sont l’ultraviolet (UV), la lumière visible et l’infrarouge (IR). Le domaine du visible et de l’UV a été abondamment étudié, et ce depuis longtemps. Mais s’il est indispensable pour une approche expérimentale de la nature de la liaison chimique, il est pauvre en information structurale.
Comment calculer le coefficient d'extinction molaire ?
.C]
Quelle est l'unité du coefficient d'extinction molaire ?
Comment déduire le coefficient d'absorption molaire ?
. Pour avoir celle-ci du côté gauche de l'équation, divisez l'absorbance par la longueur de la solution et par la concentration : ?= A/lc.
. Vous pouvez dès lors vous servir de cette équation simple pour calculer l'absorptivité molaire pour une longueur d'onde donnée.
Comment trouver K dans la loi de Beer-Lambert ?
|
Rapport du 22-24102008
Le coefficient d'absorption molaire a été calculé à ε= 106 M-1m-1 Page 2 1 5 Analyse qualitative Solution Cation majoriataire Anion majoritaire |
|
Spectrophotométrie dabsorption moléculaire Étude et dosage de la
Aλ = l · c · ελ Aλ: l'absorption à la longueur d'onde λ l: la longueur de la cuve [cm] ελ: le coefficient d'extinction molaire [l · cm-1 · mol-1] à la longueur d'onde λ |
|
121114_version électronique définitive - Thèses
donner un sel d'azafulvénium de couleur bleu-vert (Figure 11) Ce produit absorbe à 624 nm et possède un coefficient d'extinction molaire très élevé ( ε624nm |
|
Document à destination des enseignants et des techniciens - Jeulin
d- A partir du coefficient d'extinction molaire de la solution étudiée : calculer la concentration : Cmax observable avec chaque spectrophotomètre e- Pour que |
|
Spectroscopies optiques - Genopole
est le «coefficient d'extinction molaire» = α() / 2 303 * variation de I en fonction de la distance ttraversée, à c donnée * variation de la concentration c sur une |
|
9782729870782_extraitpdf
C « ελ » est le coefficient d'extinction molaire et peut s'exprimer en M-1 cm-1 A Le coefficient spécifique d'absorbance molaire du tryptophane au maximum |
|
Chapitre 1
absorbante et de la longueur d'onde : c'est le coefficient d'absorption molaire ou coefficient d'extinction molaire (en L mol –1 cm –1 si l en cm et c en mol L –1 |
|
Énoncé de lépreuve expérimentale
où b est la longueur de la cuve et ε le coefficient d'absorption molaire Les coefficients d'absorption molaires du bleu de bromothymol sous forme acide |
|
Annexe 2 analyse des ions triiodure par spectrophotometrie
s ελ Coefficient d'extinction molaire à la longueur d'onde λ M-1 cm-1 ε Puissance spécifique dissipée W kg-1 ε353 nm Coefficient d'extinction molaire de I3 |
TR00064 Introduction
Most sources report extinction coefficients for proteins measured at or near a wavelength of 280nm in phosphate or other physiologic buffer Molar Extinction Coefficients vs Absorbances for 1 Solutions Application of a molar extinction coefficient in the calculation yields an expression of concentration in terms of molarity: A / ε molar
ISO 9001 ISO 14001 ISO 13485 Registered Quality Environmental
and using a molar extinction coefficient of 18,000 M-1 cm-1 (16,000 M-1cm- 1 for 0 5 M EDTA) (1, 3) One unit of the protein phosphatase activity is defined as the amount of enzyme that hydrolyzes 1 nanomole of PNPP in one minute at 30°C in a total reaction volume of 50 μl under standard reaction condition
-N A D P H - OYC Americas
6 2×103=Molar extinction coefficient of NADPH at 340 nm(L・mol-1・cm-1) d=Light path length(1 cm) v=Sample volume(0 5 mL) s=Sample concentration(0 6 mg/mL) S=Na( ) W=Water Content( ) Keep tightly stoppered in the dark below 5℃ Moisture will accelerate the purity reduction
b-D-galactopyranoside N1127 Product Description Preparation
nm 2 The molar extinction coefficient is 2 13 x 104 at pH 10 2 3 We have used absorbance readings at 410 nm in the determination of the activity of β-galactosidase using this product as the substrate The K m for β-galactosidase (from E coli) is 9 5 x 10-4 M in Tris buffer, pH 7 6, at 20 °C 4 The V max for β-galactosidase for this substrate is
Calculation of the thickness and optical constants of lead
transparent substrates The film has thickness d and complex refractive index n c =n-ik, where n is the refractive index and k the extinction coefficient The substrate thickness is several orders of magnitude larger than d, and its refractive index is symbolised by s which the dispersion is given by the following relationship [22]: c b s a 2
Myoglobin (M0630) - Product Information Sheet
Extinction coefficient:2 EmM = 12 92 (555 nm) pI:3 7 3 (major component) and 6 8 (minor component) Myoglobin from horse skeletal muscle is a single chain heme protein containing 153 amino acid residues It posesses no disulfide bridges or free -SH groups Myoglobin contains 8 variously sized right-handed
Mesure de l’activité enzymatique
Il est difficile de mesurer la quantité d’enzyme en unités de masse ou de concentration molaire (quantité trop faible et problème de purification); l’activité enzymatique est défini en terme de vitesse de réaction (la V étant directement proportionnelle à la quantité d’enzyme) 2
|
Chapitre 2
[PDF] Chapitre fsr ac ma cours chimie zaydoun master ChapII pdf |
|
Chapitre II -Application de la spectroscopie UV-visible
[PDF] Chapitre II Application de la spectroscopie UV visible fsr ac ma Chapitre%II% Application%de%la%spectroscopie%UV visible pdf |
|
Chapitre III-Spectroscopie d absorption dans l UV-visible
[PDF] Chapitre III Spectroscopie d 'absorption dans l 'UV visible fsr uma ac ma Chapitre%III Spectroscopie%d 'absorption%dans%l 'UV visible pdf |
|
Spectrophotométrie d absorption moléculaire Étude - ASSO-ETUD
[PDF] Spectrophotométrie d 'absorption moléculaire Étude ASSO ETUD asso etud unige ch aecb rapports eme uv visible pdf |
|
2 Spectrophotométrie moléculaire appliquée aux biomolécules - ESI
[PDF] Spectrophotométrie moléculaire appliquée aux biomolécules ESI esi umontreal ca ~badiaa spectro moleculaire pdf |
|
Spectroscopie dans l ultraviolet et le visible
[PDF] Spectroscopie dans l 'ultraviolet et le visible cheneliere info Spectroscopie dans ultraviolet pdf |
|
Cours d introduction aux spectroscopies optiques : Analyse - Free
[PDF] Cours d 'introduction aux spectroscopies optiques Analyse Freestephanie bonneau free cour spectro pdf |
|
Spectrophotométrie - Eduscol
[PDF] Spectrophotométrie Eduscoleduscol education rnchimie phys baillet tp spectro pdf |
|
Dosage des protéines et electrophorèse - IBMC
[PDF] Dosage des protéines et electrophorèse I B M C ibmc u strasbg dosage des proteines et electrophorese pdf |
|
1ère S
concentration molaire c de cette solution A = c Le coefficient de proportionnalité (appelé coefficient d 'extinction molaire) dépend de la nature de la |
- transition électronique uv visible
- spectroscopie uv visible application
- principe spectroscopie uv visible
- spectroscopie uv-visible exercices corrigés
- spectre uv visible interprétation
- effet bathochrome et hypsochrome
- spectroscopie uv visible ppt
- table uv visible

Chapitre III-Spectroscopie d'absorption dans l'UV-visible par
Source:https://docplayer.fr/docs-images/40/1845605/images/page_2.jpg

SPECTROSCOPIE D ABSORPTION DANS L UV- VISIBLE - PDF Téléchargement
Source:https://docplayer.fr/docs-images/40/1845321/images/page_9.jpg

TD DOSAGE DE PROTEINES ET ELECTROPHORESE : PARTIE THÉORIQUE BST1
Source:https://www.fichier-pdf.fr/2013/10/13/td-spectro-ir-uv-pour-pcpm-2013-2014/preview-td-spectro-ir-uv-pour-pcpm-2013-2014-1.jpg

TD Spectro IR \u0026 UV pour PCPM 2013-2014 par user - Fichier PDF
Source:https://s1.studylibfr.com/store/data/008886711_1-aeec390c3601d3809a01436bae0b88e6.png
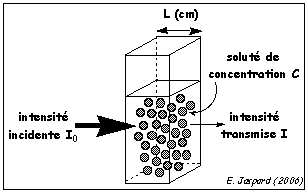
ChapIII S4pdf
Source:http://biochimej.univ-angers.fr/Page2/TexteTD/8TPmethodologie/3Spectrophotometrie/3Figures/2BeerLambert/1BeerLamb.gif

Spectrophotometrie ultra violet visible methodologie TP biochimie
Source:https://www.fichier-pdf.fr/2010/11/05/perrotmspectro/preview-perrotmspectro-1.jpg
recette pizza italienne gratuit pdf
La Pizza- recette italienne
- fiche technique pizza pdf
- livre recette pizza professionnel
- recette pate a pizza professionnelle gratuit pdf
- ingredient pate a pizza professionnel pdf
- ingredient pate a pizza professionnel
- meilleur livre pizza
- recette pizza pdf
- fiche technique pizza margherita
recette pate a pizza professionnelle gratuit pdf
ë chacun sa pizza - Metro
- recette pizza italienne gratuit pdf
- biga pour pizza
- ingredient pate a pizza professionnel
- pizza poolish
- ingredient pate a pizza professionnel pdf
- meilleur livre pizza
- fiche technique pizza margherita
- pate pizza poolish
fiche technique pizza pdf
le grand livre de la pizza - Galbani Professionale
- recette pizza pdf gratuit
- recette pizza italienne gratuit pdf
- fiche technique pizza margherita
- recette pate a pizza professionnelle gratuit pdf
- recette pizza maison pdf
- ingredient pate a pizza professionnel
- livre recette pizza professionnel
- pate a pizza pdf
spectrophotométrie uv visible
Spectrophotométrie UV-Visible - Eduscol
- spectrophotométrie uv visible définition
- spectroscopie uv visible ppt
- spectroscopie uv-visible exercices corrigés
- spectrophotométrie uv visible principe pdf
- spectrophotométrie uv visible tp
- spectre uv visible interprétation
- spectroscopie uv visible application
- spectrophotométrie uv principe