Analyse spectrale Spectres de RMN du proton
Les exercices de bac sont conçus à partir de la colonne Compétences exigibles. Notions et contenus. Compétences exigibles. Spectres RMN du proton.
Chimie RMN
Structures moléculaires et spectres de RMN - Corrigé -
Cette molécule présente 4 groupes de protons équivalents donc le spectre de RMN contiendra 4 signaux. Le proton de la fonction aldéhyde (-H) a un
Activite RMN corrige
Exercice 1(e3a PC 2017) : étude d'un spectre de RMN
3 avr. 2020 CORRIGÉ. Exercice 1(e3a PC 2017) : étude d'un spectre de RMN ... Le spectre RMN du proton du composé P obtenu présente les signaux suivants ...
ds optionPC CORRRIGE
Contrôle des Connaissances de Spectroscopie Durée 1 h
6 nov. 2003 indiquant sur les spectres l'attribution des signaux RMN et les absorptions IR ... Contrôle des Connaissances de Spectroscopie - Corrigé.
LPro Spectro Picquet
SPECTROSCOPIES
SPECTROSCOPIES. SPECTROSCOPIES. UV-visible. IR. RMN. Page 2 environnement stéréochimie. RMN du proton. Page 16. 16. Page 17 ... Exercice 1. Page 131 ...
spectroscopiesDiapo
Thème C : Constitution et cohésion de la matière TD O4
Exercice 5 : Analyse d'un spectre RMN H. On fournit le spectre RMN du proton de la molécule de 1-bromopropane de formule semi-développée. Attribuer à.
Chimie PCSI
Il est absurde et contre-productif de se précipiter sur les tables RMN 1H dès le Reprendre l'exercice en déterminant la multiplicité de chaque signal.
Spectroscopies Elèves TD
Exercice 19 page 106
Correction des exercices RMN du proton. 19 22
Corrigés exercices Spectres RMN
CORRIGÉ
8 mars 2018 CORRIGÉ. ❒ Les différents exercices et les problèmes sont indépendants ... Etudions le signal de tels groupes en spectroscopie RMN :.
ds optionPCcorrige
Chimie analytique 3 ème année docteur en pharmacie Corrigé-type
Exercice 5 : Du spectre IR on déduit que cette molécule porte une fonction cétone. Spectre RMN : Courbe intégrale :.
Chimie analytique Corrigé type RMN TD de chimie analytique eme année pharmacie Dr ADOUANI
 -1-
-1- Chimie organique 8 et 9 :
Techniques spectroscopiques
Conseils et Erreurs fréquentes
valeurs de déplacement chimique pour des systèmes où un groupement unique exerce un effet sur les hydrogènes
voisins. Dans les molécules étudiées, il y a en général plusieurs groupements caractéristiques dont les effets se
informations fournies par le spectre sont, par ordre d'importance :Intégration > Couplages > Position
Attention, dans la formule du nombre dinsaturations, le nombre datomes triǀalents (comme lazote) apparaŠt aǀec un
signe +.Attention à la présentation pour l'attribution des signaux RMN, un tableau est souvent le bienvenu. Les grandes
phrases sont souvent incompréhensibles.On n'observe presque jamais des couplages pour des protons liés à un hétéroatome (O, N...)
Exercices d·application directe du cours
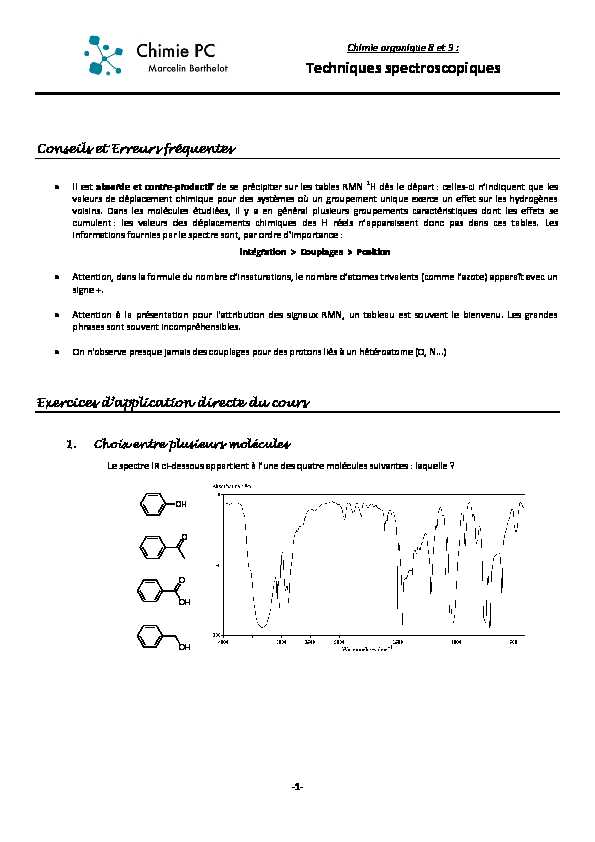
1. Choix entre plusieurs molécules
OH O OH O OH -2-2. Identification G·XQ ŃRPSRVp
Le composé dont le spectre IR est représenté ci-dessous a pour formule brute C3H6O2. Retrouver son nom.
3. 8PLOLVMPLRQ GH OM ŃRXUNH G·LQPpJUMPLRQ
Le spectre RMN 1H ci-dessous est celui du 2,2-diméthylpropan-1-ol. Attribuer à chaque signal les hydrogènes
correspondant en utilisant exclusivement la courbe dintĠgration.4. Nombre de signaux G·XQ VSHŃPUH 501 1H
1. Prévoir le nombre de signaux RMN 1H des molécules suivantes :
CH3-O-CH3
CH3-O-CH2-CH3
CH3-O-CH2-CH2-O-CH3
Cl-CH2-CH2-Br
H2C=CH2
ClHC=CHCl (Z) puis (E)
H2C=CBrI
1,4-dichlorobenzène
OO -3-5. 3MUMPqPUHV LQIOXHQoMQP OM SRVLPLRQ G·XQ VLJQMO 501 1H
1. Proposer une explication à lĠǀolution de la position du signal singulet des molĠcules suiǀantes :
CH3F CH3OCH3 (CH3)3N CH3CH3 (CH3)4Si
ɷ (ppm) 4,3 3,2 2,2 0,9 0,0
ʖ 4,0 3,5 3,0 2,5 1,8
2. InterprĠter lévolution ci-dessous :
CH3Cl CH2Cl2 CHCl3
ɷ (ppm) 3,1 5,2 7,3
3. Que peut-on conclure de lĠǀolution ci-dessous ?
0,9 ppm
1,3 ppm
0,9 ppm
O2N4,3 ppm
2,0 ppm
1,0 ppm
4. Dans les molĠcules suiǀantes, identifier le groupe dhydrogğne le plus dĠblindĠ ?
2-bromobutane
1,1,2-trichloropropane
Tétrahydrofurane
6. Utilisation de tables RMN 1H
molécule ci-dessous : 1,6 - 4,0 - 7,5 - 8,2 - 12,0. O2N CO2H7. Identification de molécule 1 : C3H5BrO2
A laide du spectre infrarouge et du spectre RMN 1H ci-après, déterminer la formule topologique de la
molécule de formule brute C3H5BrO2 -4-8. Identification de molécule : C8H10O
-5-Exercices G·entraînement
9. Etude de spectres IR
1. Le 2-méthylpropan-1-ol est traité par du trioxyde de chrome en présence de pyridine et fournit un
composé A, dont le spectre IR est donné ci-dessous : a) Interpréter les bandes principales du spectre IR et en déduire la formule et le nom de A.b) Quelle différence observerait-on sur le spectre IR du composé B obtenu par action du permanganate de
potassium en excès, en milieu acide, sur le 2-méthylpropan-1-ol ?2. Quelle est, parmi les 2 molécules C1 : 1-méthylcyclopentan-2-one et C2 : hex-5-èn-2-one, celle du composé
C de formule C6H10O, dont le spectre IR est donné ci-dessous ?10. Identification de molécules
Déterminer la structure des composés suivants.1. Composé A : C4H10O2
-6-2. Composé B: C4H8O2 :
3. Composé C : C9H10O2 : Spectre IR : bande forte à 1710 cm-1 et spectre RMN (à gauche) :
4. Composé D : C7H12O4 : Spectre IR : bandes fortes à 1740 cm-1 et 1200 cm-1 et spectre RMN (à droite) :
11. Diastéréoisomérie
1. Deux molécules diastéréoisomères ont-elles les mêmes spectres RMN 1H ?
On traite le safrole par le bromure dhydrogğne puis par laniline. On obtient un mĠlange disomğres du
safrole. O O2. Donner la formule semi-développée des isomères qui composent le mélange final. Soint-ils plus ou moins
stables que le safrole ?3. La RMN 1H permet-elle de distinguer ces isomères du safrole ?
-7-Exercices d·approfondissement
12. Attribution de signaux
1. Le composé A représenté ci-après est ajouté à un mélange de trioxyde de chrome dans la pyridine et le
dichlorométhane. Après traitement, le composé B (C13H14O2) est isolé. a) Identifier B. Quel type de réaction est effectuée ici ?b) Le spectre infra-rouge du composé B comporte, entre autres, une bande fine et intense à 1675 cm-1. À
quoi correspond-elle ? c) Dans le spectre infrarouge du composé C représenté ci-contre, cette bande est située vers 1705 cm-1. Interpréter la différence avec le composé B. d) Le spectre RMN du composé B fait apparaître, entre autres, les signaux suivants : - un multiplet intégrant pour 2H à a = 2,00 ppm (noté a) - un triplet intégrant pour 2H à b = 2,50 ppm (noté b) - un multiplet intégrant pour 1H à c = 4,53 ppm (noté c) - un multiplet mal résolu intégrant pour 1H à d = 5,92 ppm (noté d) - un doublet intégrant pour 1H à e = 6,83 ppm (notée e) - un massif intégrant pour 5H entre 6,9 et 7,2 ppm (noté f) Identifier les protons correspondant à ces 6 signaux dans la molécule B. - singulet large à 11 ppm, intégration 2 - triplet à 3,8 ppm, intégration 1 - doublet à 2,7 ppm, intégration 2 - singulet large à 2 ppm, intégration 2 interprétant les déplacements chimiques et la multiplicité. b) Pourquoi les deux singulets sont-ils élargis ?3. On sintĠresse au composĠ reprĠsentĠ ci-dessous :
HO O H3C CH2 H2C O O CH3 TBSO H H3C H CH3 HCH3 a b c d e f g h i j k Le spectre infrarouge de ce produit pur présente les bandes caractéristiques suivantes :1740 cmо1 1720 cmо1 1715 cm-1
Le spectre RMN 1H (400 MHz) enregistré dans CDCl3 présente les signaux figurant dans le tableau
suivant (certains signaux ne sont pas donnés) : ɷ (ppm) Multiplicité Intégration Couplage (Hz)1,13 d 3 7,10
1,14 s 3
1,16 d 3 7,10
1,21 s 3
1,95-1,77 m 2
2,22-2,21 m 2
3,67 s 3
4,16-4,10 m 1
9,72 d 1 2,09
-8- Cl (OCH2CH3)2 ClO Cl Cl O ClCl(OCH2CH3)2
a) Expliquer qualitativement pourquoi on observe des bandes et non pas des raies dans un spectre
infrarouge. En attribuant les différentes bandes caractéristiques, montrer que le spectre infrarouge est
en accord avec la formule du composé.b) En utilisant la numérotation proposée pour les différents groupes de protons, proposer une attribution
pour chacun des protons aux signaux correspondants. On présentera les résultats sous forme de
tableau. Justifier la multiplicité des signauxDonnées :
RMN 1H : Gamme de déplacements chimiques :
Protons CH3оCо оCH2оCH2о оCH2оCOо RоCOOCHо оCHоOо оCH2оOR RоCHO
(ppm) 0,9о1,3 1,55о2,10 2,0о3,0 3,5о4,5 3,5о4,5 4,7о6,2 9,5о10,2 Infrarouge : Nombre donde en cm-1 de vibration de quelques groupes fonctionnels C=O ester saturé C=O aldéhyde C=O -1-Chimie organique 8 et 9 :
Techniques spectroscopiques
Conseils et Erreurs fréquentes
valeurs de déplacement chimique pour des systèmes où un groupement unique exerce un effet sur les hydrogènes
voisins. Dans les molécules étudiées, il y a en général plusieurs groupements caractéristiques dont les effets se
informations fournies par le spectre sont, par ordre d'importance :Intégration > Couplages > Position
Attention, dans la formule du nombre dinsaturations, le nombre datomes triǀalents (comme lazote) apparaŠt aǀec un
signe +.Attention à la présentation pour l'attribution des signaux RMN, un tableau est souvent le bienvenu. Les grandes
phrases sont souvent incompréhensibles.On n'observe presque jamais des couplages pour des protons liés à un hétéroatome (O, N...)
Exercices d·application directe du cours
1. Choix entre plusieurs molécules
OH O OH O OH -2-2. Identification G·XQ ŃRPSRVp
Le composé dont le spectre IR est représenté ci-dessous a pour formule brute C3H6O2. Retrouver son nom.
3. 8PLOLVMPLRQ GH OM ŃRXUNH G·LQPpJUMPLRQ
Le spectre RMN 1H ci-dessous est celui du 2,2-diméthylpropan-1-ol. Attribuer à chaque signal les hydrogènes
correspondant en utilisant exclusivement la courbe dintĠgration.4. Nombre de signaux G·XQ VSHŃPUH 501 1H
1. Prévoir le nombre de signaux RMN 1H des molécules suivantes :
CH3-O-CH3
CH3-O-CH2-CH3
CH3-O-CH2-CH2-O-CH3
Cl-CH2-CH2-Br
H2C=CH2
ClHC=CHCl (Z) puis (E)
H2C=CBrI
1,4-dichlorobenzène
OO -3-5. 3MUMPqPUHV LQIOXHQoMQP OM SRVLPLRQ G·XQ VLJQMO 501 1H
1. Proposer une explication à lĠǀolution de la position du signal singulet des molĠcules suiǀantes :
CH3F CH3OCH3 (CH3)3N CH3CH3 (CH3)4Si
ɷ (ppm) 4,3 3,2 2,2 0,9 0,0
ʖ 4,0 3,5 3,0 2,5 1,8
2. InterprĠter lévolution ci-dessous :
CH3Cl CH2Cl2 CHCl3
ɷ (ppm) 3,1 5,2 7,3
3. Que peut-on conclure de lĠǀolution ci-dessous ?
0,9 ppm
1,3 ppm
0,9 ppm
O2N4,3 ppm
2,0 ppm
1,0 ppm
4. Dans les molĠcules suiǀantes, identifier le groupe dhydrogğne le plus dĠblindĠ ?
2-bromobutane
1,1,2-trichloropropane
Tétrahydrofurane
6. Utilisation de tables RMN 1H
molécule ci-dessous : 1,6 - 4,0 - 7,5 - 8,2 - 12,0. O2N CO2H7. Identification de molécule 1 : C3H5BrO2
A laide du spectre infrarouge et du spectre RMN 1H ci-après, déterminer la formule topologique de la
molécule de formule brute C3H5BrO2 -4-8. Identification de molécule : C8H10O
-5-Exercices G·entraînement
9. Etude de spectres IR
1. Le 2-méthylpropan-1-ol est traité par du trioxyde de chrome en présence de pyridine et fournit un
composé A, dont le spectre IR est donné ci-dessous : a) Interpréter les bandes principales du spectre IR et en déduire la formule et le nom de A.b) Quelle différence observerait-on sur le spectre IR du composé B obtenu par action du permanganate de
potassium en excès, en milieu acide, sur le 2-méthylpropan-1-ol ?2. Quelle est, parmi les 2 molécules C1 : 1-méthylcyclopentan-2-one et C2 : hex-5-èn-2-one, celle du composé
C de formule C6H10O, dont le spectre IR est donné ci-dessous ?10. Identification de molécules
Déterminer la structure des composés suivants.1. Composé A : C4H10O2
-6-2. Composé B: C4H8O2 :
3. Composé C : C9H10O2 : Spectre IR : bande forte à 1710 cm-1 et spectre RMN (à gauche) :
4. Composé D : C7H12O4 : Spectre IR : bandes fortes à 1740 cm-1 et 1200 cm-1 et spectre RMN (à droite) :
11. Diastéréoisomérie
1. Deux molécules diastéréoisomères ont-elles les mêmes spectres RMN 1H ?
On traite le safrole par le bromure dhydrogğne puis par laniline. On obtient un mĠlange disomğres du
safrole. O O2. Donner la formule semi-développée des isomères qui composent le mélange final. Soint-ils plus ou moins
stables que le safrole ?3. La RMN 1H permet-elle de distinguer ces isomères du safrole ?
-7-Exercices d·approfondissement
12. Attribution de signaux
1. Le composé A représenté ci-après est ajouté à un mélange de trioxyde de chrome dans la pyridine et le
dichlorométhane. Après traitement, le composé B (C13H14O2) est isolé. a) Identifier B. Quel type de réaction est effectuée ici ?b) Le spectre infra-rouge du composé B comporte, entre autres, une bande fine et intense à 1675 cm-1. À
quoi correspond-elle ? c) Dans le spectre infrarouge du composé C représenté ci-contre, cette bande est située vers 1705 cm-1. Interpréter la différence avec le composé B. d) Le spectre RMN du composé B fait apparaître, entre autres, les signaux suivants : - un multiplet intégrant pour 2H à a = 2,00 ppm (noté a) - un triplet intégrant pour 2H à b = 2,50 ppm (noté b) - un multiplet intégrant pour 1H à c = 4,53 ppm (noté c) - un multiplet mal résolu intégrant pour 1H à d = 5,92 ppm (noté d) - un doublet intégrant pour 1H à e = 6,83 ppm (notée e) - un massif intégrant pour 5H entre 6,9 et 7,2 ppm (noté f) Identifier les protons correspondant à ces 6 signaux dans la molécule B. - singulet large à 11 ppm, intégration 2 - triplet à 3,8 ppm, intégration 1 - doublet à 2,7 ppm, intégration 2 - singulet large à 2 ppm, intégration 2 interprétant les déplacements chimiques et la multiplicité. b) Pourquoi les deux singulets sont-ils élargis ?3. On sintĠresse au composĠ reprĠsentĠ ci-dessous :
HO O H3C CH2 H2C O O CH3 TBSO H H3C H CH3 HCH3 a b c d e f g h i j k Le spectre infrarouge de ce produit pur présente les bandes caractéristiques suivantes :1740 cmо1 1720 cmо1 1715 cm-1
Le spectre RMN 1H (400 MHz) enregistré dans CDCl3 présente les signaux figurant dans le tableau
suivant (certains signaux ne sont pas donnés) : ɷ (ppm) Multiplicité Intégration Couplage (Hz)1,13 d 3 7,10
1,14 s 3
1,16 d 3 7,10
1,21 s 3
1,95-1,77 m 2
2,22-2,21 m 2
3,67 s 3
4,16-4,10 m 1
9,72 d 1 2,09
-8- Cl (OCH2CH3)2 ClO Cl Cl O ClCl(OCH2CH3)2
a) Expliquer qualitativement pourquoi on observe des bandes et non pas des raies dans un spectre
infrarouge. En attribuant les différentes bandes caractéristiques, montrer que le spectre infrarouge est
en accord avec la formule du composé.b) En utilisant la numérotation proposée pour les différents groupes de protons, proposer une attribution
pour chacun des protons aux signaux correspondants. On présentera les résultats sous forme de
tableau. Justifier la multiplicité des signauxDonnées :
RMN 1H : Gamme de déplacements chimiques :
Protons CH3оCо оCH2оCH2о оCH2оCOо RоCOOCHо оCHоOо оCH2оOR RоCHO
(ppm) 0,9о1,3 1,55о2,10 2,0о3,0 3,5о4,5 3,5о4,5 4,7о6,2 9,5о10,2 Infrarouge : Nombre donde en cm-1 de vibration de quelques groupes fonctionnels C=O ester saturé C=O aldéhyde C=O