 TRAVAUX PRATIQUES DE CHIMIE DES SOLUTIONS
TRAVAUX PRATIQUES DE CHIMIE DES SOLUTIONS
Les notes correspondantes seront comptabilisées avec celles des comptes rendus et du contrôle final. • L'attitude de l'étudiant lors des séances de TP sera
 TP N°7 : TITRAGE ACIDO-BASIQUE SUIVI PAR PH-METRIE
TP N°7 : TITRAGE ACIDO-BASIQUE SUIVI PAR PH-METRIE
Objectifs : ➢ Réaliser par suivi pH-métrique le titrage d'un acide ou d'une base en solution aqueusechap8 – (1) .
 TP 3 : Titrages pH-métriques
TP 3 : Titrages pH-métriques
pH-métrique. Principe. Le titrage d'une solution acide (ou basique) de solution titrante versée et le pH de la solution. Page 3. 3. Compte rendu du TP n°2:.
 TP n° 1 - Session 2001
TP n° 1 - Session 2001
Le compte rendu d'une étude expérimentale : - rendre compte d'observations 1- DOSAGE pH-MÉTRIQUE DU JUS DE CITRON. On réalisera le dosage de l'acide ...
 Chimie TP
Chimie TP
Le compte-rendu d'une séance de travaux pratiques est la plupart du temps
 CM11 Chimie générale
CM11 Chimie générale
Vous ne rendrez qu'un seul compte rendu correspondant aux 2 TP de pHmétrie (TP3 et TP 4 : pH-métrie (2). Dosage de différents triacides. Travail préalable ...
 Travaux Pratiques BioPhysique
Travaux Pratiques BioPhysique
Pour faire un bon TP il est indispensable de lire le polycopié et de préparer la partie théorique du compte rendu. • Une feuille de résultats (fiche technique)
 rapport sur lépreuve de travaux pratique de chimie
rapport sur lépreuve de travaux pratique de chimie
pH-métrie. Spectrophotométrie UV-Vis : Les candidats prennent en main rapidement les - il est important de soigner la présentation de son compte-rendu de TP.
 3TP2 - Contrôle de qualité dun vinaigre par titrage pH-métrique
3TP2 - Contrôle de qualité dun vinaigre par titrage pH-métrique
Fixer la cellule pH-métrique la plonger dans la solution d'acide et ajouter Capture d'écran des courbes obtenues pour les insérer dans votre compte-rendu.
 L1 Chimie-Biologie accompagné
L1 Chimie-Biologie accompagné
28 sept. 2023 ... compte-rendu manipulations
 TRAVAUX PRATIQUES DE CHIMIE DES SOLUTIONS
TRAVAUX PRATIQUES DE CHIMIE DES SOLUTIONS
Les comptes rendus devront être transmis à la prochaine séance à l'enseignant. TP N°1 : DOSAGE ACIDE FORT - BASE FORTE PAR PH-METRIE ET. CONDUCTIMETRIE.
 TP 3 : Titrages pH-métriques
TP 3 : Titrages pH-métriques
TP chimie des solutions Au cours d'un dosage pH-métrique On mesure le pH de la solution titrée pour chaque volume de ... Compte rendu du TP n°2:.
 polycopie-tp-s3-biochimie-structurale.pdf
polycopie-tp-s3-biochimie-structurale.pdf
Appareillage et mesures (spectrophotométrie pHmétrie
 TP N°7 : TITRAGE ACIDO-BASIQUE SUIVI PAR PH-METRIE
TP N°7 : TITRAGE ACIDO-BASIQUE SUIVI PAR PH-METRIE
Objectifs : ? Réaliser par suivi pH-métrique le titrage d'un acide ou d'une base en solution aqueusechap8 – (1) .
 Travaux Pratiques BioPhysique
Travaux Pratiques BioPhysique
Pour faire un bon TP il est indispensable de lire le polycopié et de préparer la partie théorique du compte rendu. • Une feuille de résultats (fiche technique)
 Les Travaux Pratiques De Réactivité chimique
Les Travaux Pratiques De Réactivité chimique
La mesure potentiométrique du pH lors du titrage : pHmétrie. ci-dessous pour un dosage d'un diacide fort par une base forte
 TP-01_Chimie-01-25-09-2017.pdf
TP-01_Chimie-01-25-09-2017.pdf
II. LES COMPTES-RENDUS. En règle générale un compte rendu de TP contient les points suivants : peut avoir pour principe la pH-métrie.
 TP n° I
TP n° I
Le compte rendu doit être rendu à la fin de chaque séance. Le but de ce TP est de réaliser la mesure du pH la mesure de la résistivité et la.
 TP CHIMIE-1 & TP CHIMIE-2
TP CHIMIE-1 & TP CHIMIE-2
Instructions pour la rédaction du compte rendu de TP ................................ 1 ... pH : En chimie le pH mesure l'activité de protons (H.
 Chimie TP
Chimie TP
Suivre un titrage par pH-métrie. Fiche 7. Rédiger un compte-rendu de TP 25 ... TP 2. Titrage pH-métrique et conductimétrique d'un produit mé-.
 TP MESURES DE PH - Physagreg
TP MESURES DE PH - Physagreg
précise du pH mais son utilisation est plus contraignante que celle du papier pH Voici le protocole à respecter pour une mesure de pH au pH-mètre : Rincez la sonde du pH-mètre à l’eau distillée puis l’essuyer avec du papier absorbant Versez la solution à tester dans un bécher : remplissez environ la moitié du récipient
 TRAVAUX PRATIQUES DE CHIMIE DES SOLUTIONS - univ-chlefdz
TRAVAUX PRATIQUES DE CHIMIE DES SOLUTIONS - univ-chlefdz
Un compte-rendu n'est pas une simple fiche de résultats Il doit être rédigé et structuré Un compte-rendu doit contenir une introduction une partie expérimentale une partie résultat et une partie exploitation et conclusion (ce qui ne veut pas dire qu'un tel découpage est forcément adapté à chaque TP)
 1
1 Université de Batna 2
2019-2020
Faculté de Technologie
Dpt du Socle Commun Sciences et Techniques (L M D)TP chimie des solutions
TP 3 : Titrages pH-métriques
But du TP
Détermination de la concentration et la valeur de la constante d'acidité de l'acide acétique par la méthode
pH-métrique.Principe
Le titrage d'une solution acide (ou basique) consiste à déterminer la concentration apportée d'acide (ou de
base) dans cette solution. Pour cela, on réalise le titrage d'un volume précis de la solution de concentration
inconnue d'acide (ou de base) par une solution de base (ou d'acide), de concentration connue, afin de
déterminer l'équivalence.Au cours d'un dosage pH-métrique, On mesure le pH de la solution titrée pour chaque volume de solution
titrante versée.Afin de pouvoir représenter des points expérimentaux régulièrement répartis, il faut ajouter la
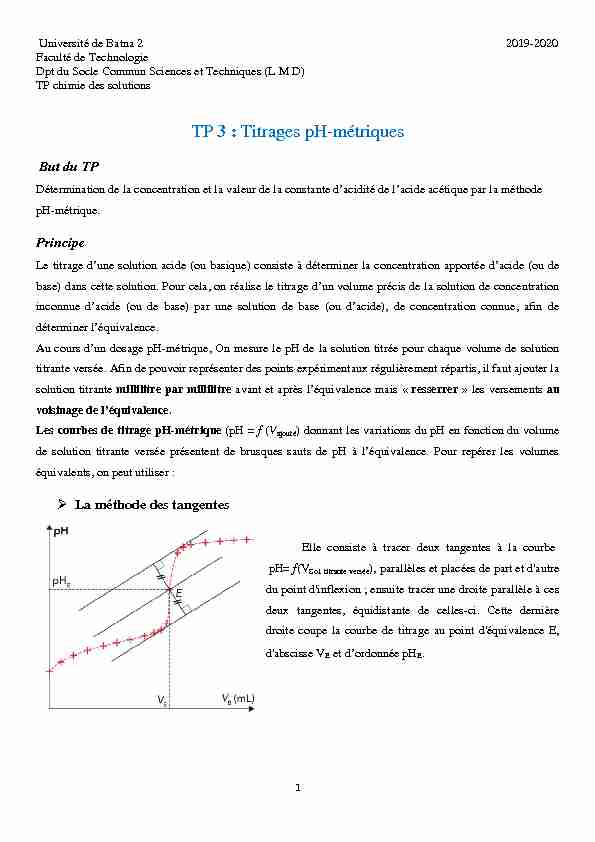
solution titrante millilitre par millilitre avant et après l'équivalence mais " resserrer » les versements au voisinage de l'équivalence. Les courbes de titrage pH-métrique (pH = f (Vajouté ) donnant les variations du pH en fonction du volumede solution titrante versée présentent de brusques sauts de pH à l'équivalence. Pour repérer les volumes
équivalents, on peut utiliser : La méthode des tangentes Elle consiste à tracer deux tangentes à la courbe pH= f(VSol. titrante versée ), parallèles et placées de part et d'autre du point d'inflexion ; ensuite tracer une droite parallèle à ces deux tangentes, équidistante de celles-ci. Cette dernière droite coupe la courbe de titrage au point d'équivalence E, d'abscisse VE et d'ordonnée pH E 2La méthode de la courbe dérivée
Il suffit de représenter, sur la courbe de titrage, la courbe = f(VSol. titrante versée
). L'abscisse de l'extremum de cette courbe correspond au volume V E de solution titrante versée à l'équivalence.Partie expérimentale
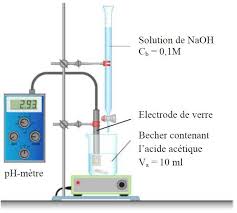
1.Matériels et produits
- Burette graduée ; - pH-mètre- Bécher de 100 mL ; - Solution d'hydroxyde de sodium NaOH à 0.1 mol/L.
- Agitateur magnétique ; - Solution d'acide acétique CH 3 COOH 2.Mode opératoire
Avant de réaliser le titrage,
effectuer une dilution au 1/10 du vinaigre commercial - Introduire, dans une burette, la solution aqueuse d"hydroxyde de sodium (NaOH) de concentration molaire connue C b = 0,1 mol/l. - Prélever 10 ml de la solution d'acide acétique diluée les verser dans un bécher de 150 ml et ajouter environ 25ml d'eau distillée. - Placer le bécher sous la burette. Y plonger la sonde pH-métrique ; - Mettre en place l'agitateur magnétique et le barreau magnétique ; - Effectuer le titrage de ces 10 ml de la solution diluée en versant, millilitre par millilitre, le réactif titrant ( NaOH de concentration Cb = 0,1M) dans le bécher. - A chaque ajout, relever dans un tableau le volume de solution titrante versée et le pH de la solution. 3
Compte rendu du TP n°2:
Nom...............
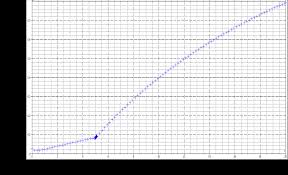
Prénom................................Groupe...... ...........Sous groupe Les résultats expérimentaux sont rassemblés dans le tableau suivant : a) Tracer la courbe pH = f (v) et déterminer ࢂ de la solution d'hydroxyde de sodium versé à l'équival ence b) Quelles particularités de la courbe indiquent que l'on a affaire à un acide faible ? c) Déterminer à l'aide de la courbe la valeur du pKa de l'acide utilisé.d) Déterminer la concentration initiale de la solution d'acide éthanoïque diluée. Retrouver par le
calcul la valeur du pH à l'équivalence. On démontrera les formules nécessaires.Volume de
NaOH versée
0 1,0 3,0 6,0 9,0 9,5 9,9 10,0 10,1 11,0
pH de la solution2,9 3,8 4,4 5,0 5,8 6,1 6,8 8,7 10,7 11,7
4 e) Quelle est la concentration molaire de l'acide éthanoïque dans le vinaigre commercial ?f) Quel est le degré d'acidité du vinaigre dosé? (masse en grammes d'acide éthanoïque pur
contenu dans de vinaigre).La Masse volumique
du vinaigre : = 1,02g.ࢉ g) En mélangeant judicieusement des solutions d'acide éthanoïque(CH 3 COOH) et d'hydroxyde de Sodium (NaOH), on peut réaliser des solutions " tampon » acide-base. Définir ce type de solution, et le pouvoir tampon de telles solutions. De quels facteurs dépend le pouvoir tampon d'une solution ? Justifier.h) On donne, pour les indicateurs colorés suivants, les zones de virage et les couleurs des formes
acides et basiques.Zone de virage Teinte Acide Teinte basique
Hélianthine 3,2 - 4,4 Rouge Jaune
Bleu de bromothymol 6,0 - 7,6 Jaune Bleu
Para-nitrophénol 5,4 - 6,6 Incolore Jaune
phénolphtaleine 8,2 - 10 Incolore RoseComment doit
-on choisir et utiliser un indicateur coloré pour un dosage acido-basique ? Quel(s) est (sont) celui (ceux) qui convient (conviennent) dans la liste ci -dessus ?quotesdbs_dbs2.pdfusesText_2[PDF] compte rendu tp redressement simple alternance
[PDF] compte rendu tp refraction de la lumiere
[PDF] compte rendu tp saponification
[PDF] compte rendu type de réunion
[PDF] compte usager bibliothèque paris
[PDF] comptes spéciaux du trésor maroc
[PDF] compteur electrique steg tunisie
[PDF] compteur electronique monophasé domestique me345
[PDF] compteur electronique monophasé domestique: me345
[PDF] comptine en anglais cycle 3
[PDF] comptine en anglais maternelle
[PDF] comptine en anglais maternelle youtube
[PDF] comptine souris maternelle
[PDF] comptine ver de terre
