 La chimie
La chimie
• chaque colonne (groupe) du tableau périodique moderne partage la même • le rayon ionique est le rayon d'un cation ou d'un anion. • lorsqu'un atome ...
 Untitled
Untitled
tableau périodique. 4. Energie de la première ionisation. * L'énergie de lère ionisation diminue lorsque le rayon atomique augmente: plus l'électron de.
 Architecture de la matière
Architecture de la matière
Figure 2 : évolution du rayon atomique pour les 3 premières périodes. Figure 3 : évolution du rayon atomique dans la classification. Source : CHIMIE 3ème
 Chapitre III LES CRISTAUX IONIQUES
Chapitre III LES CRISTAUX IONIQUES
Les rayons ioniques de tous les éléments du tableau périodique déterminés rayons cristallins (meilleure approche que le rayon ionique). Coordinence. 4. 6. 8.
 LES ELEMENTS DU GROUPE 2 - LES METAUX ALCALINO
LES ELEMENTS DU GROUPE 2 - LES METAUX ALCALINO
Rayon atomique et rayon ionique / C. Densité point de fusion et point d Les métaux alcalino-terreux sont les éléments du 2e groupe du tableau périodique.
 CRISTALLOGRAPHIE
CRISTALLOGRAPHIE
6). À partir du rayon atomique (Ti) du titane dans le tableau de données ci-dessous déterminer quel serait le paramètre de maille ′ si l'empilement du
 Tableau périodique et périodicité
Tableau périodique et périodicité
Rayon ionique: Rayons des ions (en Armstroeng) en fonction du numéro atomique. Rayon atomique: Rayons des atomes isolés (en.
 Cours 3. Classification géochimique des éléments
Cours 3. Classification géochimique des éléments
Classification des éléments en traces selon leur position dans le tableau périodique Les éléments à fort rayon ionique et à faible charge sont appelés : LILE ...
 REPUBLIQUE ALGERIENNE DEMOCRATIQUE ET POPULAIRE
REPUBLIQUE ALGERIENNE DEMOCRATIQUE ET POPULAIRE
%20%20V%20.pdf
 Architecture de la matière
Architecture de la matière
A – DEFINITION DU RAYON IONIQUE le tableau périodique est la meilleure des ... éléments chimiques tous regroupés dans un tableau périodique ...
 I. Propriétés des éléments dans un groupe et dans une période
I. Propriétés des éléments dans un groupe et dans une période
I. Tableau périodique des éléments Cette propriété périodique est directement reliée à ... Chez les ions positifs le rayon ionique est plus petit.
 La chimie
La chimie
chaque colonne (groupe) du tableau périodique moderne partage la même le rayon ionique est le rayon d'un cation ou d'un anion.
 Le tableau périodique
Le tableau périodique
Périodicité des propriétés physiques. • Le rayon atomique. • Le rayon ionique. • L'énergie d'ionisation. • L'électronégativité. • Le point de fusion
 Présentation PowerPoint
Présentation PowerPoint
V : Propriétés physiques et chimiques et tableau périodique. V.1. Propriétés physiques. V.1.b. Le rayon ionique. Ion : atome ou groupe d'atome dont la
 Untitled
Untitled
Le tableau périodique reste le moyen le plus important de comparaison Le rayon atomique diminue en traversant une période de gauche à.
 Architecture de la matière
Architecture de la matière
A – DEFINITION DU RAYON IONIQUE éléments chimiques tous regroupés dans un tableau périodique parfaitement ordonné. Le Plan du cours ...
 Chapitre 3: Classification périodique des éléments
Chapitre 3: Classification périodique des éléments
ces ions sont appelés rayons ioniques. Pour des ions ayant la même charge le rayon ionique ri varie dans le tableau périodique comme le rayon atomique.
 Après latome dhydrogène Les atomes polyélectronique
Après latome dhydrogène Les atomes polyélectronique
Le tableau périodique Le rayon covalent (1/2 de la distance entre 2 atomes dans une molécule ou dans une solide) ... Rayon atomique versus rayon ionique.
 CRISTALLOGRAPHIE
CRISTALLOGRAPHIE
Relier le rayon métallique covalent
 Tendances du rayon ionique dans le tableau périodique
Tendances du rayon ionique dans le tableau périodique
Le rayon atomique • en allant de gauche à droite les rayons atomiques des éléments tendent à devenir plus petits • le plus petit rayon atomique est dû à l’augmentation de la charge nucléaire effective en allant de gauche à droite • les électrons de valence sont retenus plus près du noyau par sa plus grande
 Chapitre 3: Classification périodique des éléments
Chapitre 3: Classification périodique des éléments
L a première classification périodique a été établie bien avant que la structure électronique des éléments ne soit connue Mendeleïev a disposé (1869) dans un tableau les 68 éléments connus à l’époque en se basant sur la relation entre le poids atomique et les propriétés chimiques
 Chap V : Propriétés physiques et chimiques et tableau périodique
Chap V : Propriétés physiques et chimiques et tableau périodique
Chap V : Propriétés physiques et chimiques et tableau périodique V 1 Propriétés physiques V 1 b Le rayon ionique Ion : atome ou groupe d’atome dont la charge est devenue positive (ou négative) à la suite de la perte (ou de la capture) d’un ou de plusieurs électrons
 Searches related to rayon ionique tableau périodique PDF
Searches related to rayon ionique tableau périodique PDF
Le rayon ionique augmente le long d'une colonne du tableau périodique Pour des ions isoélectroniques c'est-à-dire qui possèdent la même con guration électronique il diminue de gauche à droite du tableau comme le rayon atomique En n pour un même élément le rayon ionique d'un anion est généralement plus grand que le rayon atomique
Qu'est-ce que le rayon ionique dans le tableau périodique ?
Le rayon ionique des éléments présente des tendances dans le tableau périodique. En général: Le rayon ionique augmente à mesure que vous vous déplacez de haut en bas sur le tableau périodique. Le rayon ionique diminue à mesure que vous vous déplacez dans le tableau périodique, de gauche à droite.
Comment calculer le rayon ionique ?
Mesuré à partir de la distance entres cations et anions d'un cristal ionique. Le rayon est exprimé en pm (pico mètre = 10 -12 m). Le rayon ionique caractérise, comme tout rayon, le volume occupé par les électrons du nuage électronique, sauf que pour les ions, le nombre d'électron diffère de la forme neutre, ce qui explique deux phénomènes inverses:
Quelle est la différence entre rayon ionique et rayon atomique ?
Bien que rayon ionique et rayon atomique ne signifient pas exactement la même chose, la tendance s'applique au rayon atomique ainsi qu'au rayon ionique. Le rayon ionique est la moitié de la distance entre les ions atomiques dans un réseau cristallin. Pour trouver la valeur, les ions sont traités comme s'ils étaient des sphères dures.
Comment les rayons atomiques varient-ils ?
Les rayons atomiques varient de manière prévisible lorsqu'on se déplace dans le tableau périodique. Par exemple, les rayons diminuent en général le long d'une période (rangée) de la table depuis les alcalins jusqu'aux gaz nobles; et augmentent lorsqu'on descend une colonne.
Le tableau
périodiqueChimie 11
2Un lent développement
similarités entre le calcium, le strontium et le baryum •Newlands (1837-1898) : loi des octaves lien entre la masse et les propriétés des éléments •Mendeleev (1834-1907) : la périodicité des propriétés publication du premier tableau périodique des éléments •Moseley (1887-1915) : le nombre atomique rangement par nombre atomique croissant3Le tableau périodique
4Le tableau périodique
5Propriétés du tableau périodique
•La classification des 118 éléments est faite suivant le numéro atomique une période = une rangée une famille = une colonne •18 familles regroupant des éléments ayant des propriétés chimiques semblables. -Colonne 1 : les métaux alcalins -Colonne 17 : les halogènes -Colonne 18 : les gaz nobles. •Les colonnes donnent le nombre d'électrons de valence (#colonne -10 pour les colonnes 13 à 18)6Métaux, non-métaux et métalloïdes
Métaux
-ductiles -malléables -brillants -bons conducteursélectriques
-bons conducteurs thermiques -solidesNon-métaux -non ductiles -non malléables -mats -mauvais conducteursélectriques
-mauvais conducteurs thermiques -solides, liquides ou gazMétalloïdes7Propriétés
•Réagissent avec les acides •Forment des cationsEx : Na+, Mg2+
•Forment des oxydes basiquesMgO + H2O ➔Mg(OH)2
•Forment des halogénures ioniquesNaCl •Ne réagissent pas avec
les acides •Forment des anionsEx : Cl-, S2-
•Forment des oxydes acidesSO3 + H2O ➔ H2SO4
•Forment des halogénures covalentsCCl4Propriétés
intermédiaires8Exemples
fer zincor plombchlorecarbone soufrebromenéon9Les métalloïdes
•Éléments chimiques dont les propriétés physiques et chimiques sont intermédiaires entre les métaux et les non- métaux •Bore, Silicium, Germanium,Arsenic, Antimoine, Tellure,
Astatine
•semi-conducteurs10Tableau et orbitales
11NiCl2• 6 H2O
Bleu de prusse Fe4[Fe(CN)6]3Les métaux de transitionIls ont tous des propriétés physiques
et chimiques semblables indépendamment de la colonne où ils se trouvent : -Points de fusion et d'ébullitionélevés, masses volumiques
importantes -Forment plusieurs cations stables et des ions complexes covalents.Ex : Fe2+ et Fe3+, AuCl4─,
Fe(CN)63─
-Forment des solutions et des composés colorés12-Peu réactifs avec l'eau
-Agissent souvent comme catalyseurs -Peuvent être combinés avec d'autres métaux pour former des alliages •bronze = cuivre + étain •Laiton = cuivre + zinc •Amalgame = mercure + or/cuivre/argentLes métaux de transitionAmalgame dentaire
Médaille de bronzeRaccord en laiton
13-Remplissage des orbitales f
-Parfois improprement appelés "terres rares" -Lanthanides : Lanthane (57) auLutétium (71)
-Actinides : Actinium (89) auLawrencium (103) ; tous les actinides
plus lourds que l'uranium ont été générés artificiellement et sont radioactifs.Les lanthanides et les actinides14Périodicité des propriétés physiques
•Le rayon atomique •Le rayon ionique •L'énergie d'ionisation •L'électronégativité •Le point de fusion15Le rayon atomique
•En théorie, le rayon d'un atome est la distance du noyau aux électrons de la couche la plus externe. •En pratique, les mesures sont variables16Tendances
Deux facteurs déterminent la taille d'un atome : •La charge nucléaire : la force électrostatique va attirer lesélectrons vers le noyau donc le rayon diminue
•L'effet d'écran : les électrons des couches intermédiaires repoussent les électrons des couches supérieures donc le rayon augmente Plus on descend le long d'une période plus le rayon diminue la charge nucléaire augmente et l'attraction entre protons etélectrons augmente
Plus on descend le long d'une famille plus le rayon augmente Des couches se rajoutent et l'effet d'écran augmente17Tableau et rayonLe rayon diminue le long d'une période et augmente le long
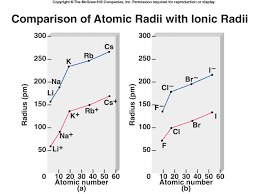
d'une famille18Rayons ioniques
•Les cations : -Ils perdent une couche donc ils sont plus petits que l'atome correspondant -À travers une période, il y a plus de protons, la force d'attraction est plus grande et le rayon plus petit. •Les anions : -Ils complètent une couche donc ils sont plus gros que l'atome correspondant. -À travers une période, il y a plus de protons, la force d'attraction est plus grande et le rayon plus petit.19Les espèces isoélectroniques
Les espèces isoélectroniques sont des atomes et des ions qui ont le même nombre d'électrons. Plus la charge nucléaire est élevée, plus les forces attractives sont fortes, plus le rayon est petit.EspècesNa+Mg2+Al3+
Charge du noyau+11+12+13
Nombre d'électrons101010
Rayon ionique986545
20L'énergie de première ionisation
L'énergie de première ionisation : énergie minimale requise pour arracher une mole d'électrons à une mole d'atome à l'état gazeux aux conditions standards (25°C, 1 atm) -Elle diminue le long d'une famille (haut vers la bas) car les électrons sont de plus en plus éloignés du noyau -Elle augmente le long d'une période (gauche vers droite) car la force d'attraction du noyau est plus forte -Les gaz rares sont très stables : énergie d'ionisation très élevée21Ionisation et table
L'énergie de première ionisation diminue le long d'une famille et augmente le long d'une période22L'affinité électronique
L'affinité électronique est le changement d'enthalpie quand une mole d'électron est ajoutée à une mole d'atomes à l'état gazeux et dans des conditions standards (25°C, 1 atm). •Il s'agit d'un processus généralement exothermique. •L'exothermie augmente le long d'une période car le rayon diminue • L'exothermie diminue le long d'une famille car le rayon augmente23L'électronégativité
L'électronégativité : tendance d'un atome à attirer vers lui les électrons du doublet liant dans une liaison covalente. Elle est mesurée sur l'échelle de Pauling qui va de 0 à 4. Elle peut être utilisée comme une mesure du caractère métallique d'un élément. •Elle augmente le long d'une période car le rayon diminue • Elle diminue le long d'une famille car le rayon augmente •Les trois éléments les plus électronégatifs sont F, le fluor,N, l'azote et O, l'oxygène.
24Vrai ou Faux ?
•L'atome de germanium est plus gros que celui du silicium mais le silicium a une plus forte énergie de première ionisation. •Le sélénium a une énergie de première ionisation et une électronégativité plus fortes que le soufre. •L'antimoine a une énergie de première ionisation et une électronégativité plus fortes que l'étain. •Cl- est plus gros que Cl mais Se2- est plus petit que Se. •L'iode a une électronégativité plus forte que le tellure mais moins forte que le brome.25Les métaux alcalins
Li, Na, K, Rb, Cs, Fr
1 seul e- de valence
-Très réactifs : perdent unélectron
-Sont conservés dans de la paraffine ou de l'huile pouréviter le contact avec l'air
-La réactivité augmente avec la taille26Les métaux alcalins
Alcalin = basique
-Réaction avec l'eau : production d'hydroxyde2 Li(s) + 2 H2O(l) ➔ 2 Li+(aq) + 2 OH-(aq) + H2(g)
-Réaction avec les halogènes : production de sel2 Na(s) + Cl2(g)
➔ 2 NaCl(s)27Le point de fusionPoint de fusion :
température à laquelle les phases solide et liquide coexistent à l'équilibreGroupe 1 : les métaux alcalinsLa température de fusion
diminue le long du groupe.Les atomes métalliques sont
maintenus par des liaisons métalliques.Les atomes sont plus gros et
les liaisons métalliques sont moins fortes.28Les halogènes
F, Cl, Br, I, At
-Molécules diatomiques -7 électrons de valence -Très réactifs : essaient de gagner unélectron pour former un ion
halogénure : F─, Cl─, Br─, I─ -la réactivité diminue avec la tailleBromure de potassiumChloreIode ou brome
29Les halogènes
Réactions de déplacement :
-Le chlore est un oxydant plus fort que le brome qui est lui-même plus fort que l'iodeCl2(aq) + 2 Br-(aq) ➔ 2 Cl-(aq) + Br2(aq)
Br2(aq) + 2 I-(aq)
➔ 2 Br-(aq) + I2(aq)30Les halogènes
Test de présence d'un ion halogénure avec du nitrate d'argent:Ag+(aq) + X-(aq) ➔ AgX(s)
AgCl = blanc, AgBr = crème, AgI = jaune
Les halogénures d'argent sont
à la base de la photographie AgI AgBr AgCl AgF31Le point de fusion
Groupe 7 : les halogènes
La température de fusion
augmente le long du groupe.Les molécules diatomiques
sont maintenues par des forces de Van der Waals.Les molécules sont plus
grosses et les forces intermoléculaires sont plus fortes.32Les oxydes de la période 3
Les oxydes métalliques ont tendance à être basiques.MgO(s) + H2O(l)
Les oxydes non métalliques ont tendance à être acides.SO3(g) + H2O(l)
P4O10(s) + 6 H2O(l)
quotesdbs_dbs35.pdfusesText_40[PDF] énergie de première ionisation calcul
[PDF] l'ancien régime et la révolution résumé
[PDF] la morphologie en linguistique
[PDF] énergie d'ionisation calcul
[PDF] morphologie flexionnelle et dérivationnelle
[PDF] morphologie des mots exercices
[PDF] cours de morphologie linguistique pdf
[PDF] analyse morphologique des mots exercices
[PDF] fin de l'ancien régime
[PDF] morphologie flexionnelle et dérivationnelle pdf
[PDF] la morphologie lexicale
[PDF] morphologie des insectes pdf
[PDF] classification des insectes pdf
[PDF] biologie des insectes pdf
