 La chimie
La chimie
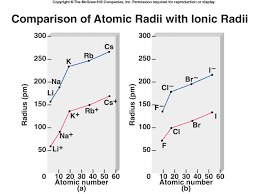
• chaque colonne (groupe) du tableau périodique moderne partage la même • le rayon ionique est le rayon d'un cation ou d'un anion. • lorsqu'un atome ...
 Untitled
Untitled
tableau périodique. 4. Energie de la première ionisation. * L'énergie de lère ionisation diminue lorsque le rayon atomique augmente: plus l'électron de.
 Architecture de la matière
Architecture de la matière
Figure 2 : évolution du rayon atomique pour les 3 premières périodes. Figure 3 : évolution du rayon atomique dans la classification. Source : CHIMIE 3ème
 Chapitre III LES CRISTAUX IONIQUES
Chapitre III LES CRISTAUX IONIQUES
Les rayons ioniques de tous les éléments du tableau périodique déterminés rayons cristallins (meilleure approche que le rayon ionique). Coordinence. 4. 6. 8.
 Le tableau périodique
Le tableau périodique
• Le rayon atomique. • Le rayon ionique. • L'énergie d'ionisation. • L'électronégativité. • Le point de fusion. Page 15. 15. Le rayon atomique. • En théorie le
 LES ELEMENTS DU GROUPE 2 - LES METAUX ALCALINO
LES ELEMENTS DU GROUPE 2 - LES METAUX ALCALINO
Rayon atomique et rayon ionique / C. Densité point de fusion et point d Les métaux alcalino-terreux sont les éléments du 2e groupe du tableau périodique.
 CRISTALLOGRAPHIE
CRISTALLOGRAPHIE
6). À partir du rayon atomique (Ti) du titane dans le tableau de données ci-dessous déterminer quel serait le paramètre de maille ′ si l'empilement du
 Tableau périodique et périodicité
Tableau périodique et périodicité
Rayon ionique: Rayons des ions (en Armstroeng) en fonction du numéro atomique. Rayon atomique: Rayons des atomes isolés (en.
 Cours 3. Classification géochimique des éléments
Cours 3. Classification géochimique des éléments
Classification des éléments en traces selon leur position dans le tableau périodique Les éléments à fort rayon ionique et à faible charge sont appelés : LILE ...
 REPUBLIQUE ALGERIENNE DEMOCRATIQUE ET POPULAIRE
REPUBLIQUE ALGERIENNE DEMOCRATIQUE ET POPULAIRE
%20%20V%20.pdf
 Architecture de la matière
Architecture de la matière
A – DEFINITION DU RAYON IONIQUE le tableau périodique est la meilleure des ... éléments chimiques tous regroupés dans un tableau périodique ...
 I. Propriétés des éléments dans un groupe et dans une période
I. Propriétés des éléments dans un groupe et dans une période
I. Tableau périodique des éléments Cette propriété périodique est directement reliée à ... Chez les ions positifs le rayon ionique est plus petit.
 La chimie
La chimie
chaque colonne (groupe) du tableau périodique moderne partage la même le rayon ionique est le rayon d'un cation ou d'un anion.
 Le tableau périodique
Le tableau périodique
Périodicité des propriétés physiques. • Le rayon atomique. • Le rayon ionique. • L'énergie d'ionisation. • L'électronégativité. • Le point de fusion
 Présentation PowerPoint
Présentation PowerPoint
V : Propriétés physiques et chimiques et tableau périodique. V.1. Propriétés physiques. V.1.b. Le rayon ionique. Ion : atome ou groupe d'atome dont la
 Untitled
Untitled
Le tableau périodique reste le moyen le plus important de comparaison Le rayon atomique diminue en traversant une période de gauche à.
 Architecture de la matière
Architecture de la matière
A – DEFINITION DU RAYON IONIQUE éléments chimiques tous regroupés dans un tableau périodique parfaitement ordonné. Le Plan du cours ...
 Chapitre 3: Classification périodique des éléments
Chapitre 3: Classification périodique des éléments
ces ions sont appelés rayons ioniques. Pour des ions ayant la même charge le rayon ionique ri varie dans le tableau périodique comme le rayon atomique.
 Après latome dhydrogène Les atomes polyélectronique
Après latome dhydrogène Les atomes polyélectronique
Le tableau périodique Le rayon covalent (1/2 de la distance entre 2 atomes dans une molécule ou dans une solide) ... Rayon atomique versus rayon ionique.
 CRISTALLOGRAPHIE
CRISTALLOGRAPHIE
Relier le rayon métallique covalent
 Tendances du rayon ionique dans le tableau périodique
Tendances du rayon ionique dans le tableau périodique
Le rayon atomique • en allant de gauche à droite les rayons atomiques des éléments tendent à devenir plus petits • le plus petit rayon atomique est dû à l’augmentation de la charge nucléaire effective en allant de gauche à droite • les électrons de valence sont retenus plus près du noyau par sa plus grande
 Chapitre 3: Classification périodique des éléments
Chapitre 3: Classification périodique des éléments
L a première classification périodique a été établie bien avant que la structure électronique des éléments ne soit connue Mendeleïev a disposé (1869) dans un tableau les 68 éléments connus à l’époque en se basant sur la relation entre le poids atomique et les propriétés chimiques
 Chap V : Propriétés physiques et chimiques et tableau périodique
Chap V : Propriétés physiques et chimiques et tableau périodique
Chap V : Propriétés physiques et chimiques et tableau périodique V 1 Propriétés physiques V 1 b Le rayon ionique Ion : atome ou groupe d’atome dont la charge est devenue positive (ou négative) à la suite de la perte (ou de la capture) d’un ou de plusieurs électrons
 Searches related to rayon ionique tableau périodique PDF
Searches related to rayon ionique tableau périodique PDF
Le rayon ionique augmente le long d'une colonne du tableau périodique Pour des ions isoélectroniques c'est-à-dire qui possèdent la même con guration électronique il diminue de gauche à droite du tableau comme le rayon atomique En n pour un même élément le rayon ionique d'un anion est généralement plus grand que le rayon atomique
Qu'est-ce que le rayon ionique dans le tableau périodique ?
Le rayon ionique des éléments présente des tendances dans le tableau périodique. En général: Le rayon ionique augmente à mesure que vous vous déplacez de haut en bas sur le tableau périodique. Le rayon ionique diminue à mesure que vous vous déplacez dans le tableau périodique, de gauche à droite.
Comment calculer le rayon ionique ?
Mesuré à partir de la distance entres cations et anions d'un cristal ionique. Le rayon est exprimé en pm (pico mètre = 10 -12 m). Le rayon ionique caractérise, comme tout rayon, le volume occupé par les électrons du nuage électronique, sauf que pour les ions, le nombre d'électron diffère de la forme neutre, ce qui explique deux phénomènes inverses:
Quelle est la différence entre rayon ionique et rayon atomique ?
Bien que rayon ionique et rayon atomique ne signifient pas exactement la même chose, la tendance s'applique au rayon atomique ainsi qu'au rayon ionique. Le rayon ionique est la moitié de la distance entre les ions atomiques dans un réseau cristallin. Pour trouver la valeur, les ions sont traités comme s'ils étaient des sphères dures.
Comment les rayons atomiques varient-ils ?
Les rayons atomiques varient de manière prévisible lorsqu'on se déplace dans le tableau périodique. Par exemple, les rayons diminuent en général le long d'une période (rangée) de la table depuis les alcalins jusqu'aux gaz nobles; et augmentent lorsqu'on descend une colonne.
V.1. Propriétés physiques
V.1.b. Le rayon ionique
Ion : atome ou groupe d'atome dont la charge est devenue positive (ou négative) à la suite de la perte (ou de la capture) d'un ou de plusieursélectrons.
Cation : charge positive et anion : charge négative rcation < ratome ranion > ratomeV.1.c. Energie d'ionisation (E.I.)
XgazXgaz+e-E.I.V.1.a. Le rayon atomique Dans une même colonne quand on change de période n↗ d'une unité, le volume effectif de l'atome croît brusquement → dans une même colonne r↗ quand n↗. Au sein d'une même période il y a contraction des O.A. (r ↘) de gauche à droite. Energie d'ionisation : l'énergie qu'il faut fournir à l'atome gazeux pour lui arracher un électron (E.I. > 0) Au sein d'une même période : E.I. ↗ quand Z ↗. Au sein d'une même colonne : E.I. ↘ quand Z ↗. ⇒ E.I. varie en raison inverse du rayon atomique Energie d'attachement électronique : l'énergie libérée lorsqu'il y a capture par l'atome gazeux d'un électron, elle peut être > 0 ou < 0. L'affinité électronique A.E. est l'opposée de l'énergie d'attachementélectronique ⇒ A.E. > 0 ou < 0.Chap. V : Propriétés physiques et chimiques et tableau périodique
V.1.d. Affinité électronique (A.E.)
Xgaze-Xgaz-A.E.
Exemple :Cl gaz + e- ⇒ Cl- gaz A.E. = + 3,61 eVO gaz + e- ⇒ O-
gaz A.E. = + 1,47 eV Les éléments de plus forte A.E. se trouvent en haut à droite du tableau, A.E. a tendance à ↗ de gauche à droite (mais on observe de nombreuses irrégularités).Exemples d'irrégularités :
Les alcalins (ns1) cherchent à saturer leur sous-couche s pour donner la structure ns2 (plus stable), bien que situés à gauche dans le tableau périodique, ils ont alors, des A.E. > 0. Les éléments de la colonne de l'azote (ns2 np3), ils possèdent une certaine stabilité (sous-couche à moitié remplie).L'azote bien que situé à droite dans le tableau a une A.E. < 0.Chap. V : Propriétés physiques et chimiques et tableau périodique
V.1.e. Electronégativité (χ) d'un élément chimique et énergie de liaison EA-B Les caractéristiques (E.I. et A.E.) d'un élément sont rassemblées dans le concept d'électronégativité. l'électronégativité (χ) traduit la capacité d'un élément à attirer lesélectrons dans un doublet de liaison.Chap. V : Propriétés physiques et chimiques et tableau périodique
Un élément attracteur est dit électronégatif et possède un χ élevé. Un élément donneur est dit électropositif et χ est faible. Sur une même ligne : χ↗ lorsque Z↗ Sur une même colonne : χ↘ lorsque Z↗Plusieurs méthodes de détermination des
électronégativités des éléments.
L'échelle de PAULING (la plus utilisée) construite àpartir des énergies de liaison. Chap. V : Propriétés physiques et chimiques et tableau périodique
Energie de liaison EA-B : l'énergie qu'il faut fournir au composé A-Bgaz pour casser la liaison et obtenir 2 atomes gazeux séparés : EA-B > 0.A-BgazAgazBgazEA-B
Création d'une échelle en attribuant par convention la valeur χH = 2,10 à l'hydrogène. Plus la différence d'électronégativité entre 2 atomes est grande, plus le nuage électronique qui relie les 2 atomes est déformé... plus laliaison est dite polarisée. Chap. V : Propriétés physiques et chimiques et tableau périodique
V.1.f. Le caractère métallique
Métal : Solide cristallin possédant de bonnes propriétés : électriques, thermiques, mécaniques et optiques (électrons externes peu liés). Le caractère métallique ↘ dans une période quand Z↗. Le caractère métallique ↗ dans une colonne quand n↗ (électrons externes de - en - liés).V.2. Propriétés chimiques
Elles sont dues aux électrons
de la couche externe dits électrons de valence. Chap. V : Propriétés physiques et chimiques et tableau périodiqueCas des éléments les plus à gauche :
Les ions issus des colonnes 1, 2 et 13 présentent des d° d'oxydation positifs respectivement +I, +II et +III.Ils cherchent à prendre la structure du gaz rare qui les précèdent.V.2.a. Degré d'oxydation
Cas des éléments les plus à droite :
Les ions issus des colonnes 16 et 17 présentent des d° d'oxydation négatifs, respectivement -II et -I. Ils cherchent à prendre la structure du gaz rare qui les suivent. Cas des éléments au centre, autres que les éléments de transition : Comportement plus varié avec des états d'oxydation variés. Ex : l'azote dans la colonne 15 est au d° d'oxydation : -III dans NH3, 0 dans N2, +II dans NO, +IV dans NO2, +V dans HNO3.Cas des éléments de transition :
Ils donnent en général des ions positifs avec divers d° d'oxydation. Ex. :Fe2+ : d° +II et Fe3+ : d° +III. Chap. V : Propriétés physiques et chimiques et tableau périodique
V.2.b. Caractère oxydo-réducteur
OXYDANT = "GOURMAND» d'électrons
REDUCTEUR = DONNEUR d'électrons
Sur une même période le pouvoir oxydant ↗ qd Z↗ Sur une même colonne le pouvoir oxydant ↘ qd Z↗V.2.c. Caractère acido-basique des oxydes
A gauche avec les métaux très électropositifs, on obtient des oxydesBASIQUES
Ex : Na2O est un oxyde fortement ionique et donc très basique car :O2- est une base forte : O2- + H2O → 2 OH-
A droite avec les non métaux on obtient des oxydes ACIDES.Ex : SO3 SO3 + H2O → H2SO4
Intermédiairement on obtient des oxydes amphotèresChap. V : Propriétés physiques et chimiques et tableau périodique
Oxn-Réd
V.2.d. Nature des liaisons
Une combinaison stable de plus d'un atome
⇔ liaison entre les atomes.Chap. V : Propriétés physiques et chimiques et tableau périodique
Différents types de liaisons :
Lorsque χA - χB est grand (éléments situés aux 2 extrémités du tableau) ⇒ liaisons dites IONIQUES (Ex : NaCl, Na2O, CaO) Lorsque χA - χB est faible (éléments proches dans le tableau périodique). * Si les éléments sont à droite du tableau, c'est la liaison dite de covalence (Ex : H2 , SO2) * Si les éléments sont à gauche du tableau c'est la liaison métallique : les e- sont délocalisés dans l'ensemble du métalquotesdbs_dbs35.pdfusesText_40[PDF] énergie de première ionisation calcul
[PDF] l'ancien régime et la révolution résumé
[PDF] la morphologie en linguistique
[PDF] énergie d'ionisation calcul
[PDF] morphologie flexionnelle et dérivationnelle
[PDF] morphologie des mots exercices
[PDF] cours de morphologie linguistique pdf
[PDF] analyse morphologique des mots exercices
[PDF] fin de l'ancien régime
[PDF] morphologie flexionnelle et dérivationnelle pdf
[PDF] la morphologie lexicale
[PDF] morphologie des insectes pdf
[PDF] classification des insectes pdf
[PDF] biologie des insectes pdf
