 Chapitre C7 Transformation en chimie organique Programme officiel
Chapitre C7 Transformation en chimie organique Programme officiel
Aspect microscopique : - Liaison polarisée site donneur et site accepteur de doublet d'électrons. - Interaction entre des sites donneurs et accepteurs de
 LCFI 44 Transformations en chimie organique : aspects
LCFI 44 Transformations en chimie organique : aspects
Transformations en chimie organique. : aspects microscopiques et macrosco- piques. Clément Montembault et Romain Granier† DER de physique
 cours 13_14 transformation chimie organique aspect macro micro
cours 13_14 transformation chimie organique aspect macro micro
Une compréhension plus approfondie peut être menée à l'échelle microscopique en étudiant les mécanismes de réactions entre les espèces chimiques. I) ASPECT
 la transformation chimique
la transformation chimique
microscopiques s'appelle un mécanisme réactionnel. I) polarisation d'une liaison Chapitre 12 : transformations en chimie organique: aspect microscopique ...
 Transformations en chimie organique : aspect microscopique
Transformations en chimie organique : aspect microscopique
Transformations en chimie organique : aspect microscopique. 1 L'électronégativité de l'atome A traduit son apti- tude à attirer vers lui le doublet
 Laurent VILLEGAS
Laurent VILLEGAS
Chapitre 14 : Transformations en chimie organique aspect microscopique. Connaissances et compétences : - Déterminer la polarisation des liaisons en lien
 CH10 Transformation organique
CH10 Transformation organique
Grandes catégories de réactions en chimie organique : substitution addition
 Séléctivité et chimioséléctivité
Séléctivité et chimioséléctivité
Structure et transformation de la matière. Notions et contenus. Compétences exigibles. Transformation en chimie organique. […] Aspect microscopique :.
 la transformation chimique
la transformation chimique
L'ensemble de ces étapes microscopiques s'appelle un mécanisme réactionnel. Chapitre 12 : transformations en chimie organique: aspect microscopique ...
 SMARTCOURS
SMARTCOURS
TS –TRANSFORMATIONS EN CHIMIE ORGANIQUE – COURS. III. ASPECT MICROSCOPIQUE. 1. Electronégativité. L'électronégativité est une grandeur qui caractérise la
 COMPRENDRE: Chapitre 12 : transformations en chimie organique
COMPRENDRE: Chapitre 12 : transformations en chimie organique
Transformation en chimie organique Notions et contenus Compétences exigibles Aspect microscopique : Déterminer la polarisation des liaisons en lien avec - Liaison polarisée site donneur et site accepteur de doublet d’électrons - Interaction entre des sites donneurs et accepteurs l’électronégativité (table fournie)
 Chapitre 5 : Interprétation microscopique d’une
Chapitre 5 : Interprétation microscopique d’une
Bernheim Transformation en chimie organique aspect microscopique 1 Chapitre 12 : Transformation en chimie organique aspect microscopique I DETERMINATION DE LA POLARISATION D’UNE MOLECULE: 1) Activité introductive : 2) Électronégativité d’un élément chimique: 3) Polarisation d’une liaison: a) Exemple du chlorure d’hydrogène:
 Partie Comprendre : Lois et modèles CHAP 12-COURS
Partie Comprendre : Lois et modèles CHAP 12-COURS
CHAP 12-COURS Transformations en chimie organique : Aspect microscopique Objectifs : Comment expliquer à l’échelle microscopique les modifications de structure qui se produisent lors d’une réaction en chimie organique ? Déterminer la polarisation de liaisons Identifier un site donneur ou accepteur de doublet d’électrons
 Transformations en chimie organique : aspect microscopique
Transformations en chimie organique : aspect microscopique
Transformations en chimie organique : aspect microscopique Comment expliquer les modifications de structure qui se produisent à l'échelle microscopique lors d'une réaction en chimie organique ? 1) Comment déterminer la polarisation d'une liaison ? 1) Électronégativité d'un élément chimique ? activité : Polarisation de liaison
 leay:block;margin-top:24px;margin-bottom:2px; class=tit physchileborgnefreefrChapitre 10 : Transformation en chimie organique
leay:block;margin-top:24px;margin-bottom:2px; class=tit physchileborgnefreefrChapitre 10 : Transformation en chimie organique
Chapitre 10 : Transformation en chimie organique Transformation en chimie organique 1 Aspect macroscopique : page 291 - Modification de chaîne modification de groupe caractéristique - Grandes catégories de réactions en chimie organique : substitution addition élimination 2 Aspect microscopique : page 307
Quelle est l’interprétation microscopique d’une transformation chimique ?
Chapitre 5 : Interprétation microscopique d’une transformation chimique Thème 1 : Organisation et transformations de la matière I. Reconnaître une transformation chimique Définition : Une transformation chimiqueest le phénomèneobservé lorsque des espèces chimiques appelées réactifs
Comment expliquer les transformations chimiques ?
Décrire et expliquer des transformations chimiques chimie : transformer la matière Chimie : la notion de pH (0 à 20 min : dès la 5ème, 20 à 30 min : 4ème et 3ème) acidification des océans et écriture collaborative pH: une évaluation formative avec un logiciel de vote mers et océans vidéo lumni "Comprendre la combustion de l’éthanol" atome hotel
Quels sont les différents types de transformations en chimie organique d’atomes de carbone?
Transformations en chimie organique d’atomes de carbone). Modifications de chaîne: On distingue trois modifications de chaîne différentes : craquage (diminution du nombre d’atomes de carbone), polymérisation (augmentation du nombre d’atomes de carbone) et reformage (conservation du nombre
Qu'est-ce que la composition chimique après transformation ?
La compositionr chimique après transformation en vue de la consommation est unraspect important de la valeur nutritive (voir chapitre 5); eller est affectée par la structure physique du grain, par desr facteurs génétiques et environnementaux, par la transformationr et autres maillons de la chaîne alimentaire.
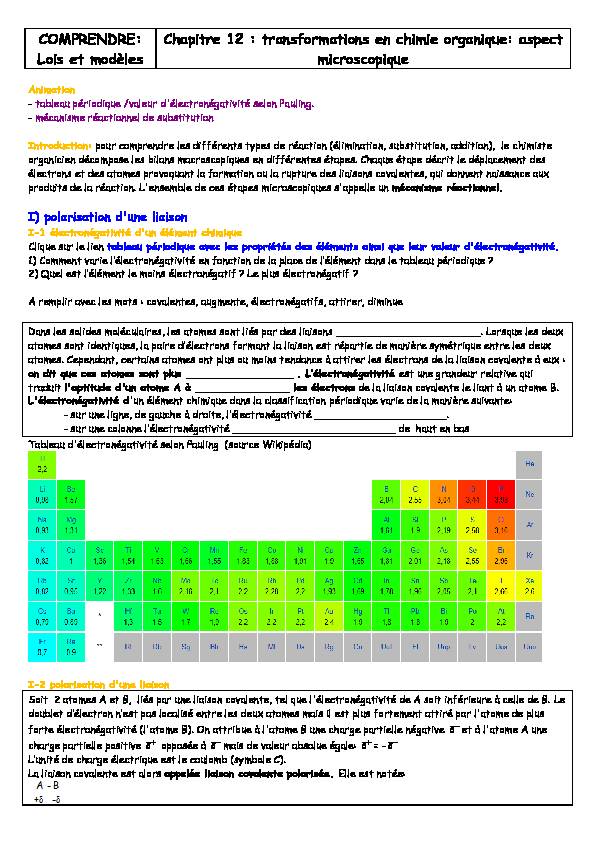
Animation
- tableau périodique /valeur d'électronégativité selon Pauling. - mécanisme réactionnel de substitutionIntroduction: pour comprendre les différents types de réaction (élimination, substitution, addition), le chimiste
organicien décompose les bilans macroscopiques en différentes étapes. Chaque étape décrit le déplacement des
électrons et des atomes provoquant la formation ou la rupture des liaisons covalentes, qui donnent naissance aux
produits de la réaction. L'ensemble de ces étapes microscopiques s'appelle un mécanisme réactionnel.
I) polarisation d'une liaison
I-1 électronégativité d'un élément chimiqueClique sur le lien tableau périodique avec les propriétés des éléments ainsi que leur valeur d'électronégativité.
1) FRPPHQP YMULH O·pOHŃPURQpJMPLYLPp en fonction GH OM SOMŃH GH O·pOpPHQP GMQV OH PMNOHMX SpULRGLTXH "
2 4XHO HVP O·pOpPHQP OH PRLQV pOHŃPURQpJMtif ? Le plus électronégatif ?
A remplir avec les mots : covalentes, augmente, électronégatifs, attirer, diminueDans les solides moléculaires, les atomes sont liés par des liaisons _______________________. Lorsque les deux
atomes sont identiquHV OM SMLUH G·pOHŃPURQV IRUPMQP OM OLMLVRQ HVP UpSMUPLH GH PMQLqUH V\PpPULTXH HQPUH OHV GHX[
atomes. Cependant, certains atomes ont plus ou moins tendance à attirer les électrons de la liaison covalente à eux :
on dit que ces atomes sont plus _________________ . I·pOHŃPURQpJMPLYLPp est une grandeur relative qui
traduit l'aptitude d'un atome A à _______________ les électrons de la liaison covalente le liant à un atome B.
L'électronégativité d'un élément chimique dans la classification périodique varie de la manière suivante:
- sXU XQH OLJQH GH JMXŃOH j GURLPH O·pOHŃPURQpJMPLYLPp _____________________. - sur une colonne O·pOHŃPURQpJMPLYLPp __________________________ de haut en bas Tableau d'électronégativité selon Pauling (source Wikipédia)I-2 polarisation d'une liaison
Soit 2 atomes A et B, liés par une liaison covalente, tel que l'électronégativité de A soit inférieure à celle de B. Le
GRXNOHP G·pOHŃPURQ Q·HVP SMV ORŃMOLVp HQPUH OHV GHX[ MPRPHV PMLV LO HVP SOXV IRUPHPHQP MPPLUp SMU O
MPRPH GH SOXV
forte électronégativité (l'atome B). On attribue à l'atome B une charge partielle négative
et à l'atome A une charge partielle positive opposée à mais de valeur absolue égale: I·XQLPp GH ŃOMUJH pOHŃPULTXH HVP OH ŃRXORPN V\PNROH FB La liaison covalente est alors appelée liaison covalente polarisée. Elle est notée:COMPRENDRE:
Lois et modèles
Chapitre 12 : transformations en chimie organique: aspect microscopiqueRemarque : 2 charges électriques, égales en valeur absolue et de signes opposés, constituent un dipôle électrique
caractérisé par un moment dipolaire PF . Le moment dipolaire à pour direction la droite passant par les centres des atomes. Il est orienté de la charge partielle négative vers la charge partielle positive.Exercice: A l'aide du tableau périodique dessiner la molécule de bromure d'hydrogène HBr et la position des
charges partielles positives et négatives. Dessiner également le moment dipolaire PF . Mêmes questions pour laPROpŃXOH G·HMXB
II) site donneur ou accepteur de doublet d'électronsII-1 représentation de Lewis d'une molécule
Au sein dH OM PROpŃXOH RQ GLVPLQJXH 2 P\SHV GH GRXNOHP G·pOHŃPURQV - le doublet liant constitué de deux électrons mis en commun dans une liaison covalente.- le doublet non liant formé de deux électrons de la couche externe des atomes. Les doublets non liant ne
participent pas aux liaisons entre atomes.IM UHSUpVHQPMPLRQ GH IHRLV SHUPHP GH UHSUpVHQPHU OHV GRXNOHPV OLMQPV HP QRQ OLMQPV G·XQH PROpŃXOHB IHV GRXNOHPV
liants se représentent par un trait entre les symboles des atomes et les doublets non liants se représentent par un
trait à côté du symbole de cet atome. Exemple : représentation de Lewis GH OM PROpŃXOH G·MPPRQLMTXH GH IRUPXOH NUXPH 1+3:(OOH ŃRPSRUPH 3 OLMLVRQV ŃRYMOHQPHV GRQŃ 3 GRXNOHPV OLMQPV HP XQ GRXNOHP QRQ OLMQP VXU O·MPRPH
I·MPRPH G·M]RPH SRVVqGH 3 GRXNOHPV OLMQPV HP XQ GRXNOHP QRQ OLMnt, il possède donc 8 électrons,
OM UqJOH GH O·RŃPHP HVP UHVSHŃPpHB
FRPPHQP pPMNOLU OM UHSUpVHQPMPLRQ GH IHRLV G·XQH PROpŃXOH "Méthode : Exemple
1) Ecrire le nom et la formule brute de la molécule. Dioxyde de carbone : CO2
2) Ecrire la configuration électronique de chaque atome. 6C : (K)2 (L)4 8O : (K)2 (L)6
3) En déduire le nombre ne G·pOHŃPURQV VXU OM ŃRXŃOH H[PHUQH GHV
atomes mis en jeu. ne (C) = 4 ne (O)=64) En déduire le nombre nl de liaisons covalentes que doit établir
O·MPRPH SRXU MŃTXpULU XQH VPUXŃPXUH HQ RŃPHP RX HQ GXHPB nl (C) = 8-4 = 4 nl (O) = 8-6=25) Calculer le nombre total nt G·pOHŃPURQV H[PHUQHV GH la molécule. En
déduire le nombre nd de doublets externes. nt = (1x4)+(2x6)=16 nd = 16/2=86) Répartir les doublets de la molécule en doublets liants et non
OLMQPV HQ UHVSHŃPMQP OHV UqJOHV GX GXHP HP GH O·RŃPHPBReprésentation de Lewis de la molécule
CO2Sinon il y a plus simple :
1) Ecrire le nom et la formule brute de la
molécule.Dioxyde de carbone : H2O
2) Ecrire la configuration électronique de
chaque atome.1H : (K)1 8O : (K)2 (L)6
3) En déduire le nombre ne G·pOHŃPURQV VXr la
couche externe des atomes mis en jeu. ne (H) = 1 ne (O) = 64) Pour les couches comprenant 8 électrons
au maximum placer un électron dans chaqueNRLPH SXLV XQ VHŃRQG V·LO HQ UHVPHB GHX[
électrons dans une boite représente un
doublet non liant. Un électron seul représente un électron célibataire qui va créer une liaisonquotesdbs_dbs2.pdfusesText_2[PDF] engagement scolaire
[PDF] relation entre prof et eleve
[PDF] pourquoi voulez vous devenir ingenieur
[PDF] pourquoi vouloir devenir ingénieur
[PDF] pourquoi choisir le métier d'ingénieur
[PDF] exercice précipitation
[PDF] pourquoi devenir ingénieur entretien
[PDF] permis scooter 50cc belgique
[PDF] exercice solubilité chimie
[PDF] réaction de précipitation exercices corrigés mpsi
[PDF] permis am belgique
[PDF] précipitation et produit de solubilité
[PDF] effet d'ions communs solubilité
[PDF] faut il un permis pour un scooter 25cc
