 Les liquides ioniques leur utilisation et leur role comme solvants de
Les liquides ioniques leur utilisation et leur role comme solvants de
Oct 29 2007 Chapitre I : Etude bibliographique : Les liquides ioniques
 Elaboration de liquides ioniques (chiraux) réversibles et
Elaboration de liquides ioniques (chiraux) réversibles et
Jan 13 2018 Le premier exemple d'un liquide ionique pour lequel la chiralité est portée par l'anion a été rapporté par Seddon en 1999.
 Liquides ioniques espoirs et raison
Liquides ioniques espoirs et raison
https://hal.archives-ouvertes.fr/hal-03011403/document
 Développement de Nouveaux Sels dimidazolium : Application du
Développement de Nouveaux Sels dimidazolium : Application du
Milieu Cristal Liquide Ionique pour la Réaction de Diels-Alder Exemples des cristaux liquides obtenus par l'introduction d'ions dans leur structure.
 Utilisation des liquides ioniques en analyse
Utilisation des liquides ioniques en analyse
Les liquides ioniques sont des sels fondus à la température ambiante dont le point de fusion doit Par exemple les points de fusion au-delà desquels les.
 Application des liquides ioniques à la valorisation des métaux
Application des liquides ioniques à la valorisation des métaux
Sep 3 2018 Résultats et discussion en milieu liquide ionique . ... d'échange d'un acide fort (par exemple pour le liquide ionique [BMIM][PF6]) et ...
 Étude physico-chimique de liquides ioniques protoniques pour piles
Étude physico-chimique de liquides ioniques protoniques pour piles
Aug 31 2010 Mots clés : PEMFC
 Utilisations originales dun liquide ionique: catalyseur et support
Utilisations originales dun liquide ionique: catalyseur et support
Prenons comme premier exemple les liquides ioniques à base du cation imidazolium propriétés du liquide ionique final.5 Par exemple un catalyseur ...
 Synthèse dun liquide ionique sulfonate & Application dans l
Synthèse dun liquide ionique sulfonate & Application dans l
Jun 6 2016 Chapitre I : Synthèse et caractérisation du liquide ionique ... la langueur de la chaine alkyle portée par le cation
 Etude thermodynamique des liquides ioniques: applications à la
Etude thermodynamique des liquides ioniques: applications à la
Mar 29 2018 21–26]. I.1.3 Synthèse et Purification des liquides ioniques. I.1.3.1 Synthèse. Dans la littérature
 Utilisation des liquides ioniques en analyse
Utilisation des liquides ioniques en analyse
Par exemple les points de fusion au-delà desquels les chlorures de sodium potassium aluminium ou calcium sont des liquides ioniques sont respectivement égaux à 801 770 190 et 782oC La plupart des molécules organiques se décomposent à de telles températures Le fait de pouvoir disposer de sels fondus à la température ambiante a ouvert
 Liquides ioniques : exercices
Liquides ioniques : exercices
A partir du liquide ionique zwittérionique A il est possible d’accéder à un liquide ionique à cation protique ; exemple : A B CF 3SO 3H 2 ) : Identifier le liquide ionique B et expliquer pourquoi l’étape A ? B n’est pas équilibrée mais totale Exercice 3 : liquides ioniques chiraux
Quels sont les liquides ioniques ?
Les liquides ioniques possèdent de très bonnes propriétés de dissolution pour la plupart des composés organiques et inorganiques. Ils sont non-inflammables (à l'exception de toute une classe de liquides ioniques dit "énergétiques", composés d'anions nitrate ou picrate, par exemple).
Comment les liquides ioniques interagissent-ils avec les solutés ?
Les liquides ioniques interagissent principalement avec les solutés via des forces de dispersion et des forces dipolaires. Les forces de dispersion sont constantes pour tous les liquides ioniques mais ce n’est pas le cas des forces dipolaires. La miscibilité de liquides ioniques avec de l'eau est particulièrement intéressante.
Quels sont les propriétés de coordination d’un liquide ionique ?
L’acidité et les propriétés de coordination d’un liquide ionique dépendent surtout de l’anion, ce qui peut paraître étonnant, car les anions sont utilisés pour fabriquer des liquides ioniques sont généralement décrits comme non-coordinants.
Quelle est la différence entre les liquides ioniques protiques et aprotiques ?
— Les liquides ioniques protiques sont bien plus polaires que les liquides ioniques aprotiques . Les liquides ioniques Propriétés des liquides ioniques — Conductivité : — Elle est moins élevée que ce à quoi on aurait pu s’attendre de la part de composés ioniques .
Recherche et développement
l'actualité chimique - janvier 200424Utilisation des liquides ioniques
en analyseAlain Berthod et Samuel Carda-Broch
Abstract Uses of ionic liquids in chemical analysisRoom temperature ionic liquids (RTIL) are salts with melting point close or below room temperature. They
form liquids in which ions are present. This fact produces interesting solvent properties. RTIL are able to
dissolve some apolar molecules as well as some very polar ones. They start to find original use in chemical
analysis. Since some RTIL are not soluble in water, they can find uses in water/RTIL extractions. The
distribution coefficients of a variety of solutes in the biphasic liquid system 1-butyl-3-methyl imidazolium
hexafluorophosphate/water is presented and discussed. RTIL were also used as electrolytes in capillary
electrophoresis. Their low volatility makes them useful as solvent working in high vacuum (MALDI matrixes)
or high temperature (GC stationary phases). Examples of such uses are given. Mots-clés Solvants organiques, liquides ioniques, utilisation en analyse. Key-words Organic solvents, ionic liquids, analytical uses.Une nouvelle classe de solvants Les liquides ioniques sont des sels fondus à la température ambiante dont le point de fusion doit être inférieur à une trentaine de degrés Celsius. Leur aspect est celui d'un liquide classique un peu visqueux, mais ils sont constitués uniquement d'ions. La structure des liquides ioniques est complètement différente de celle des solvants moléculaires classiques. Les propriétés physico-chimiques d'un solvant dépendentdes interactions entre les molécules qui le constituent. S'il ya des interactions fortes entre les molécules du solvant, on
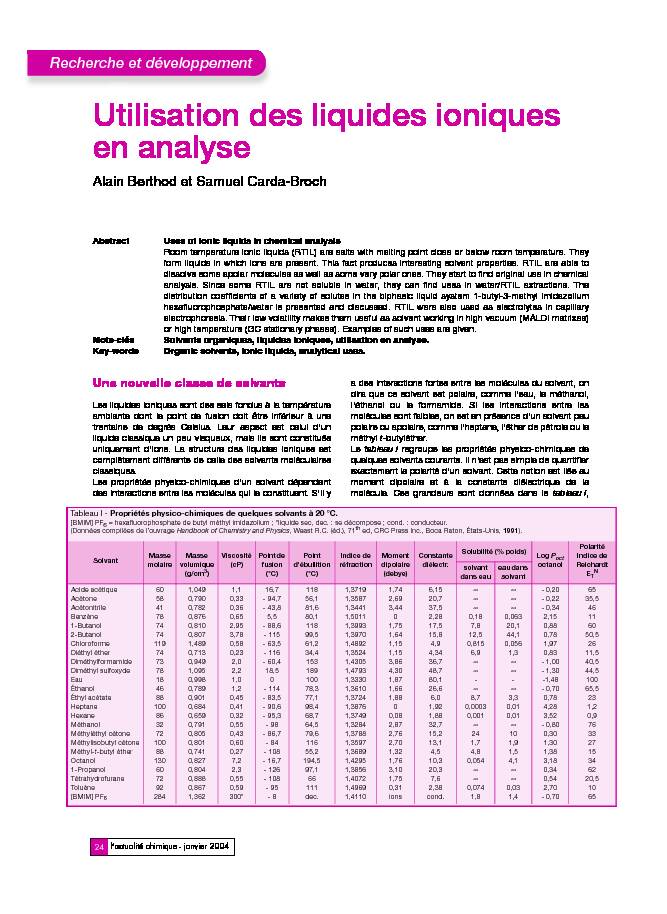
dira que ce solvant est polaire, comme l'eau, le méthanol, l'éthanol ou le formamide. Si les interactions entre les molécules sont faibles, on est en présence d'un solvant peu polaire ou apolaire, comme l'heptane, l'éther de pétrole ou le méthyl t-butyléther. Le tableau I regroupe les propriétés physico-chimiques de quelques solvants courants. Il n'est pas simple de quantifier exactement la polarité d'un solvant. Cette notion est liée au moment dipolaire et à la constante diélectrique de la molécule. Ces grandeurs sont données dans le tableau I, TableauI- Propriétés physico-chimiques de quelques solvants à 20 °C. [BMIM] PF 6= hexafluorophosphate de butyl méthyl imidazolium ; *liquide sec, dec.: se décompose ; cond. : conducteur.
(Données compilées de l'ouvrage Handbook of Chemistry and Physics, Weast R.C. (éd.), 71th ed, CRC Press Inc., Boca Raton, États-Unis, 1991).Solvant
Masse molaireMasse volumique (g/cm 3Viscosité
(cP)Point de fusion (°C)Point d'ébullition (°C)Indice de réfractionMoment dipolaire (debye)Constante diélectr.Solubilité (% poids)
Log P oct octanolPolarité
Indice de
Reichardt
ETN solvant dans eaueau dans solvantAcide acétique
Acétone
Acétonitrile
Benzène
1-Butanol
2-Butanol
Chloroforme
Diéthyl éther
Diméthylformamide
Diméthyl sulfoxyde
EauÉthanol
Éthyl acétate
Heptane
Hexane
Méthanol
Méthyléthyl cétone
Méthylisobutyl cétone
Méthyl-t-butyl éther
Octanol
1-Propanol
Tétrahydrofurane
Toluène
[BMIM] PF 6 6058
41
78
74
74
119
74
73
78
18 46
88
100
86
32
72
100
88
130
60
72
92
2841,049
0,790 0,782 0,876 0,810 0,807 1,489 0,713 0,949 1,095 0,998 0,789 0,901 0,684 0,659 0,791 0,805 0,801 0,741 0,827 0,804 0,888 0,8671,3621,1
quotesdbs_dbs2.pdfusesText_2[PDF] utilisation des liquides ioniques
[PDF] liquides ioniques chimie verte
[PDF] liquide ionique liste
[PDF] liquide ionique voiture
[PDF] synthèse des liquides ioniques
[PDF] liquide ionique electrolyte
[PDF] droite d'action d'une force définition
[PDF] réaction support plan incliné
[PDF] réaction du support formule
[PDF] réaction nucléaire uranium
[PDF] réaction nucléaire exercice
[PDF] mots croisés ce1 pdf
[PDF] réaction nucléaire cours
[PDF] hachette
