 Fiche de synthèse n° 1.b Cohésion de la matière
Fiche de synthèse n° 1.b Cohésion de la matière
Remarque : Si la différence d'électronégativité entre les deux Si une molécule comporte plusieurs liaisons polarisées elle peut être polaire ou apolaire.
 La polarité de la liaison covalente
La polarité de la liaison covalente
Une liaison covalente est polaire si la différence des électronégativités Une substance polaire possède des molécules à dipôle résultant non nul. Une ...
 4 fiche polaire / apolaire
4 fiche polaire / apolaire
ex : la molécule de CO2 étant symétrique et linéaire elle est apolaire. un solvant constitué de molécules polaires (ex. eau) est un solvant polaire
 Pourquoi les glucides sont-ils solubles dans leau
Pourquoi les glucides sont-ils solubles dans leau
polaire ; on dit qu'elle est apolaire. Ex : C - C C - H. H - H. • Si la différence d'électronégativité varie de 03 à 1
 Exercices de la séquence 1
Exercices de la séquence 1
Le dioxyde de soufre est une molécule polaire alors que le dioxyde de carbone est apolaire. Justifier la différence de polarité observée entre le dioxyde de ...
 PHARMACOLOGIE GENERALE
PHARMACOLOGIE GENERALE
*** La diffusion simple permet le passage des molécules liposolubles apolaire et non Cas particulier d'eau. C'est une molécule très polaire
 Forces intermoléculaires
Forces intermoléculaires
Une molécule est dite polaire quand elle possède de moment dipolaire permanent et sinon elle est appelée apolaire. différences d'électronégativité). Leur ...
 TECHNIQUES: Principes de la chromatographie
TECHNIQUES: Principes de la chromatographie
Les molécules chargées ne migreront habituellement pas sur gel de silice elles sont trop polaires. 10. Phase mobile. Une phase mobile liquide est appelée
 Structure des entités
Structure des entités
Déterminer le caractère polaire ou apolaire d'une entité moléculaire à La liaison sera considérée comme polaire si la différence entre les électronégativités.
 Analyse de molécules dintérêt biologique en chromatographie
Analyse de molécules dintérêt biologique en chromatographie
21 janv. 2021 ... molécules d'eau et de dioxyde de carbone illustrant la différence entre une molécule apolaire (le dioxyde de carbone) et une molécule polaire.
 La polarité de la liaison covalente
La polarité de la liaison covalente
Une liaison covalente est polaire si la différence des électronégativités Les molécules polaires tiennent ensemble par leurs dipôles (loi de Coulomb
 Fiche de synthèse n° 1.b Cohésion de la matière
Fiche de synthèse n° 1.b Cohésion de la matière
Le propane est donc considéré comme apolaire. Si une molécule comporte plusieurs liaisons polarisées elle peut être polaire ou apolaire. Pour le savoir
 La polarité
La polarité
Une liaison covalente est dite polaire si la différence entre les polaire toute substance dont les molécules sont polaires
 I. La forme des molécules II. Lélectronégativité III. Polarité moléculaire
I. La forme des molécules II. Lélectronégativité III. Polarité moléculaire
En raison de l'arrangement des atomes dans les molécules covalentes qui La liaison covalente non-polaire est lorsque la différence.
 TP12 COMMENT CHOISIR LE BON SOLVANT POUR ELIMINER
TP12 COMMENT CHOISIR LE BON SOLVANT POUR ELIMINER
? Le cyclohexane est-il une molécule polaire ou apolaire ? dans une liaison sont d'électronégativités identiques ou de faibles différences la.
 Fiche 6 : Les solvants
Fiche 6 : Les solvants
Solvants polaires et apolaires usuels. (Voir cours sur l'électronégativité des éléments et sur les molécules polaires et apolaires).
 Forces intermoléculaires
Forces intermoléculaires
Une molécule est dite polaire quand elle possède de moment dipolaire appelée apolaire. ... car les deux liaisons sont identiques (mêmes différences.
 Molécules et solvants
Molécules et solvants
Un solvant polaire est constitué de molécules qui possèdent un moment dipolaire. Un solvant qui n'est pas polaire est apolaire. Page 18
 Constitution et transformation de la matière 2 De la structure des
Constitution et transformation de la matière 2 De la structure des
caractère polaire ou non de la molécule (On ne tiendra pas compte de la légère différence d'électronégativité entre les atomes d'hydrogène et de carbone).
 4. CHROMATOGRAPHIE LIQUIDE
4. CHROMATOGRAPHIE LIQUIDE
Les molécules polaires interagissent avec le support dans un solvant apolaire ainsi le k' diminue lorsque l'éluant devient plus polaire.
HABITAT
CHAPITRE 6
352G8H76 G·(175(7H(1 (7
REACTIONS ACIDE-BASE
TP12 COMMENT CHOISIR LE BON
SOLVANT POUR ELIMINER UNE TACHE ?
1. But
Solvant polaire et apolaire. Savoir choisir un solvant pour éliminer une espèce chimique.2. Solvant polaire et apolaire.
c D·après le document 2, à quelle condition une liaison est-elle polarisée ? T D·après le document 3, à quelles conditions une molécule est-elle polaire ? e D·après le document 3, à quelles conditions une molécule est-elle apolaire ? f I·HMX HVP-elle une molécule polaire ou apolaire ? Pourquoi ? g Le cyclohexane est-il une molécule polaire ou apolaire ? Pourquoi ?U GRQQHU OM IRUPXOH VHPL GpYHORSSpH GH O·pPOMQROB I·pPOMQRO HVP-il une molécule polaire ou apolaire ?
Pourquoi ?
i Dans un tube à essais, YHUVHU GH O·HMX HP GH O·pPOMQRO SXLV GMQV XQ MXPUH GH O·HMX HP GX Ń\ŃOROH[MQHB
Faire des schémas et noter les observations.
j A quelle(s) condition(s) deux molécules sont-elles miscibles ? sont-elles non miscibles ?k G·MSUqV OM TXHVPLRQ SUpŃpGHQPH, lHV PROpŃXOHV GH Ń\ŃOROH[MQH HP G·éthanol sont-elles miscibles ?
Pourquoi ?
3. Tests de solvant pour éliminer une tâche
On souhaLPH PHVPHU O·HIILŃMŃLPp GH GHX[ solvants (eau et cyclohexane) contre certaines tâches (miel,
OXLOH G·ROLYH HQŃUH NOHXH URXJH j OqYUHV et dentifrice). c Donner la signification des pictogrammes pour le cyclohexane.T Proposer un protocole expérimental respectant les règles de sécurité et permettant de choisir un de
ces solvants pour éliminer des taches. e Faire les expériences et noter les observations.f A partir des résultats expérimentaux précédents, indiquer si les molécules qui constituent les tâches
sont polaires ou apolaires. Justifier.4. Solvant et solide ionique
c GMQV XQ PXNH j HVVMLV YHUVHU GH O·HMX HP GX VXOIMPH GH ŃXLYUH SXLV GMQV XQ MXPUH GX Ń\ŃOROH[Mne et du
sulfate de cuivre. Faire des schémas et noter les observations. T Dans quel type de solvant peut-on dissoudre un solide ionique comme le sulfate de cuivre ?5. Tâches et oxydo-réduction
c Sur un morceau de papier filtre faire une tâche de permaQJMQMPH GH SRPMVVLXPB 3XLV j O·MLGH G·XQ
T Ecrire les demi-pTXMPLRQV HP OM UpMŃPLRQ G·R[\GR-réduction des couples en présence. O2/H2O2 : E = + 0,68 V et MnO4-/Mn2+ : E = + 1,51 Ve G·MSUqV OM Tuestion précédente, expliquer pourquoi la tâche de permanganate de potassium disparait ?
f 6XU TXHOV P\SHV GH PkŃOHV O·HMX GH -MYHO HVP-elle efficace ?6. (PXGH G·XQ GpPMŃOMQP O·HMX pŃMUOMPH
Pour certains types de taches et certains textiles fragiles (soies,...) ou difficilement lavable en machine
(tissus d'ameublement,...), on utilise un nettoyant à sec. c GRQQHU OM ŃRPSRVLPLRQ GH O·HMX pŃMUOMPHBT Qu·est-ce qu·un solvant aliphatique ?
e " I·eau écarlate » contient-HOOH GH O·HMX ? Donner une raison pour laquelle on lui a donné ce nom.
f Indiquer si les types de taches qui peuvent être enlevées avec " l'eau Écarlate » correspondent à des
produits solubles dans l'eau ? Pourquoi ? g Ce produit est-il adapté pour retirer des taches de miel ? Pourquoi ? Document 1 : Electronégativité G·XQ MPRPHHO V·MJLP GH O·MSPLPXGH G
XQ MPRPH RX G
XQ JURXSH G
MPRPHV G
XQH HQPLPp PROpŃXOMLUH j MPPLUHU GHV
électrons de liaison.
H2,1 He
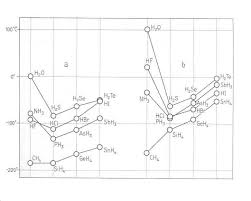
0 Li 1,0 Be 1,5 B 2,0 C 2,5 N 3,0 O 3,5 F 4,0 Ne 0 Na 0,9 Mg 1,2 Al 1,5 Si 1,8 P 2,1 S 2,5 Cl 3,0 Ar 0 Echelle d'électronégativité de PAULING pour quelques éléments chimiques (en unité atomique de moment dipolaire : 1 u.a.m.d = 2,54 Debye)Document 2 : Polarité G·XQH OLMLVRQ
Si deux atomes impliqués dans une liaison sont G·pOHŃPURQpJMtivités identiques ou de faibles différences, la
OLMLVRQ Q·HVP SMV SROMULVpH.
Exemples : H2 (H H), Cl2 (Cl Cl), O2 (O = O) Ces liaisons ne sont pas polarisées car les atomes qui
constituent ces liaisons ont la même électronégativité.Si deux atomes impliqués dans une liaison sont G·pOHŃPURQpJMPLYLPpV GLIIpUHQPHV OM OLMLVRQ HVP SROMULVpHB
Exemples : HCl (H Cl), CO (C O) Ces liaisons sont polarisées car les atomes qui constituent ces liaisons
ont une électronégativité différente.Document 3 : Molécules polaires et apolaires
Molécules polaires
Une molécule est polaire si elle a des liaisons polarisées et que le centre des charges positives ne
coïncide pas avec celui des charges négatives. Exemples de molécules polaires (MX MŃpPRQH pPOMQRO ŃOORURIRUPH "Molécules apolaires
Une molécule est apolaire si elle ne comporte pas de liaisons polarisées ou si les charges partielles
positives et négatives ont le même centre. Exemples de molécules apolaires : tétrachlorométhane, cyclohexane, pentane, benzqQH "Document 4 : Eau et cyclohexane
Nom Formule Précaution Nom Formule Précaution Eau H H OCyclohexane
L'eau est une molécule polaire car elle possède des liaisons polarisées (O H) et le centre des charges partielles négatives ne coïncide pas avec celui des charges partielles positives. (Cf schéma ci-contre) Le tétrachlorométhane est une molécule MSROMLUH ŃMU NLHQ TX·LO SRVVqGH des liaisons polarisées (C Cl), le centre des charges positives coïncide avec le centre des charges partielles négatives. (Cf schéma ci-contre) Le cyclohexane est aussi une molécule apolaire car il ne possède pas de liaisons polarisées tout comme, le pentane et le benzène.Document 5 : Exemple de quelques tâches
Nature Composition
Rouge à
lèvresIH URXJH j OqYUHV HVP XQ PpOMQJH GRQP O·H[ŃLSLHQP HVP OM ŃLUH G·MNHLOOH ŃRQVPLPXpH PMÓRULPMLUHPHQP
de palmitate de myricyle dont la formule est :+XLOH G·ROLYH L'huile d'olive est composée d'environ 99 % de matières grasses. La matière grasse de l'huile
d'olive est composée de triglycérides. Ceux-ci sont constitués d'acides gras de différentes
VRUPHVB IHV MŃLGHV JUMV GH O·OXLOH G·ROLYH SRVVqGHQP XQH ŃOMvQH ŃMUNRQpH GH 16 à 24 atomes de
carbone et un groupe ²COOH.Encre bleue
pour stylo plumeMiel I·HVVHQPLHO GX PLHO HVP ŃRPSRVp GH VXŃUHV PRQRVMŃŃOMULGHV TXL VRQP OH JOXŃRVH HP OH
fructose. Dentifrice Un dentifrice comprend plusieurs ingrédients liés ensemble par le glycérol qui a pour formule développée :Document 6 I·HMX GH -MYHO
I·(MX GH -MYHO MJLP VXU OHV PMŃOHV HQ OHV PUMQVIRUPMQP HQ PMPLqUHV LQŃRORUHV HQPUMvQpHV SMU OH ULQoMJH VL
concentrations nécessaires pour obtenir des réactions efficaces sont en général plus élevées que pour la
GpVLQIHŃPLRQ TXHOTXHV ŃHQPMLQHV GH PJCOB (Q HIIHP O·MŃPLRQ GpPMŃOMQPH RX NOMQŃOLVVMQPH YM GHYRLU GpPUXLUH GHV
molécules plus stables et pas forcément aminées.L'Eau de Javel est particulièrement efficace sur les taches oxydables - vin, café, thé -, sur les taches
protéiniques ² sang, sauces - et sur les taches colorées de fruitsDocument 7 I·HMX pŃMUOMPH
Document 8 : Les solvants aliphatiques
Les solvants aliphatiques sont des hydrocarbures ŃRQVPLPXpV XQLTXHPHQP GH ŃMUNRQH HP G·O\GURJqQHB IM
plupart des hydrocarbures sur le marché sont issus de la pétrochimie. Quelques hydrocarbures appelés
terpènes sont extraits de végétaux, par exemple le d-limonène provenant des pelures d·MJUXPHVB Ils peuvent
être linéaires ou cycliques :
- hydrocarbures aliphatiques linéaires : la chaîne de carbone est ouverte, droite ou ramifiée (hexane).
- hydrocarbures aliphatiques cycliques : la chaîne de carbone est fermée (cyclohexane). Les
hydrocarbures aliphatiques linéaires et cycliques ont des propriétés physiques et chimiques semblables.
CH3 (CH2)14 C
O O (CH2)29 CH3 N H+ S O O O- N H S O O O- Na+ CH3 NH2 S O O O- Na+ C H Priv ate Sub H Priv ate Sub Com manOH Priv C H OH H Priv ate Sub H Priv ate Sub Com manOH Priv CGlucose Fructose
Le colorant présent est le bleu
G·MQLOLQH de formule :
quotesdbs_dbs47.pdfusesText_47[PDF] Molécule produits par Rh+
[PDF] molécule synonyme
[PDF] molécule taille
[PDF] MOLECULES
[PDF] molécules 4ème exercices
[PDF] Molécules Apolaires 1ere S
[PDF] Molécules colorées organiques
[PDF] molécules coudées
[PDF] molécules d'adhérence cellulaire
[PDF] molécules d'adhésion immunologie
[PDF] Molécules de dioxygène en nanomètre
[PDF] molécules du vivant definition
[PDF] Molecules du vivant fondamentale
[PDF] Molécules et isomères
