 Fiche de synthèse n° 1.b Cohésion de la matière
Fiche de synthèse n° 1.b Cohésion de la matière
Remarque : Si la différence d'électronégativité entre les deux Si une molécule comporte plusieurs liaisons polarisées elle peut être polaire ou apolaire.
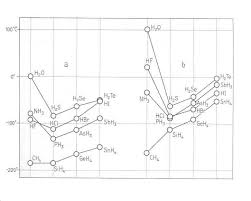 La polarité de la liaison covalente
La polarité de la liaison covalente
Une liaison covalente est polaire si la différence des électronégativités Une substance polaire possède des molécules à dipôle résultant non nul. Une ...
 4 fiche polaire / apolaire
4 fiche polaire / apolaire
ex : la molécule de CO2 étant symétrique et linéaire elle est apolaire. un solvant constitué de molécules polaires (ex. eau) est un solvant polaire
 Pourquoi les glucides sont-ils solubles dans leau
Pourquoi les glucides sont-ils solubles dans leau
polaire ; on dit qu'elle est apolaire. Ex : C - C C - H. H - H. • Si la différence d'électronégativité varie de 03 à 1
 Exercices de la séquence 1
Exercices de la séquence 1
Le dioxyde de soufre est une molécule polaire alors que le dioxyde de carbone est apolaire. Justifier la différence de polarité observée entre le dioxyde de ...
 PHARMACOLOGIE GENERALE
PHARMACOLOGIE GENERALE
*** La diffusion simple permet le passage des molécules liposolubles apolaire et non Cas particulier d'eau. C'est une molécule très polaire
 Forces intermoléculaires
Forces intermoléculaires
Une molécule est dite polaire quand elle possède de moment dipolaire permanent et sinon elle est appelée apolaire. différences d'électronégativité). Leur ...
 TECHNIQUES: Principes de la chromatographie
TECHNIQUES: Principes de la chromatographie
Les molécules chargées ne migreront habituellement pas sur gel de silice elles sont trop polaires. 10. Phase mobile. Une phase mobile liquide est appelée
 Structure des entités
Structure des entités
Déterminer le caractère polaire ou apolaire d'une entité moléculaire à La liaison sera considérée comme polaire si la différence entre les électronégativités.
 Analyse de molécules dintérêt biologique en chromatographie
Analyse de molécules dintérêt biologique en chromatographie
21 janv. 2021 ... molécules d'eau et de dioxyde de carbone illustrant la différence entre une molécule apolaire (le dioxyde de carbone) et une molécule polaire.
 La polarité de la liaison covalente
La polarité de la liaison covalente
Une liaison covalente est polaire si la différence des électronégativités Les molécules polaires tiennent ensemble par leurs dipôles (loi de Coulomb
 Fiche de synthèse n° 1.b Cohésion de la matière
Fiche de synthèse n° 1.b Cohésion de la matière
Le propane est donc considéré comme apolaire. Si une molécule comporte plusieurs liaisons polarisées elle peut être polaire ou apolaire. Pour le savoir
 La polarité
La polarité
Une liaison covalente est dite polaire si la différence entre les polaire toute substance dont les molécules sont polaires
 I. La forme des molécules II. Lélectronégativité III. Polarité moléculaire
I. La forme des molécules II. Lélectronégativité III. Polarité moléculaire
En raison de l'arrangement des atomes dans les molécules covalentes qui La liaison covalente non-polaire est lorsque la différence.
 TP12 COMMENT CHOISIR LE BON SOLVANT POUR ELIMINER
TP12 COMMENT CHOISIR LE BON SOLVANT POUR ELIMINER
? Le cyclohexane est-il une molécule polaire ou apolaire ? dans une liaison sont d'électronégativités identiques ou de faibles différences la.
 Fiche 6 : Les solvants
Fiche 6 : Les solvants
Solvants polaires et apolaires usuels. (Voir cours sur l'électronégativité des éléments et sur les molécules polaires et apolaires).
 Forces intermoléculaires
Forces intermoléculaires
Une molécule est dite polaire quand elle possède de moment dipolaire appelée apolaire. ... car les deux liaisons sont identiques (mêmes différences.
 Molécules et solvants
Molécules et solvants
Un solvant polaire est constitué de molécules qui possèdent un moment dipolaire. Un solvant qui n'est pas polaire est apolaire. Page 18
 Constitution et transformation de la matière 2 De la structure des
Constitution et transformation de la matière 2 De la structure des
caractère polaire ou non de la molécule (On ne tiendra pas compte de la légère différence d'électronégativité entre les atomes d'hydrogène et de carbone).
 4. CHROMATOGRAPHIE LIQUIDE
4. CHROMATOGRAPHIE LIQUIDE
Les molécules polaires interagissent avec le support dans un solvant apolaire ainsi le k' diminue lorsque l'éluant devient plus polaire.
ère
Partie : Constitution de la matière Solvants et solutés
Fiche6 : Les solvants
1. Solvants polaires et apolaires usuels
(Voir cours sur l'électronégativité des éléments et sur les molécules polaires et apolaires)
Rappels sur l'électronégativité :
Une liaison covalente entre 2 atomes résulte de la mise en commun par chaque atome d'unélectron de sa couche électronique externe.
Certains atomes, engagés dans une liaison covalente, ont tendance à attirer les électrons de la liaison : ils sont dits électronégatifs. Une liaison covalente est dite polarisée lorsqu'elle unit deux atomes d'électronégativité très différente Quand une liaison chimique est polarisée, on dit que :
l'atome le plus électronégatif porte une charge électrique partielle négative notée : ɷ
l'atome le moins électronégatif porte une charge électrique partielle positive notée : ɷ
Une molécule est polaire quand le centre géométrique des charges partielles positives n'est pas confondu avec le centre géométrique des charges partielles négatives.
Les molécules organiques présentent souvent des géométries complexes, ce qui rend difficile l'étude de
la répartition des charges partielles. En première approximation, le caractère polaire ou apolaire d'un
solvant organique est déterminé par la présence d'atomes très électronégatifs.Un solvant organique dont les molécules comportent un atome très électronégatif N, O, F ou Cl est généralement polaire.
Exemple
: Solvants polaires usuels : L"eau H20 ; certains alcools (méthanol, éthanol, propanol) ; certains acides (acide éthanoïque ou acide
acétique, acide méthanoïque ou acide formique) ; l'ammoniac NH3 ; l'acétone C3H6O.Les solvants hydrogénocarbonés (uniquement constitués d'atome de carbone et d'hydrogène) sont
considérés comme apolaire car les électronégativités du carbone et de l"hydrogène sont très proches.
Exemple
: Solvant apolaire usuel : le cyclohexane et le pentane CH 3 CH 2 CH 2 CH 2 CH 3 C C C C C C HH H H H H HHHHH H 22. Dissolution et choix du solvant
La solubilité d"une espèce polaire ou ionique est plusélevée dans un
solvant polaire que dans un solvant apolaire. La solubilité d"une espèce apolaire est plus élevée dans un solvant apolaire que dans un solvant polaire.Solvant polaire Solvant apolaire
Espèce polaire ou ionique Très soluble Peu solubleEspèce apolaire Peu soluble Très soluble
quotesdbs_dbs47.pdfusesText_47[PDF] Molécule produits par Rh+
[PDF] molécule synonyme
[PDF] molécule taille
[PDF] MOLECULES
[PDF] molécules 4ème exercices
[PDF] Molécules Apolaires 1ere S
[PDF] Molécules colorées organiques
[PDF] molécules coudées
[PDF] molécules d'adhérence cellulaire
[PDF] molécules d'adhésion immunologie
[PDF] Molécules de dioxygène en nanomètre
[PDF] molécules du vivant definition
[PDF] Molecules du vivant fondamentale
[PDF] Molécules et isomères
