 Chapitre 12 : La réaction chimique - AlloSchool
Chapitre 12 : La réaction chimique - AlloSchool
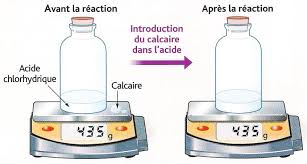
▫ On appelle transformation chimique une transformation (réaction) au cours de laquelle des réactifs. (substances présentes au départ) sont consommés pour
 Chimie Générale (Chimie 1)
Chimie Générale (Chimie 1)
23 déc. 2020 ✓ Loi de conservation de la masse au cours d'une réaction (Lavoisier « lors d'une réaction chimique la masse totale des réactifs est égale à ...
 Les réactions chimiques
Les réactions chimiques
G L'annexe 18 présente une activité de laboratoire au cours de laquelle les élèves peuvent calculer avec un bon degré de précision la masse molaire du butane.
 Les transformations chimiques
Les transformations chimiques
Exemple : l'eau est une espèce chimique. b) Transformation physique. Au cours d'une transformation physique les espèces chimiques restent les mêmes : il ne.
 Chapitre Chimie N°8 La Réaction Chimique Objectifs du cours
Chapitre Chimie N°8 La Réaction Chimique Objectifs du cours
→. E.F = (Cu2+; Ag; NO3- ; Ag+ (?); Cu (?)) c) Réactifs et produits. Au cours d'une transformation chimique : → Les espèces chimiques qui disparaissent sont
 Réactions chimiques 1 :
Réactions chimiques 1 :
Le présent guide d'apprentissage constitue votre principal instrument de travail pour le cours Réactions chimiques 1 : énergie et cinétique chimique. Il a été
 Dangers chimiques liés à la présence de substances néoformées
Dangers chimiques liés à la présence de substances néoformées
En effet au cours du processus de transformation technologique et/ou de préparations culinaires industrielles ou ménagères des denrées alimentaires
 Chapitre 8 : Le tableau davancement
Chapitre 8 : Le tableau davancement
Au cours d'une transformation chimique des espèces chimiques sont modifiées : réactifs et des produits au cours de la réaction chimique. Il s'exprime en ...
 obS.2 avancement dune réaction chimique – cours
obS.2 avancement dune réaction chimique – cours
b) Transformation chimique : Les espèces chimiques qui constituent un système peuvent réagir entre elles. Le système peut donc évoluer au cours du temps. Cette
 Reaction chimique - Thermodynamique - Cinétique
Reaction chimique - Thermodynamique - Cinétique
La réaction chimique. Définition. Il s'agit d'une transformation au cours de laquelle un certain nombre de constituants initiaux appelés réactifs.
 Chimie Générale (Chimie 1)
Chimie Générale (Chimie 1)
Loi de conservation de la masse au cours d'une réaction (Lavoisier « lors d'une réaction chimique la masse totale des réactifs est égale à la masse totale
 Réactions chimiques 1 :
Réactions chimiques 1 :
Réactions chimiques 1 : énergie et cinétique chimique est le deuxième des trois guides d'apprentissage correspondant aux trois cours du programme Chimie 5e
 Chapitre 12 : La réaction chimique - AlloSchool
Chapitre 12 : La réaction chimique - AlloSchool
On appelle transformation chimique une transformation (réaction) au cours de laquelle des réactifs. (substances présentes au départ) sont consommés pour
 Cours de chimie g´en´erale Pr´eparation au concours B des ´ecoles
Cours de chimie g´en´erale Pr´eparation au concours B des ´ecoles
La cinétique chimique est l'étude de la cinétique des réactions chimiques. En d'autres termes elle permet d'étudier l'évolution temporelle des quantités de
 2. Réactions chimiques Stœchiométrie
2. Réactions chimiques Stœchiométrie
Equation chimique. Une réaction chimique est un processus par lequel des éléments ou des composés (les réactifs) interagissent en brisant et/ou en créant
 La réaction chimique
La réaction chimique
On peut considérer que l'élimination est une réaction au cours de laquelle une double liaison carbone : C=C est formée tandis qu'une petite molécule est libérée
 Chapitre VI: Lévolution des réactions chimiques
Chapitre VI: Lévolution des réactions chimiques
La transformation chimique est le passage d'un système chimique de l'état initial à l'état final. exemple: les ions iodure I - avec les ions peroxodisulfate
 Les transformations chimiques
Les transformations chimiques
Exemple : l'eau est une espèce chimique. b) Transformation physique. Au cours d'une transformation physique les espèces chimiques restent les mêmes : il ne.
 COURS DE CHIMIE GENERALE Semestre 1 SVI
COURS DE CHIMIE GENERALE Semestre 1 SVI
Titrage d'un acide faible par une base forte. CHAPITRE III : REACTIONS D'OXYDO-REDUCTION. 1. Généralités. 1.1. Oxydant réducteur

Universit
´e Paris-Sud
Cours de chimie g
´en´erale
Pr´eparation au concours B des´ecoles
Agronomiques et V
´et´erinairesFabien Cailliez, LCP UMR 8000
fabien.cailliez@u-psud.frChapitre I
Cinétique chimique
SommaireI.1 Définitions et concepts . . . . . . . . . . . . . . . . . . . . . . .3 I.1.1 Équation-bilan . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3 I.1.2 Vitesse de la réaction . . . . . . . . . . . . . . . . . . . . . . . . . 4 I.1.3 Ordre d"une réaction . . . . . . . . . . . . . . . . . . . . . . . . . 6 I.2 Étude de quelques réactions d"ordre simple . . . . . . . . . . . 7 I.2.1 Réaction d"ordre 0 . . . . . . . . . . . . . . . . . . . . . . . . . . 7 I.2.2 Réaction d"ordre 1 . . . . . . . . . . . . . . . . . . . . . . . . . . 8 I.2.3 Réaction d"ordre 2 . . . . . . . . . . . . . . . . . . . . . . . . . . 8 I.2.4 Réaction d"ordre 1 par rapport à A et B . . . . . . . . . . . . . . 8 I.3 Détermination de l"ordre d"une réaction à partir de données expérimentales . . . . . . . . . . . . . . . . . . . . . . . . . . . . 10 I.3.1 Méthodes physiques de suivi d"une réaction . . . . . . . . . . . . 10 I.3.2 Méthode de dégénérescence de l"ordre . . . . . . . . . . . . . . . 11 I.3.3 Méthode intégrale . . . . . . . . . . . . . . . . . . . . . . . . . . 12 I.3.4 Temps de demi-réaction . . . . . . . . . . . . . . . . . . . . . . . 13 I.3.5 Méthode différentielle et méthode des vitesses initiales . . . . . . 13 I.4 Étude de quelques réactions complexes . . . . . . . . . . . . . 14 I.4.1 Réactions opposées d"ordre 1 . . . . . . . . . . . . . . . . . . . . 14 I.4.2 Réactions concurrentes . . . . . . . . . . . . . . . . . . . . . . . . 16 I.4.3 Réactions successives . . . . . . . . . . . . . . . . . . . . . . . . . 17I.1. Définitions et concepts 3
La cinétique chimique est l"étude de la cinétique des réactions chimiques. En d"autrestermes, elle permet d"étudier l"évolution temporelle des quantités de réactifs au sein d"un
système soumis à des transformations chimiques. Exemple : réaction d"hydrogénation de l"éthène H2+H2CCH2!CH3CH3
L"étude cinétique de ce système consiste à déterminer l"évolution des quantités de dihydrogène H
2, d"éthène C2H4et d"éthane C2H6au cours du temps.Dans ce cours, nous ferons deux hypothèses simplificatrices :
Hyp othèsedu système fermé : le s ystèmeen réaction c himiqueétudié n"éc hangepas de
matière avec le milieu extérieur. Hyp othèseiso chore: le v olumeVdu système est considéré constant.I.1 Définitions et concepts
I.1.1 Équation-bilan
Une équation-bilan permet de décrire la réaction chimique. Elle sera notée par la suite de
la façon suivante :1A1+2A2+:::1*)21B1+2B2+:::
ou, de façon plus synthétique X i iAi=X j jBjCoefficients stoechiométriques
Dans l"équation ci-dessus, les espèces A
isont nommées les réactifs, et les espèces Bjles produits. Les coefficientsietjsont appelés coefficients stoechiométriques. Ils sont tous positifs. Pour former1moles de B1, il est nécessaire de faire réagir1moles de A1,2 moles de A2,etc.
On définit également des coefficients stoechiométriques algébriquesi, qui peuvent être
négatifs. Ils dépendent du sens de la réaction chimique. Si on considère la réaction dans le
sens direct, c"est-à-dire des réactifs A ivers les produits Bj(sens 1), on a : -i=ipour les réactifs -j=jpour les produits.À l"aide de cette notation, on peut réécrire l"équation-bilan de la réaction chimique sous
une forme encore plus synthétique :X k kRk= 0 où lesksont les coefficients stoechiométriques algébriques et où Rkreprésente soit un réactif A k, soit un produit BkI.1. Définitions et concepts 4
Considérons la réaction suivante entre le monoxyde d"azote et le dihydrogène :2NO+2H2*)2H2O+N2
Il faut 2 moles de NO et 2 moles de H
2pour produire une mole de N2et 2 moles de
H2O. Le coefficient stoechiométrique du monoxyde d"azote estNO=2, celui de l"eau est
H2O= +2.Avancement de la réaction
Dans l"exemple précédent, lorsqu"on consomme 2 moles de monoxyde d"azote NO par la réaction chimique, on consomme également 2 moles de dihydrogène H2et on produit 2
moles d"eau H2O et 1 mole de diazote N2. Si on consomme maintenant2moles de NO,
par proportionalité, on consomme2moles de H2et on produit2moles de H2O etmoles de N2. On obtient le tableau d"avancement suivant :
2NO+2H2*)2H2O+N2t = 0n1n2n3n4
tn12 n22 n3+ 2 n4+ (t)est appelé avancement de la réaction à l"instantt, et il est défini par : (t) =ni(t)n0i iouni=n0i+i(t) L"avancement d"une réaction est indépendant du réactif!I.1.2 Vitesse de la réaction
Vitesse de formation ou de disparition d"une espèce On définit la vitesse de formationvfd"une espèce comme la variation de sa quantité de matière en un temps donné. Pour une espèce A, on a donc : V f;A=dnAdt La vitesse de disparitionvdd"une espèce est l"opposée de sa vitesse de formation : V d;A=dnAdt =Vf;A Les vitesses de formation et de disparition d"une espèce s"expriment enmol:s1. Leur définition est indépendante des équations-bilan décrivant le système chimique.I.1. Définitions et concepts 5
Vitesse d"une réaction
Considérons de nouveau la réaction du monoxyde d"azote sur le dihydrogène :2NO+2H2*)2H2O+N2
Les vitesses de formation de l"eau et du diazote sont données par : V f;H2O=dnH2Odt etVf;N2=dnN2dt Quand on produit 2 moles d"eau, on n"en produit qu"une seule de diazote : dnH2O= 2dnN2d0ouVf;H2O= 2Vf;N2
La vitesse de formation d"un produit (ou réactif) est ainsi dépendante de la nature de ce produit. Elle n"est donc pas adaptée à la mesure de la vitesse de réaction. En revanche, nous avons vu que l"avancement d"une réaction est uniquement dépendant de l"équation- bilan de la réaction. On définit donc la vitesse de la réactionVcomme la variation de l"avancement en fonction du temps : V=ddt La vitesse de réaction est reliée aux vitesses de formation ou disparition des composés impliqués dans la réaction, du fait de la relation entre l"avancement et les quantités de matières. En effet, puisqueni=n0i+i, on a par dérivation par rapport au temps :V=Vf;i
i iest le coefficient stoechiométrique algébrique et est donc négatif pour un réactif et positif pour un produit!Vitesse volumique d"une réaction
La vitesse volumique d"une réaction est définie par : v=VV =1Vquotesdbs_dbs2.pdfusesText_2[PDF] cours de langage de programmation c++
[PDF] cours de langage de programmation java
[PDF] cours de langage de programmation pascal
[PDF] cours de langage de programmation visual basic
[PDF] cours de linguistique générale english
[PDF] cours de linguistique générale english pdf
[PDF] cours de linguistique générale explication pdf
[PDF] cours de linguistique générale ferdinand de saussure pdf
[PDF] cours de linguistique générale pdf
[PDF] cours de linguistique générale saussure
[PDF] cours de maths trigonométrie première s
[PDF] cours de philosophie sur l'etat
[PDF] cours de philosophie sur l'etat pdf
[PDF] cours de philosophie sur l'existence et la mort
