 Chapitre 12 : La réaction chimique - AlloSchool
Chapitre 12 : La réaction chimique - AlloSchool
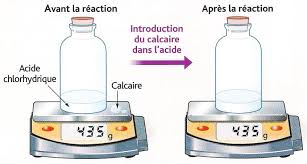
▫ On appelle transformation chimique une transformation (réaction) au cours de laquelle des réactifs. (substances présentes au départ) sont consommés pour
 Chimie Générale (Chimie 1)
Chimie Générale (Chimie 1)
23 déc. 2020 ✓ Loi de conservation de la masse au cours d'une réaction (Lavoisier « lors d'une réaction chimique la masse totale des réactifs est égale à ...
 Les réactions chimiques
Les réactions chimiques
G L'annexe 18 présente une activité de laboratoire au cours de laquelle les élèves peuvent calculer avec un bon degré de précision la masse molaire du butane.
 Les transformations chimiques
Les transformations chimiques
Exemple : l'eau est une espèce chimique. b) Transformation physique. Au cours d'une transformation physique les espèces chimiques restent les mêmes : il ne.
 Chapitre Chimie N°8 La Réaction Chimique Objectifs du cours
Chapitre Chimie N°8 La Réaction Chimique Objectifs du cours
→. E.F = (Cu2+; Ag; NO3- ; Ag+ (?); Cu (?)) c) Réactifs et produits. Au cours d'une transformation chimique : → Les espèces chimiques qui disparaissent sont
 Cours de chimie g´en´erale Pr´eparation au concours B des ´ecoles
Cours de chimie g´en´erale Pr´eparation au concours B des ´ecoles
La cinétique chimique est l'étude de la cinétique des réactions chimiques. En d'autres termes elle permet d'étudier l'évolution temporelle des quantités de
 Réactions chimiques 1 :
Réactions chimiques 1 :
Le présent guide d'apprentissage constitue votre principal instrument de travail pour le cours Réactions chimiques 1 : énergie et cinétique chimique. Il a été
 Dangers chimiques liés à la présence de substances néoformées
Dangers chimiques liés à la présence de substances néoformées
En effet au cours du processus de transformation technologique et/ou de préparations culinaires industrielles ou ménagères des denrées alimentaires
 Chapitre 8 : Le tableau davancement
Chapitre 8 : Le tableau davancement
Au cours d'une transformation chimique des espèces chimiques sont modifiées : réactifs et des produits au cours de la réaction chimique. Il s'exprime en ...
 obS.2 avancement dune réaction chimique – cours
obS.2 avancement dune réaction chimique – cours
b) Transformation chimique : Les espèces chimiques qui constituent un système peuvent réagir entre elles. Le système peut donc évoluer au cours du temps. Cette
 Reaction chimique - Thermodynamique - Cinétique
Reaction chimique - Thermodynamique - Cinétique
La réaction chimique. Définition. Il s'agit d'une transformation au cours de laquelle un certain nombre de constituants initiaux appelés réactifs.
 Chimie Générale (Chimie 1)
Chimie Générale (Chimie 1)
Loi de conservation de la masse au cours d'une réaction (Lavoisier « lors d'une réaction chimique la masse totale des réactifs est égale à la masse totale
 Réactions chimiques 1 :
Réactions chimiques 1 :
Réactions chimiques 1 : énergie et cinétique chimique est le deuxième des trois guides d'apprentissage correspondant aux trois cours du programme Chimie 5e
 Chapitre 12 : La réaction chimique - AlloSchool
Chapitre 12 : La réaction chimique - AlloSchool
On appelle transformation chimique une transformation (réaction) au cours de laquelle des réactifs. (substances présentes au départ) sont consommés pour
 Cours de chimie g´en´erale Pr´eparation au concours B des ´ecoles
Cours de chimie g´en´erale Pr´eparation au concours B des ´ecoles
La cinétique chimique est l'étude de la cinétique des réactions chimiques. En d'autres termes elle permet d'étudier l'évolution temporelle des quantités de
 2. Réactions chimiques Stœchiométrie
2. Réactions chimiques Stœchiométrie
Equation chimique. Une réaction chimique est un processus par lequel des éléments ou des composés (les réactifs) interagissent en brisant et/ou en créant
 La réaction chimique
La réaction chimique
On peut considérer que l'élimination est une réaction au cours de laquelle une double liaison carbone : C=C est formée tandis qu'une petite molécule est libérée
 Chapitre VI: Lévolution des réactions chimiques
Chapitre VI: Lévolution des réactions chimiques
La transformation chimique est le passage d'un système chimique de l'état initial à l'état final. exemple: les ions iodure I - avec les ions peroxodisulfate
 Les transformations chimiques
Les transformations chimiques
Exemple : l'eau est une espèce chimique. b) Transformation physique. Au cours d'une transformation physique les espèces chimiques restent les mêmes : il ne.
 COURS DE CHIMIE GENERALE Semestre 1 SVI
COURS DE CHIMIE GENERALE Semestre 1 SVI
Titrage d'un acide faible par une base forte. CHAPITRE III : REACTIONS D'OXYDO-REDUCTION. 1. Généralités. 1.1. Oxydant réducteur
 Chapitre VI: L'évolution des réactions chimiques
Chapitre VI: L'évolution des réactions chimiques I/ Les réactions chimiques
1/ L'évolution d'un système chimique
La transformation chimique est le passage d'un système chimique de l'état initial à l'état final.
exemple: les ions iodure I - avec les ions peroxodisulfate S2O82-état initial
température Ti = 30°C espèce n°1: ions iodure ✔formule chimique: I - ✔quantité de matière: 5.10-3 mol espèce n°2: ions peroxodisulfate ✔formule chimique: S2O82- ✔quantité de matière: 1.10-3 molétat final température Tf = 30°C espèce n°1: ions iodure ✔formule chimique: I - ✔quantité de matière: 3.10-3 mol espèce n°3: diiode ✔formule chimique: I2 ✔quantité de matière: 1.10-3 mol espèce n°4: ions sulfate ✔formule chimique: SO42- ✔quantité de matière: 2.10-3 mol➔On modélise la transformation chimique par un processus qu'on appelle " la réaction chimique » et
qu'on décrit par son équation chimique : exemple :➔L'équation doit respecter la conservation des atomes et des charges électriques entre les
réactifs et les produits :2/ La stoechiométrie
Il s'agit des relations de proportionnalité entre les quantités de matière consommées des réactifs et
entre les quantités de matière formées des produits. exemple:quand 1 mole d'ions peroxodisulfate S2O82- est consommée, alorsréactifsproduits2I- + S2O82- I2 + 2SO42-
on doit les retrouver les mêmes atomes et en même nombre dans les réactifs et dans les produits, de
même que les charges électriques totales pour cela, on doit introduire des coefficients appelés coefficients stoechiométriques (en vert dans l'exemple)2 moles d'ions iodure I- sont aussi consommées ; au cours de la transformation, 1 mole de diiode I2 est
formée ainsi que 2 moles d'ions sulfate SO42-.3/ L'avancement : simulateur " 1S avancement réaction »
L'avancement x est une grandeur qui permet de suivre l'évolution des quantités de matière des réactifs
et des produits au cours de la réaction. Il s'exprime en moles.exemple: quand x moles d'ions peroxodisulfate ont été consommées, il reste dans le système chimique:
➔les autres quantités de matières se déduisent :➔Au cours de la réaction chimique, les quantités de matière des réactifs diminuent :
4/ Le tableau d'évolution (ou tableau d'avancement)
Il décrit l'évolution des quantités de matière de l'état initial jusqu'à l'état final.
➔chaque ligne est un bilan de matière correspondant à l'instant considérééquation
étatavancementquantités de matière (mol)
initialX = 05.10-31.10-300 en cours de transformationX 5.10-3 - 2x1.10-3 - xx2xfinalX = xmax5.10-3 - 2xmax1.10-3 - xmaxxmax2xmax2I- + S2O82- I2 + 2SO42-n(S2O82-) = (1.10-3 - x) mol
n(I -) = (5.10-3 - 2x) mol n(I2) = x mol n(SO42-) = 2x mol
de moins en moins de plus en plus de plus en plus
car I - est consommé car I2 est formé car SO42- est forméde moins en moins de S2O82- car ces ions sont
des réactifs donc ils sont consommés remarque : Quand au moins 1 réactif est entièrement consommé, alors la réaction s'arrête : ce réactif est appelé " le réactif limitant » l'avancement atteint est maximal : on le note xmax5/ L'exploitation du tableau d'évolution
➔pour construire et compléter le tableau d'évolution, on n'a besoin que de 2 informations :
✔l'équation de la réaction (qu'on est souvent capable de formuler soi-même) ✔les quantités de matière des réactifs à l'état initial a/ le réactif limitant et l'avancement finalOn sait que la réaction prend fin quand l'un des réactifs est entièrement consommé. Cherchons lequel :
➔dans notre exemple, il y a 2 réactifs donc il y a 2 possibilités : hypothèsesI - est le réactif limitantS2O82- est le réactif limitantétat finalnfinale(I-) = 0
5.10-3 - 2xmax 1 = 0
2xmax 1 = 5.10-3
xmax 1 = (5/2).10-3 = 2,5. 10-3 molnfinale(S2O82-) = 01.10-3 - xmax 2 = 0
xmax 2 = 1.10-3 mol bilan 1.10-3 ' 2,5. 10-3 xmax 2 ' xmax 1 c'est la 2ème hypothèse qui est la bonne car l'avancement x est maximal pour 1.10-3 mol : la réaction s'arrête (car il n'y a plus le réactif S2O82-) et alors l'avancement ne peut plus augmenter, donc l'autre hypothèse (avec xmax 1 = 2,5. 10-3 mol) n'est pas possible. conclusion✔l'avancement maximal a pour valeur : xmax = 1.10-3 mol ✔le réactif limitant est S2O82- (on dit que c'est le réactif en défaut) ✔on dit que l'autre réactif I - est en excès b/ le cas o ù tous les réactifs s'épuisent en même temps➔c'est possible si les quantités de matière des réactifs à l'état initial sont proportionnelles à leurs
coefficients stoechiométriques. ➔exemple : 2I- + S2O82- I2 + 2SO42- c/ l'état fin al➔La dernière ligne du tableau indique l'expression de chaque quantité de matière à l'état final :
Rappel :
nfinale(I -) = 5.10-3 - 2xmax = 3.10-3 molnfinale(S2O82-) = 1.10-3 - xmax = 0 molnfinale(I2) = xmax = 1.10-3 molnfinale(SO42-) = 2xmax = 2.10-3 molsi ninitiale(I -) = 2ninitiale(S2O82-) , alors ces 2 réactifs seront totalement consommés en même temps xmax = 1.10-3 molquotesdbs_dbs2.pdfusesText_2[PDF] cours de langage de programmation c++
[PDF] cours de langage de programmation java
[PDF] cours de langage de programmation pascal
[PDF] cours de langage de programmation visual basic
[PDF] cours de linguistique générale english
[PDF] cours de linguistique générale english pdf
[PDF] cours de linguistique générale explication pdf
[PDF] cours de linguistique générale ferdinand de saussure pdf
[PDF] cours de linguistique générale pdf
[PDF] cours de linguistique générale saussure
[PDF] cours de maths trigonométrie première s
[PDF] cours de philosophie sur l'etat
[PDF] cours de philosophie sur l'etat pdf
[PDF] cours de philosophie sur l'existence et la mort
