 Exercice de révision pour le bac : chimie Contrôle de la qualité par dos
Exercice de révision pour le bac : chimie Contrôle de la qualité par dos
Dans l'industrie laitière l'acidité d'un lait n'est pas exprimée par son pH mais par son degré Dornic : un degré Dornic (°D) correspond à une concentration de
 MÉTHODE SURE ET RAPIDE DAPPRÉCIATION DES LAITS
MÉTHODE SURE ET RAPIDE DAPPRÉCIATION DES LAITS
d'acidité exprimée en acide lactique par litre. L'un des acidimètres contient la solution de soude habituelle- ment utilisée pour le titrage du degré Dornic ...
 H.S.5.1 T.P. N°2 Détermination de lacidité dun lait.
H.S.5.1 T.P. N°2 Détermination de lacidité dun lait.
I). Objectif : L'Objectif est de titrer l'acide lactique contenu dans un lait afin de déterminer sa fraîcheur en mesurant son degré Dornic.
 1 1. - Degré dacidité de la crème et· acidit de la crème dégraissée.
1 1. - Degré dacidité de la crème et· acidit de la crème dégraissée.
La teneur en matière grasse déterminée par méthode butyrométrique est également exprimée gravimé- triquement. comme en France on employait la méthode Dornic ...
 Fraicheur du lait
Fraicheur du lait
Problématique possible : « Comment le degré Dornic permet-il d'évaluer la fraicheur d'un lait ? » Introduction sur l'acide lactique : La masse molaire de l'
 Séquence n°4 La transformation du lait en yaourt est-elle un
Séquence n°4 La transformation du lait en yaourt est-elle un
L'acidité est exprimée en degré Dornic (°D). Plus le degré Dornic est élevé – Objectifs : Déterminer le degré Dornic (°D) du lait. – Matériel : Pour un ...
 Concours interne
Concours interne
L'objectif est de déterminer la fraîcheur du lait testé en mesurant son degré d'acidité total qui s'exprime en degré DORNIC (°D). BACCALAUREAT PROFESSIONNEL.
 a) Principe ~
a) Principe ~
Si elle n'augmente pas le degré théorique de neutra- lisation apparaît par comparaison avec l'acidité du lait frais. La méthode Dornic pour le dosage de l' ...
 Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
déterminer son degré Dornic (c'est-à-dire la masse d'acide lactique dans un ... D'après la définition du degré Dornic le lait titré a une acidité de 21 °D.
 Exercice de révision pour le bac : chimie Contrôle de la qualité par dos
Exercice de révision pour le bac : chimie Contrôle de la qualité par dos
Dans l'industrie laitière l'acidité d'un lait n'est pas exprimée par son pH mais par son degré Dornic : un degré Dornic (°D) correspond à une concentration de
 H.S.5.1 T.P. N°2 Détermination de lacidité dun lait.
H.S.5.1 T.P. N°2 Détermination de lacidité dun lait.
I). Objectif : L'Objectif est de titrer l'acide lactique contenu dans un lait afin de déterminer sa fraîcheur en mesurant son degré Dornic.
 Séquence n°4 La transformation du lait en yaourt est-elle un
Séquence n°4 La transformation du lait en yaourt est-elle un
Objectifs : Déterminer les facteurs favorables à la transformation du lait en yaourt (durée température) L'acidité est exprimée en degré Dornic (°D).
 Concours interne
Concours interne
L'objectif est de déterminer la fraîcheur du lait testé en mesurant son degré d'acidité total qui s'exprime en degré DORNIC (°D). BACCALAUREAT PROFESSIONNEL.
 Mini-titreur dacidité totale titrable pour lanalyse des produits laitiers
Mini-titreur dacidité totale titrable pour lanalyse des produits laitiers
Elle est exprimée en degrés Dornic. Un lait frais titre environ 16 à 18 ° Dornic. Bien que souvent utilisé le titrage manuel
 MÉTHODE SURE ETRAPIDE DAPPRÉCIATION DES LAITS
MÉTHODE SURE ETRAPIDE DAPPRÉCIATION DES LAITS
du lait ':fermentation lactique pure; fermentationchymasique ment utilisée pour le titrage du degré Dornic d'acidité.
 Fraicheur du lait
Fraicheur du lait
Problématique possible : « Comment le degré Dornic permet-il d'évaluer la fraicheur d'un lait ? » Introduction sur l'acide lactique : La masse molaire de l'
 T.l.copie pleine page
T.l.copie pleine page
L'objectif est de déterminer la fraîcheur du lait testé en mesurant son degré d'acidité total qui s'exprime en degré DORNIC (°D). TRAVAIL À RÉALISER.
 CHIMIE PHÉNOLPHTALÉINE
CHIMIE PHÉNOLPHTALÉINE
La phénolphtaléine est un indicateur acide-base et un médicament (laxatif). Déterminer l'acidité du lait exprimée en degrés Dornic. Ce lait est-il frais ...
 LES RELATIONS ENTRE LACIDITÉ ACTUELLE ET LACIDITÉ
LES RELATIONS ENTRE LACIDITÉ ACTUELLE ET LACIDITÉ
itre N/9 de la soude pour qu'une simple transposition de virgule permette d'exprimer l'acidité du lait en acide lactique. Le degré Dornic en effet
Concours B ENV
B - 0206V
1/4 T.S.V.P.
CHIMIE
Durée : 2 heures
L"usage d"une calculatrice est autorisé.
Si, au cours de l"épreuve, un candidat repère ce qui lui semble être une erreur d"énoncé, il le signale sur
sa copie et poursuit sa composition en expliquant les raisons des initiatives qu"il a été amené à prendre.
Cette épreuve est constituée de trois parties indépendantes mais concernant toutes la phénolphtaléine.
PHÉNOLPHTALÉINE
La phénolphtaléine est un indicateur acide-base et un médicament (laxatif). Après avoir étudié sa
synthèse, on s"intéressera à quelques-unes de ses propriétés chimiques.I. Synthèses
I.1.1. Proposer une synthèse du chlorure de propanoyle à partir d"éthylène (ou éthène), de tous solvants et
réactifs minéraux ainsi que de tout réactif à un atome de carbone.I.1.2. Proposer une synthèse de l"anisole (ou méthoxybenzène) à partir du phénol, de tous solvants et
réactifs minéraux ainsi que de tout réactif à un atome de carbone.I.2. Quels produits majoritaires A1 et A2 obtient-on par réaction entre l"anisole et le chlorure de
propanoyle en présence de chlorure d"aluminium et après hydrolyse ?OCH3 +C
2H5 OCl1) AlCl3
2) H2O, HA
1 + A2
Indiquer le mécanisme de cette réaction. En justifier la régiosélectivité en écrivant les intermédiaires
réactionnels. AlCl3 doit-il être utilisé en quantité catalytique ? Justifier la réponse.
I.3. La phénolphtaléine est synthétisée par la réaction acido-catalysée de l"anhydride phtalique avec deux
équivalents de phénol. Le bilan est le suivant : OO O + 2 OH H2SO4 O OHOOH + H2O phénolphtaléine, notée PPhH 2Proposer un mécanisme pour cette synthèse, sachant qu"une première étape peut être la protonation d"un
oxygène d"un groupe carbonyle. On peut utiliser une écriture simplifiée pour les composés mis en jeu.
I.4. En milieu basique, la phénolphtaléine PPhH2 , incolore, donne naissance à un dianion rouge selon
une réaction renversable et rapide : 2/4 O OHO OH OO O HO H O dianion rouge noté PPh2- I.4.1. Proposer un mécanisme pour le passage de PPhH2 à PPh2-
I.4.2. Les deux atomes d"oxygène phénoliques sont-ils différents ? Justifier brièvement la réponse.
En tant que laxatif, on peut aussi utiliser un dérivé de la phénolphtaléine : la diacétophtaléine ou diacétate
de phénolphtaléine.I.5.1. Ecrire le mécanisme de la réaction d"estérification en utilisant la réaction entre l"acide acétique (ou
acide éthanoïque) et le propan-1-ol en milieu acide comme exemple.I.5.2. Un acide carboxylique et un phénol ne réagissent pas pour conduire à un ester. Indiquer une
constatation expérimentale montrant que l"estérification d"un phénol est difficile. Proposer une interprétation à cette constatation.I.5.3. Quel réactif pourrait-on utiliser pour synthétiser la diacétophtaléine à partir de phénolphtaléine ?
II. Indicateur coloré
On s"intéresse à la détermination de l"acidité d"un lait. Les données utiles sont regroupées en fin de
paragraphe.Le lait frais contient essentiellement de l"eau (87% en masse) mais aussi des glucides, des protéines et des
corps gras. Le lactose C12H22O11 est le glucide le plus abondant. Des bactéries peuvent provoquer sa
transformation en acide 2-hydroxypropanoïque usuellement appelé acide lactique.Bien que l"acide lactique ne soit pas le seul acide présent, on caractérise l"acidité du lait par son
équivalent en acide lactique.
II.1. L"acide lactique peut exister sous deux formes énantiomères. Représenter ses deux formes en les
nommant sans ambiguïté.II.2.1. Ecrire l"équation de la réaction de transformation d"une mole de lactose en acide lactique.
II.2.2. Calculer l"enthalpie standard de cette réaction à 25 °C à partir des enthalpies standard de
combustion fournies en données. On rappelle que la combustion d"un composé est sa réaction avec le
dioxygène qui produit de l"eau liquide et du dioxyde de carbone gazeux. II.2.3. On considère un lait qui contient 50 g.L -1 de lactose. Quelle serait la variation de température d"unlitre de lait dont la moitié du lactose se transformerait en acide lactique, en négligeant tout autre transfert
thermique ?II.3. Pour mettre au point un protocole opératoire de dosage, on s"intéresse au dosage pHmétrique de 10,0
mL d"une solution d"acide lactique de concentration CA = 0,12 mol.L-1, par une solution d"hydroxyde de
sodium 0,10 mol.L -1.3/4 T.S.V.P. II.3.1. Déterminer le volume équivalent.
II.3.2. Calculer le pH de la solution d"acide avant ajout de soude ainsi que le pH du mélange réactionnel à
la demi-équivalence puis à l"équivalence. On justifiera brièvement les relations utilisées.
II.3.3. Tracer l"allure de la courbe de dosage pH = f(v soude versé) en utilisant le quadrillage de la copie. II.3.4. Faire un schéma annoté du montage complet permettant de réaliser ce dosage.II.4. Dans la détermination de l"acidité du lait, le protocole standard prescrit l"usage de phénolphtaléine
(en solution à 1 % dans l"éthanol à 95°, 2 gouttes pour 10 mL de lait) et un titrage par une solution de
soude de concentration 1/9 mol.L -1 (dite soude Dornic). Le volume équivalent est lu à l"apparition de la couleur rose.II.4.1. Justifier le choix de la phénolphtaléine pour ce dosage et le mode de détermination du volume
équivalent.
II.4.2. Pourquoi n"utilise-t-on pas une solution aqueuse de phénolphtaléine ?II.4.3. Pourquoi met-on une si faible quantité de phénolphtaléine dans le milieu réactionnel ?
II.5. Dans l"industrie laitière, l"acidité d"un lait s"exprime en degré Dornic (°D). Un degré Dornic
correspond à 0,.1 g d"acide lactique par litre de lait. L"acidité d"un lait frais doit être inférieure à 18°D.
Dans un bécher, on verse 10,0 mL du lait à étudier, on ajoute 2 gouttes de solution de phénolphtaléine. La
burette est remplie de soude Dornic. L"apparition de la couleur rose correspond à un volume de 3,2 mL.
II.5.1. Avec quel instrument de verrerie prélève-t-on les 10,0 mL de lait ? II.5.2. Déterminer l"acidité du lait exprimée en degrés Dornic. Ce lait est-il frais ?II.5.3. Expliquer pourquoi il est commode d"utiliser la soude Dornic, de prendre un volume de lait de 10
mL et d"exprimer les résultats en degrés Dornic. Pour les questions II.6.1.et II.6.2. une réponse brève est souhaitée. II.6.1. Comment se comportent les protéines lorsque le pH diminue ?II.6.2. Les corps gras sont des triesters du glycérol. Comment évoluent-ils lorsque le pH diminue ?
Données.
Le pKa du couple où intervient l"acide lactique est 3,9. On donne les domaines de virage de quelques indicateurs : bleu de bromothymol jaune ½6,0 7,6½ bleu hélianthine orange ½3,4 5,0½ rosephénolphtaléine incolore ½8,0½ rouge
rouge de méthyle rouge ½4,2 6,2½ jaune
Masses molaires atomiques en g.mol-1 : C : 12 ; H : 1 ; O : 16 Enthalpies standard de combustion à 25 °C en kJ.mol -1 :Composé lactose acide lactique
DcomH° - 5631 - 1344
Capacité calorifique de lait C
p = 4,4 kJ.K-1.L-1III. Cinétique
En milieu franchement basique, il se produit la réaction d"équation :PPh2- + HO-PPhOH3-1
24/4 PPh
2- désigne le dianion dont la formule est écrite en I.4.
Cette réaction est renversable est assez lente. La durée de l"étude est assez brève pour que l"on puisse
négliger la réaction inverse (sens 2) dans un premier temps.L"évolution est suivie par spectrophotométrie, on mesure l"absorbance A des solutions. On se place à
550 nm, longueur d"onde où seul PPh
2- absorbe. Toutes les mesures sont effectuées à 25 °C.
III.1.1. Proposer une structure pour PPhOH
3-. III.1.2. Pourquoi précise-t-on la température où sont effectuées les mesures ?III.1.3. Ecrire la loi de Beer-Lambert. Préciser la signification de chaque terme ainsi que les limites de
cette loi. III.2. Une expérience où les concentrations initiales en PPh2- et HO- sont respectivement égales à
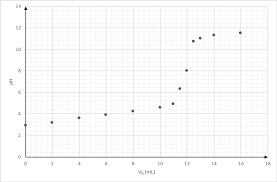
6,08.10
-5 et 1,0 mol.L-1 a donné les résultats suivants : t/min 0 0,5 1,0 1,5 2,0 2,5 3,0 3,5 4,0 5,0 A 1,90 1,547 1,262 1,027 0,838 0,681 0,555 0,454 0,367 0,245Pour répondre aux questions III.2.2, III.3.1. et III.4.4. on pourra effectuer une régression linéaire à
l"aide d"une calculatrice ou tracer un graphe en utilisant le quadrillage de la copie. III.2.1. Dans quelle situation cinétique se trouve-t-on ? III.2.2. Déterminer l"ordre de la réaction par rapport à PPh 2-. III.2.3. Quelle est la valeur de la constante apparente k app de vitesse ?III.3. On réalise une série d"expériences avec des concentrations initiales variables en anion hydroxyde.
On obtient les résultats suivants où la valeur de k app est donnée dans un système d"unités où les concentrations s"expriment en mol.L -1 et le temps en minutes. [HO -]0/mol.L-1 0,05 0,10 0,20 0,30 kapp 2,04.10-2 4,11.10-2 8,18.10-2 0,124 III.3.1. Déterminer l"ordre de la réaction par rapport à HOIII.3.2. Quelle est la valeur de la constante k
1 de vitesse de la réaction dans le sens 1 ?
III.4. Dans un deuxième temps, on poursuit les mesures assez longtemps pour que la réaction inverse ne
puisse pas être négligée. Elle est d"ordre un par rapport à PPhOH3- et l"on note k2 sa constante de vitesse.
On note x le taux (ou degré) d"avancement volumique de la réaction. On réalise une expérience où l"absorbance initiale A0 = 0,805, et l"absorbance à l"équilibre A¥ = 0,105. La
concentration initiale en hydroxyde de sodium vaut 0,05 mol.L -1 celle de PPh2- vaut 2,58.10-5 mol.L-1.Les résultats sont les suivants :
t/min 2 6 10 12 14 16 20 22 24 26 A 0,776 0,715 0,660 0,633 0,609 0,586 0,542 0,522 0,502 0,484III.4.1. Montrer que la concentration en anions hydroxyde peut être considérée comme constante au cours
de la réaction. III.4.2. Etablir une équation différentielle en x, puis l"intégrer. On pourra introduire x¥, valeur de x à
l"équilibre.III.4.3. Trouver une relation liant t, A, A
0 et A¥.
III.4.4. Déterminer les constantes de vitesse k1 et k2. Comparer avec la valeur de k1 trouvée plus haut.
FIN DE L"ÉPREUVE
quotesdbs_dbs50.pdfusesText_50[PDF] déterminer l'ensemble des points m d'affixe z argument
[PDF] déterminer l'ensemble des points m d'affixe z tels que
[PDF] déterminer l'ensemble des points m d'affixe z tels que z' soit un imaginaire pur
[PDF] déterminer l'ensemble des points m dont l'affixe z vérifie
[PDF] determiner l'ensemble des points m du plan
[PDF] determiner l'ensemble e des points m d'affixe z tel que z' soit reel
[PDF] determiner l'equation de la courbe des contrats
[PDF] déterminer l'expression d'une fonction affine
[PDF] déterminer l'ordre d'une réaction chimique
[PDF] déterminer la concentration massique en saccharose d'un soda
[PDF] déterminer le pka du couple acide ascorbique/ion ascorbate
[PDF] déterminer les coordonnées des points i j et k
[PDF] déterminer les points critiques d'une fonction
[PDF] deua 2017
