 TP N.04 Dosage doxydoréduction - Suivi potentiométrique 1
TP N.04 Dosage doxydoréduction - Suivi potentiométrique 1
On souhaite préparer de façon précise 1000 mL d'une solution aqueuse S1 de concentration C1 = 1
 Dosage doxydoréduction - Suivi potentiométrique - CORRECTION
Dosage doxydoréduction - Suivi potentiométrique - CORRECTION
Dans ce TP on réalise le dosage d'une solution de sel de Mohr (ions. ) par une solution de permanganate ( 0 ). La réaction de dosage est une réaction
 Étude dune réaction : titrage des ions fer II par les ions permanganate
Étude dune réaction : titrage des ions fer II par les ions permanganate
Solution de permanganate de potassium. K+(aq) + MnO4. -(aq). Concentration [MnO4. -]. Volume équivalent Véq à déterminer ? Solution acidifiée de sel de Mohr.
 Dosage potentiométrique
Dosage potentiométrique
solution de permanganate de potassium à la concentration C1 = 20.10-2 mol.L-1. La solution d'ions fer II est préparée avec du sel de Mohr : Le sel de Mohr
 Dosage potentiométrique Un dosage potentiométrique consiste à
Dosage potentiométrique Un dosage potentiométrique consiste à
Le potentiel EPt varie en fonction du volume versé à l'aide de la burette d'un réactif titrant. Protocole : - Prélever 20
 Dosage doxydoréduction - Suivi potentiométrique
Dosage doxydoréduction - Suivi potentiométrique
solution de sel de Mohr (ions ) par une solution de permanganate ( 0 ). A) Détermination de la concentration de la solution de Fer(II). • Ecrire les demi ...
 enseignement et formation
enseignement et formation
de sel de Mohr (10 x 10-1 mol L-1) par du sulfate de cérium(IV) Figure 10 - Simulation d'un titrage potentiométrique des ions FeII (25 mL de solution de sel.
 Méthodes de titrage en électrochimie
Méthodes de titrage en électrochimie
2 mai 2020 d'une des méthodes présentées dans ce cours. Exemple de TP : titrages potentiométriques du fer (II) dans le sel de Mohr par. KMnO4 ...
 Présentation PowerPoint
Présentation PowerPoint
Dosage par potentiométrie . • On détermine le Calcul: • Détermination de la relation entre Ve C1
 Synthèse et analyse dun complexe : loxalate de fer II
Synthèse et analyse dun complexe : loxalate de fer II
2 - Mode opératoire. – Dissoudre 8 g de sel de Mohr dans 25 mL d'eau acidifiée par 1 mL d'H2SO4 2 mol.L– 1. – Préparer une solution d'acide oxalique : 5 g
 Dosage doxydoréduction - Suivi potentiométrique - CORRECTION
Dosage doxydoréduction - Suivi potentiométrique - CORRECTION
Dans ce TP on réalise le dosage d'une solution de sel de Mohr (ions. ) par une solution de permanganate ( 0 ). La réaction de dosage est une réaction
 TP N.04 Dosage doxydoréduction - Suivi potentiométrique 1
TP N.04 Dosage doxydoréduction - Suivi potentiométrique 1
Réaliser par dissolution du sel de Mohr (solide ionique de formule FeSO4 Vérifier la concentration de la solution obtenue en dosant les ions Fe2+.
 Étude dune réaction : titrage des ions fer II par les ions permanganate
Étude dune réaction : titrage des ions fer II par les ions permanganate
Solution de permanganate de potassium. K+(aq) + MnO4. -(aq). Concentration [MnO4. -]. Volume équivalent Véq à déterminer ? Solution acidifiée de sel de Mohr.
 TP 13 DOSAGE des IONS FER (II) contenus dans le SEL de MOHR
TP 13 DOSAGE des IONS FER (II) contenus dans le SEL de MOHR
Réaliser par dissolution du sel de Mohr (solide ionique de formule FeSO4(NH4)2SO4
 Dosage dune solution de sel de Mohr par une solution de sulfate
Dosage dune solution de sel de Mohr par une solution de sulfate
Généralités: Un titrage rédox suppose une réaction quasi totale et rapide. On peut suivre cette réaction en continu par potentiométrie: On réalise une pile
 TP de chimie n°4 Oxydoréduction : titrage par potentiométrie
TP de chimie n°4 Oxydoréduction : titrage par potentiométrie
Prélever un volume V0=200mL de solution de Fe2+ (sel de Mohr
 Loi de Nernst et dosage potentiométrique
Loi de Nernst et dosage potentiométrique
manganate de potassium de concentration inconnue par la solution de Fe(II). Solutions utilisées : ? Solution de sel de Mohr ((NH4)2Fe(SO4)26H2O) préparée
 EI-7v1 : DÉTERMINATION DE LA DEMANDE CHIMIQUE EN
EI-7v1 : DÉTERMINATION DE LA DEMANDE CHIMIQUE EN
Sulfate de fer (II) et d'ammonium hexahydraté : (sel de Mohr) solution titrée Lors du titrage potentiométrique de l'excès de dichromate dans ...
 Les dosages doxydoréduction
Les dosages doxydoréduction
Exercice 8 : Dosage potentiométrique d'une solution d'ions fer 2. Dans cet exercice on réalise le dosage d'une solution de sel de Mohr (contenant les ions
 Dosage potentiométrique
Dosage potentiométrique
La solution d'ions fer II est préparée avec du sel de Mohr : Le sel de Mohr (ainsi nommé en l'honneur du chimiste allemand Karl Friedrich Mohr) ou alun de
TP-Chimie de solution 2017-2018
TP N.04
Dosage d'oxydoreduction - Suivi potentiometrique
Objectif :
IRealiser par dissolution dusel de Mohr(solide ionique de formuleFeSO4;(NH4)2SO4;6H2O), une solution aqueuse de concentration connueen ion fer (II) IVerier la concentration de la solution obtenue en dosant les ionsFe2+ (aq)par oxydoreduction.ISavoir mesurer le potentiel d'une solution
1 Comment reperer l'equivalence :
Materiel utilise :
u nebu rettegr adueecon tenantl er eactift itrant; u nagi tateurmagn etique( bo^tieret ai mant) u nb ^echerd egar de; u nb ^echerc ontenantl asol ution at itrer( preleveepar u nepi pettej augeed ansu nb ^echer);Il faut egalement une pissette d'eau distillee pour rincer le becher entre les deux dosages.2 Preparation de la solution aqueuse :
On souhaite preparer de facon precise 100,0 mL d'une solution aqueuseS1de concentrationC1=1;50:101mol:L1en sel de Mohr.
1. D eterminerl amas sem de sel d eM ohr ad issoudre?Donnees :Masse molaireFeSONH
en [g:mol1]55,832,116,014,01,0 2. Ecrire l'equation de dissolution du sel de Mohr; preciser les especes presentes dans la solution? 3. D ecrirel es etapesde la p reparationpu isl ar ealiser? 3 Etude de la reaction chimique :(Dosage des ions de Fer(II) dans la solution)On realise le dosage des ionsFe2+
(aq)deS1par une solution acidiee de permanganate de potassium(K+ (aq)+ MnO4(aq)) de concentrationC2= 2;00:102mol:L1.MPSI 1 http ://prepanouar.sup.fr
TP-Chimie de solution 2017-2018
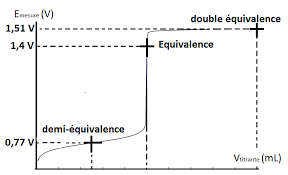
1. P ourquoid oit-onac idierla s olutionde p ermanganated ep otassium? 2. D eterminerl escou plesen p resenceet l esde mi-equationsde cou ple, ainsil ar eactionbi lan? 3. l 'equivalencees td etecteep aru nc hangementde t eintequ id oit^ etren etet f acilementd etectable. Expliquer comment va varier la couleur de la solution a doser? 4. D eterminerl ac onstantede l ar eaction,sac hantq ueEMnO4=Mn2+= 1;51VetEFe3+=Fe2+=
0;77V.Conclure.
5. D eterminerl acon centrationd el asol utiond eF er(II)?Sachant que le tableau d'avancement de la reaction de dosage s'ecrit :6.D eterminerle v olumeV2pour calculer le potentiel standard du coupleFe3+=Fe2+:EFe3+=Fe2+
7. Cal culerl ep otentiels tandardd ucou pleMnO4=Mn2+:EMnO4=Mn2+
4 Protocole experimental :
4.1 Protocole :
IPreparer avec soinV1= 10;0mLde la solution de sel de Mohr dans l'erlenmeyer puis ajouter environ 25 mL d'eau et 25 mL de la solution deH2SO4depH'0. IPreparer la burette, la remplir de la solution de permanganate de potassium. IPlacer une feuille blanche sous l'erlenmeyer, preparer l'agitateur magnetique. IEectuer un premier dosage pour determiner l'ordre de grandeur (au mL pres) du volume (V2)eq. IEectuer un second dosage pour determiner le volume (V2)eqa la goutte pres. IAppeler le professeur pour qu'il verie au second dosage la lecture de (V2)eq.4.2 Dosage colorimetrique :
Determiner rapidement le volume equivalent de permanganate.4.3 Dosage potentiometrique :
IRaccorder l'electrode potentiometrique combinee au millivoltmetre et la plonger dans la solution. Ne pas oublier de rincer l'electrode avant et apres le dosage.Imaintenir une agitation reguliere.
INoter les valeurs de la d.d.p. U en versant la solution de permanganate (ralentir a l'approche de l'equivalence);U[mV]V[mL]012345
MPSI 2 http ://prepanouar.sup.fr
TP-Chimie de solution 2017-2018
Remarque :
U=EPtErefou U est la f.e.m de la pile constituee de l'electrode de platine indiquant le potentiel de la solutionEPt, qui depend des concentrations des dierentes especes redox presentes (note E dans le TP); et de l'electrode de reference au calomel de potentiel constant E ref= 0;244Va 25°C. Par consequent, pour obtenir le potentiel de la solution E, il faut ajouter a la f.e.mEPtle potentiel de referenceErefsoit :EPt=E=U+Eref. IJeter la solution du b^echer des la n du dosage. Pourquoi? ITracer avecLatis-prosla courbeE(V2) :V2volume de permanganate de potassium verse.IPlacer le volume equivalent. Imprimer la courbe.
5 Exploitation des resultats :
1. D eterminerl acon centrationC1de la solution de sel de Mohr. 2. Comp arer al av aleurt heorique( c alculerl 'ecartr elatif) et con clure 3. D eterminerl escon centrationse ectivesd esdi erentese specesc himiquespr esentesd ansl em ilieu reactionnel a l'equivalence. 4. M esurerl ep otentield uc oupleFe3+=Fe2+en expliquant la methode. Attention, on ne trouve pas 0,77 V car les deux ions ont ete complexes par le sulfate. 5. Me surerl ep otentield ucou pleMnO4=Mn2+en expliquant la methode.MPSI 3 http ://prepanouar.sup.frquotesdbs_dbs50.pdfusesText_50[PDF] dosage sulfate ferreux par permanganate de potassium
[PDF] dose mais par hectare
[PDF] dose toxique aspirine
[PDF] dossier a fournir campus france guinee
[PDF] dossier a fournir pour le crem
[PDF] dossier a fournir visa france en cote d'ivoire
[PDF] dossier art appliqué bac pro commerce
[PDF] dossier art appliqué bac pro exemple 2012
[PDF] dossier art appliqué bac pro exemple coca cola
[PDF] dossier art appliqué bac pro pdf
[PDF] dossier art appliqué bac pro terminal 2015
[PDF] dossier art appliqué bac pro terminal 2017
[PDF] dossier bac pro commerce exemple
[PDF] dossier bac pro vente exemple
