 TP N.04 Dosage doxydoréduction - Suivi potentiométrique 1
TP N.04 Dosage doxydoréduction - Suivi potentiométrique 1
On souhaite préparer de façon précise 1000 mL d'une solution aqueuse S1 de concentration C1 = 1
 Dosage doxydoréduction - Suivi potentiométrique - CORRECTION
Dosage doxydoréduction - Suivi potentiométrique - CORRECTION
Dans ce TP on réalise le dosage d'une solution de sel de Mohr (ions. ) par une solution de permanganate ( 0 ). La réaction de dosage est une réaction
 Étude dune réaction : titrage des ions fer II par les ions permanganate
Étude dune réaction : titrage des ions fer II par les ions permanganate
Solution de permanganate de potassium. K+(aq) + MnO4. -(aq). Concentration [MnO4. -]. Volume équivalent Véq à déterminer ? Solution acidifiée de sel de Mohr.
 Dosage potentiométrique
Dosage potentiométrique
solution de permanganate de potassium à la concentration C1 = 20.10-2 mol.L-1. La solution d'ions fer II est préparée avec du sel de Mohr : Le sel de Mohr
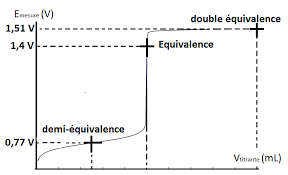
 Dosage potentiométrique Un dosage potentiométrique consiste à
Dosage potentiométrique Un dosage potentiométrique consiste à
Le potentiel EPt varie en fonction du volume versé à l'aide de la burette d'un réactif titrant. Protocole : - Prélever 20
 Dosage doxydoréduction - Suivi potentiométrique
Dosage doxydoréduction - Suivi potentiométrique
solution de sel de Mohr (ions ) par une solution de permanganate ( 0 ). A) Détermination de la concentration de la solution de Fer(II). • Ecrire les demi ...
 enseignement et formation
enseignement et formation
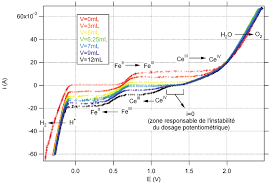
de sel de Mohr (10 x 10-1 mol L-1) par du sulfate de cérium(IV) Figure 10 - Simulation d'un titrage potentiométrique des ions FeII (25 mL de solution de sel.
 Méthodes de titrage en électrochimie
Méthodes de titrage en électrochimie
2 mai 2020 d'une des méthodes présentées dans ce cours. Exemple de TP : titrages potentiométriques du fer (II) dans le sel de Mohr par. KMnO4 ...
 Présentation PowerPoint
Présentation PowerPoint
Dosage par potentiométrie . • On détermine le Calcul: • Détermination de la relation entre Ve C1
 Synthèse et analyse dun complexe : loxalate de fer II
Synthèse et analyse dun complexe : loxalate de fer II
2 - Mode opératoire. – Dissoudre 8 g de sel de Mohr dans 25 mL d'eau acidifiée par 1 mL d'H2SO4 2 mol.L– 1. – Préparer une solution d'acide oxalique : 5 g
 Dosage doxydoréduction - Suivi potentiométrique - CORRECTION
Dosage doxydoréduction - Suivi potentiométrique - CORRECTION
Dans ce TP on réalise le dosage d'une solution de sel de Mohr (ions. ) par une solution de permanganate ( 0 ). La réaction de dosage est une réaction
 TP N.04 Dosage doxydoréduction - Suivi potentiométrique 1
TP N.04 Dosage doxydoréduction - Suivi potentiométrique 1
Réaliser par dissolution du sel de Mohr (solide ionique de formule FeSO4 Vérifier la concentration de la solution obtenue en dosant les ions Fe2+.
 Étude dune réaction : titrage des ions fer II par les ions permanganate
Étude dune réaction : titrage des ions fer II par les ions permanganate
Solution de permanganate de potassium. K+(aq) + MnO4. -(aq). Concentration [MnO4. -]. Volume équivalent Véq à déterminer ? Solution acidifiée de sel de Mohr.
 TP 13 DOSAGE des IONS FER (II) contenus dans le SEL de MOHR
TP 13 DOSAGE des IONS FER (II) contenus dans le SEL de MOHR
Réaliser par dissolution du sel de Mohr (solide ionique de formule FeSO4(NH4)2SO4
 Dosage dune solution de sel de Mohr par une solution de sulfate
Dosage dune solution de sel de Mohr par une solution de sulfate
Généralités: Un titrage rédox suppose une réaction quasi totale et rapide. On peut suivre cette réaction en continu par potentiométrie: On réalise une pile
 TP de chimie n°4 Oxydoréduction : titrage par potentiométrie
TP de chimie n°4 Oxydoréduction : titrage par potentiométrie
Prélever un volume V0=200mL de solution de Fe2+ (sel de Mohr
 Loi de Nernst et dosage potentiométrique
Loi de Nernst et dosage potentiométrique
manganate de potassium de concentration inconnue par la solution de Fe(II). Solutions utilisées : ? Solution de sel de Mohr ((NH4)2Fe(SO4)26H2O) préparée
 EI-7v1 : DÉTERMINATION DE LA DEMANDE CHIMIQUE EN
EI-7v1 : DÉTERMINATION DE LA DEMANDE CHIMIQUE EN
Sulfate de fer (II) et d'ammonium hexahydraté : (sel de Mohr) solution titrée Lors du titrage potentiométrique de l'excès de dichromate dans ...
 Les dosages doxydoréduction
Les dosages doxydoréduction
Exercice 8 : Dosage potentiométrique d'une solution d'ions fer 2. Dans cet exercice on réalise le dosage d'une solution de sel de Mohr (contenant les ions
 Dosage potentiométrique
Dosage potentiométrique
La solution d'ions fer II est préparée avec du sel de Mohr : Le sel de Mohr (ainsi nommé en l'honneur du chimiste allemand Karl Friedrich Mohr) ou alun de
Dosage potentiométrique
1. Généralités:
Un titrage rédox suppose une réaction quasi totale et rapide. On peut suivre cette réaction en continu
par potentiométrie: On réalise une pile constituée d'une électrode en platine (indicatrice du couple
rédox) plongeant dans la solution à étudier et d'une électrode de référence qui garde un potentiel
constant et connu (électrode au calomel saturé). Le voltmètre affiche: E = EOx/Red - EE.C.S. (EE.C.S. = 0,245V) On peut donc en déduire à châque moment EOx/Red = E + EE.C.S. On trace alors EOx/Red en fonction du volume V du réactif titrant.EOx/Red représente le potentiel de la solution à chaque instant, c'est-à-dire le potentiel de tout couple
présent dans le milieu. Pour le TP nous utiliserons une électrode combinée.2. Étalonnage de la solution de sulfate cérique par pesée de sel de Mohr
Mettre en oeuvre cette méthode. Faire 2 essais concordants.Compte rendu
Données: Couple ferrique Fe3+/ferreux Fe2+ E0 = 0,68 V Couple cérique Ce4+/céreux Ce3+ E0 = 1 ,44 VÉquation de la réaction, détermination de la masse m de sel de Mohr à peser, expression littérale de la
concentration cherchée, résultats expérimentaux, calcul de la concentration en Ce4+. L'indicateur utilisé
est la ferroine qui passe du rouille au bleu.3. Dosage d'une solution de sel ferreux par une solution titrée de sulfate cérique
1. Principe
Écrire les 1/2 équations électroniques des couples mis en jeu et l'équation de la réaction qui se produit
quand on verse la solution cérique.2. Mode opératoire
*Burette : Solution titrante de sulfate cérique.*Bécher : 10 mL de solution à titrer + 50mL d'eau distillée environ pour immerger l'électrode
Verser la solution titrante de 0,5 en 0,5 cm3 jusqu'à 25 cm3 . Mesurer chaque fois le d.d.p. entre les
électrodes.
3. Compte-rendu et calculs
*Tracer la courbe EOx/Red = f (V) *Déterminer graphiquement -la valeur de V au point équivalent. -la valeur de E0x/Red à veq/2 et à 2Veq *En déduire - la c.m.v. de la solution de la solution de sel de Mohr- la composition de la solution à veq/2. (Quelle est la relation entre [Fe3+] et [Fe2+]) et la valeur
expérimentale du potentiel normal du couple rédox Fe3+ / Fe2+.- la composition de la solution à 2Veq (Quelle est la relation entre [Ce4+] et [Ce3+] et la valeur
expérimentale du potentiel du couple rédox Ce4+ / Ce3+.Fanny Demay - BTS BioAnalyses & Contrôles1/1
quotesdbs_dbs50.pdfusesText_50[PDF] dosage sulfate ferreux par permanganate de potassium
[PDF] dose mais par hectare
[PDF] dose toxique aspirine
[PDF] dossier a fournir campus france guinee
[PDF] dossier a fournir pour le crem
[PDF] dossier a fournir visa france en cote d'ivoire
[PDF] dossier art appliqué bac pro commerce
[PDF] dossier art appliqué bac pro exemple 2012
[PDF] dossier art appliqué bac pro exemple coca cola
[PDF] dossier art appliqué bac pro pdf
[PDF] dossier art appliqué bac pro terminal 2015
[PDF] dossier art appliqué bac pro terminal 2017
[PDF] dossier bac pro commerce exemple
[PDF] dossier bac pro vente exemple
