 Exercice : La bouteille magique Corrigé
Exercice : La bouteille magique Corrigé
1- Équation de la réaction modélisant la transformation chimique entre le glucose et la solution de bleu de méthylène. 1-1) Définitions :.
 Activité expérimentale n°2 : LE LIQUIDE MAGIQUE
Activité expérimentale n°2 : LE LIQUIDE MAGIQUE
Le schtroumpf curieux vient de dérober la recette d'un liquide magique chez Gargamel chimie arrive à le réaliser. Faire valider ce protocole par le professeur ...
 Exercice : La bouteille magique
Exercice : La bouteille magique
Exercice : La bouteille magique. D'après épreuve de BAC Terminale S Afrique 2008. 2008-2009. Au cours d'une séance de travaux pratiques un élève de terminale
 CHAPITRE 9 : QUANTITÉ DE MATIERE TP1 : LA BOUTEILLE
CHAPITRE 9 : QUANTITÉ DE MATIERE TP1 : LA BOUTEILLE
Le schtroumpf curieux vient de dérober la recette d'un liquide magique chez Gargamel. Page 2. Doc 2 : quelques définitions de cours. ➢ Une mole est un « ...
 CORRIGE
CORRIGE
1 août 2020 La pression dans la bouteille est égale à 370 bars si tout le CO2 qu ... Exercice 5 : Un exemple de valorisation de CO2. CO2(g) + 4 H2(g) ...
 TP15 La chimie du liquide magique
TP15 La chimie du liquide magique
de glucose. LE PROTOCOLE À SUIVRE pour réaliser le liquide magique est donc le suivant : Lorsque la bouteille est agitée le dioxygène qui se trouve dans l' ...
 BACCALAURÉAT GÉNÉRAL PHYSIQUE-CHIMIE
BACCALAURÉAT GÉNÉRAL PHYSIQUE-CHIMIE
Chez le nourrisson les ions nitrate (NO3. -) sont incriminés dans la survenue de la méthémoglobinémie (ou maladie bleue). La formation des ions nitrite
 Exercice 10. La bouteille de butane
Exercice 10. La bouteille de butane
Tous les gaz seront assimilés à des gaz parfaits. Une bouteille de gaz pour usage domestique contient 130 kg de butane C4H10 partiellement liquéfié. La
 La chimie verte adaptée aux exercices et aux expériences
La chimie verte adaptée aux exercices et aux expériences
La chimie verte appliquée aux expériences. La soi-disant “expérience de la bouteille bleue” (dont sont décrites un grand nombre de variantes. 4. ) peut être
 Mes premières expériences de chimie
Mes premières expériences de chimie
Fixe la bouteille n°1 sur la bouteille n°2 avec du scotch. Au fond de la - Découvrir la craie magique. 9. Pour aller. Page 10. 10. 15. Extrait de : « Le Labo ...
 Exercice : La bouteille magique Corrigé
Exercice : La bouteille magique Corrigé
1- Équation de la réaction modélisant la transformation chimique entre le glucose et la solution de bleu de méthylène. 1-1) Définitions :.
 Exercice : La bouteille magique
Exercice : La bouteille magique
Exercice : La bouteille magique. D'après épreuve de BAC Terminale S Afrique 2008. 2008-2009. Au cours d'une séance de travaux pratiques
 CHIMIE Partie I : Chimie et Magie – La bouteille magique
CHIMIE Partie I : Chimie et Magie – La bouteille magique
Dans la suite on s'intéresse plus particulièrement au tour de la « bouteille magique ». A grands renforts de mise en scène
 Activité expérimentale n°2 : LE LIQUIDE MAGIQUE
Activité expérimentale n°2 : LE LIQUIDE MAGIQUE
Le schtroumpf curieux vient de dérober la recette d'un liquide magique chez Gargamel. 1. AIDONS LE SCHTROUMPF CURIEUX… chimie arrive à le réaliser.
 TP : La bouteille magique : correction
TP : La bouteille magique : correction
Calcul de la masse de n= 6.10-2 mol d'HYDROXYDE DE SODIUM. Formule du composé ionique à l'état solide NaOH. Masse molaire M= 23+16+1=40 g/mol.
 La chimie verte adaptée aux exercices et aux expériences
La chimie verte adaptée aux exercices et aux expériences
Le terme de chimie verte (ou durable) renvoie vers une façon de pratiquer la La soi-disant “expérience de la bouteille bleue” (dont sont décrites un ...
 Exercice 10. La bouteille de butane
Exercice 10. La bouteille de butane
La constante des gaz parfaits vaut : R = 831 J?mol-1?K-1. Tous les gaz seront assimilés à des gaz parfaits. Une bouteille de gaz pour usage domestique
 Appendice: réponses aux exercices
Appendice: réponses aux exercices
littérature 6. le droit 7. l'informatique 8. la chimie. B. A2. Appendice: réponses aux exercices. Chapitre 2. UNIVERSITÉ DE CAEN.
 Français interactif
Français interactif
Students also categorize vocabulary in the “Chassez l'intrus” exercises. Phonetics la chimie chemistry l'informatique (f) ... 1 bouteille de vin rouge.
 TP15 La chimie du liquide magique
TP15 La chimie du liquide magique
LE PROTOCOLE À SUIVRE pour réaliser le liquide magique est donc le suivant : Lorsque la bouteille est agitée le dioxygène qui se trouve dans l'air de ...
 [PDF] Exercice : La bouteille magique Corrigé
[PDF] Exercice : La bouteille magique Corrigé
Exercice : La bouteille magique D'après épreuve de BAC Terminale S Afrique 2008 Corrigé 2008-2009 1- Équation de la réaction modélisant la
 [PDF] Exercice : La bouteille magique
[PDF] Exercice : La bouteille magique
Exercice : La bouteille magique D'après épreuve de BAC Terminale S Afrique 2008 2008-2009 Au cours d'une séance de travaux pratiques
 Exercice : La bouteille magique - Yumpu
Exercice : La bouteille magique - Yumpu
12 juil 2015 · Le glucose est noté RCHO (aq) Sa masse molaire vaut M = 180g mol -1 Couples oxydant/réducteur mis en jeu :• BM + (aq)/BMH (aq)• O 2(g) /H 2 O
 Exercice III La bouteille magique (4 pts)
Exercice III La bouteille magique (4 pts)
1 1 Un oxydant est une espèce chimique capable de capter un ou plusieurs électrons Un réducteur est exercices corriges pdf
 Travaux pratiques sur la bouteille magique - correction - Docsity
Travaux pratiques sur la bouteille magique - correction - Docsity
Télécharge Travaux pratiques sur la bouteille magique - correction et plus Exercices au format PDF de Chimie sur Docsity uniquement!
 Travaux pratiques sur la bouteille magique Exercices Chimie
Travaux pratiques sur la bouteille magique Exercices Chimie
Télécharge Travaux pratiques sur la bouteille magique et plus Exercices au format PDF de Chimie sur Docsity uniquement! Afrique 2008 EXERCICE III
 [PDF] Activité expérimentale n°2 : LE LIQUIDE MAGIQUE
[PDF] Activité expérimentale n°2 : LE LIQUIDE MAGIQUE
Le schtroumpf curieux vient de dérober la recette d'un liquide magique chez Gargamel 1 AIDONS LE SCHTROUMPF CURIEUX chimie arrive à le réaliser
 La bouteille magique - Labolycée
La bouteille magique - Labolycée
Bac S 2003-2012Tronc communChimieLa transformation d'un système chimique est-elle toujours rapide ? Durée 52 minutes 2008 Centres étrangers
 Examen corrige TS Chimie La bouteille magique Exercice résolu
Examen corrige TS Chimie La bouteille magique Exercice résolu
s p a c e 1re s physique manuel de l eleve pdf 250 exercices corriges de svt exercices de chimie 1ère eurin gié 1ère s et e page 155 corriges du livre
 [PDF] CHIMIE Partie I - La bouteille magique - Concours Agro Veto
[PDF] CHIMIE Partie I - La bouteille magique - Concours Agro Veto
Dans la suite on s'intéresse plus particulièrement au tour de la « bouteille magique » A grands renforts de mise en scène le magicien prépare une solution

1ere SExercice : La bouteille magique
D'après épreuve de BAC Terminale S Afrique 20082008-2009Au cours d'une séance de travaux pratiques, un élève de terminale S doit réaliser le mélange réactionnel
décrit dans le protocole expérimental suivant :Protocole expérimental :
•Dans un erlenmeyer contenant une solution S dont on ne se souciera pas du contenu, on dissout du glucose. •On ajoute une solution de bleu de méthylène. Cette solution donne une coloration bleue au mélange réactionnel. •On constate que la solution bleue devient progressivement incolore. •Boucher l'erlenmeyer et agiter vigoureusement : la solution devient immédiatement bleue puis se décolore progressivement. •Agiter une nouvelle fois : la solution devient tout de suite bleue puis se décolore progressivement.Données du problème :
•La seule espèce colorée dans le mélange réactionnel est la forme oxydée du bleu de
méthylène qui donne une coloration bleue. Elle est notée BM+(aq). •La forme réduite du bleu de méthylène est notée BMH(aq).•Dans les conditions de l'expérience, le glucose est un réducteur qui réduit le bleu de
méthylène. On admettra qu'il est introduit en large excès devant les autres réactifs. •Le glucose est noté RCHO(aq). Sa masse molaire vaut M = 180g.mol-1.Couples oxydant/réducteur mis en jeu :
•BM+(aq)/BMH(aq) •O2(g)/H2O (l) •RCOOH(aq)/RCHO(aq)1- Équation de la réaction modélisant la transformation chimique entre le glucose et la
solution de bleu de méthylène.1-1) Donner la définition d'un oxydant puis d'un réducteur.
1-2) Ecrire la demi-équation électronique de réduction de la forme oxydée BM+(aq) du bleu de
méthylène.1-3) Ecrire la demi-équation électronique d'oxydation du glucose RCHO(aq).
1-4) En déduire que l'équation d'oxydoréduction entre le glucose et la forme oxydée du bleu de
bromothymol est : RCHO(aq) + BM+(aq) + H2O (l) RCOOH(aq) + BMH(aq) + H+(aq)(équation 1)Cette réaction est lente.
2- Interprétation des observations :
Lorsque l'on agite l'erlenmeyer, une partie du dioxygène de l'air se dissout dans la solution puis réagit en
oxydant la forme réduite du bleu de méthylène. Cette réaction est rapide.2-1) Montrer que l'équation chimique modélisant cette transformation chimique est :
2 BMH(aq) + O2(aq) + 2H+(aq) 2H2O (l) + 2BM+(aq)(équation 2)
2-2) A l'aide des caractéristiques des équations chimiques 1 et 2, expliquer les variations de
couleur observées lors de l'expérience et leurs vitesses.3- Étude quantitative :
L'erlenmeyer dans lequel l'élève réalise l'expérience est bouché hermétiquement et contient un volume
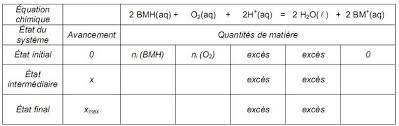
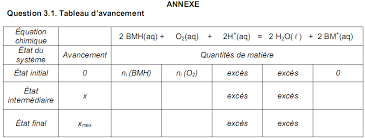
V(O2) = 48 mL de dioxygène et 5,0g de glucose RCHO. Le volume molaire des gaz dans les conditions de l'expérience vaut Vm = 24,0 L.mol-1.3-1) Compléter de façon littérale et en respectant les notations, le tableau d'avancement de
l'ANNEXE.3-2) Calculer la quantité de matière initiale ni(O2) de dioxygène contenu dans l'erlenmeyer.
On réalise une série d'agitations successives qui permet de dissoudre tout le dioxygène présent
dans l'erlenmeyer.3-3) En déduire la quantité de matière ni(BMH) susceptible de réagir avec la quantité de matière
initiale ni(O2) de dioxygène.3-4) A partir de l'équation 1, montrer que la quantité de matière de glucose n(RCHO) ayant
réagi au cours de l'expérience est 4,0×10-3mol. On pourra s'aider d'un tableau d'avancement.
3-5) En déduire la masse m de glucose n'ayant pas réagi dans l'erlenmeyer.
quotesdbs_dbs28.pdfusesText_34[PDF] conservation de l'eau potable
[PDF] durée conservation eau distillée
[PDF] combien de temps peut on conserver de l eau distillée
[PDF] conservation eau demineralisee
[PDF] expérience évaporation de l'eau
[PDF] combien de temps peut on conserver de l'eau en bouteille
[PDF] eau stérile conservation
[PDF] 20 expériences avec l'eau et la glace
[PDF] images séquentielles glaçon qui fond
[PDF] a quelle temperature fond un glacon
[PDF] ballon de stockage eau glacée
[PDF] a quelle température la glace fond elle
[PDF] dimensionnement ballon tampon eau glacée
[PDF] exercice fonte d un glaçon
