 Chapitre 2 :Quantification de lénergie de latome dhydrogène
Chapitre 2 :Quantification de lénergie de latome dhydrogène
L'électron de l'atome d'hydrogène ne possède qu'un nombre limité d'états accessibles. Chaque état possède une énergie invariante (quantification des niveaux
 CHAPITRE III : QUANTIFICATION DE LENERGIE
CHAPITRE III : QUANTIFICATION DE LENERGIE
Le modèle de Bohr est une théorie physique cherchant à comprendre la constitution d'un atome et plus particulièrement celui de l'hydrogène et des ions
 QUANTIFICATION DE LÉNERGIE DES ATOMES
QUANTIFICATION DE LÉNERGIE DES ATOMES
On dit qu'on a un spectre de raies On a donc une quantification de l'énergie des atomes. b) Relation entre la longueur d'onde et l'énergie de l'onde. Lors de la
 Chapitre II : Quantification de lénergie
Chapitre II : Quantification de lénergie
Dans l'atome le noyau est immobile alors que l'électron de masse m se déplace autour du noyau selon une orbite circulaire de rayon r. • L'électron déplace sur
 A la découverte de la quantification des niveaux dénergie
A la découverte de la quantification des niveaux dénergie
Mots clés de recherche : quantification des niveaux d'énergie photon
 DL n 14 : Atome de Bohr
DL n 14 : Atome de Bohr
Pour quantifier l'énergie de l'électron Bohr ajouta un troisi`eme pos- tulat ou condition de quantification : les seules trajectoires circulaires. Page 2. DL
 Chapitre 5 QUANTIFICATION DES ÉNERGIES ATOMIQUES.
Chapitre 5 QUANTIFICATION DES ÉNERGIES ATOMIQUES.
l'atome est négative les termes spectraux
 MECANIQUE QUANTIQUE
MECANIQUE QUANTIQUE
Oscillateur Harmomique. •. Puits de potentiel. •. Potentiel en atome d'Hydrogène (Cours 14 et 15). Quantification de l'énergie pour des systèmes simples.
 I- La quantification de lénergie transférée à un atome - 1
I- La quantification de lénergie transférée à un atome - 1
b- Principe. ? Les atomes de vapeur de mercure à faible pression sont bombardés avec des électrons d'énergie cinétique Ec variables.
 Cours LS1 - Interactions rayonnements ionisants
Cours LS1 - Interactions rayonnements ionisants
rayonnements ionisants : rayonnements qui provoquent l'ionisation de l'atome ; pour le vivant sont ionisantes les radiations d'énergie > 124 eV.
 [PDF] Chapitre 2 :Quantification de lénergie de latome dhydrogène
[PDF] Chapitre 2 :Quantification de lénergie de latome dhydrogène
Chaque état possède une énergie invariante (quantification des niveaux d'énergie de l'hydrogène) Postulat optique : La transition entre deux états accessibles
 [PDF] CHAPITRE III : QUANTIFICATION DE LENERGIE
[PDF] CHAPITRE III : QUANTIFICATION DE LENERGIE
CHAPITRE III : QUANTIFICATION DE L'ENERGIE III-1 MODÈLE ATOMIQUE DE BOHR (CAS DE L'ATOME D'HYDROGÉNE) Le modèle de Bohr est une théorie physique
 [PDF] QUANTIFICATION DE LÉNERGIE DES ATOMES
[PDF] QUANTIFICATION DE LÉNERGIE DES ATOMES
On dit qu'on a un spectre de raies On a donc une quantification de l'énergie des atomes b) Relation entre la longueur d'onde et l'énergie de l'onde Lors de la
 [PDF] quantification des niveaux dénergie - Académie dOrléans-Tours
[PDF] quantification des niveaux dénergie - Académie dOrléans-Tours
Mots clés de recherche : quantification des niveaux d'énergie photon modèle de l'atome spectre de l'hydrogène Provenance : Académie d'Orléans-Tours
 [PDF] CHAPITRE IV Modèles Atomiques Et Quantification Energétique
[PDF] CHAPITRE IV Modèles Atomiques Et Quantification Energétique
Chapitre IV: Modèles Atomiques et Quantifications Energétique 54 I- Introduction : L'atome avec ses constituants n'est pas un élément statique du faite de
 [PDF] Quantification de lénergie pour les systèmes simples
[PDF] Quantification de lénergie pour les systèmes simples
On peut classer les niveaux par valeur croissante de l'énergie en fonction du nombre de nœuds (points où le signe change) de la fonction d'onde V(x) 1er état
 [PDF] I- La quantification de lénergie transférée à un atome
[PDF] I- La quantification de lénergie transférée à un atome
L'expérience de Franck et Hertz met en évidence la quantification du transfert d'énergie entre un atome et le milieu extérieur 2- Niveaux d'énergie d'un
 [PDF] Modèle de Bohr (1913)
[PDF] Modèle de Bohr (1913)
L'atome peut passer d'un état d'énergie Ei à un état d'énergie Ef par absorption ou emission -Quantification des niveaux d'énergie (Modèle de Bohr)
 [PDF] Chapitre II Latome dhydrogène
[PDF] Chapitre II Latome dhydrogène
L'énergie potentielle de l'atome de nature purement électrostatique s'écrit en fonction de la distance r de l'électron au noyau L'opérateur associé est la
 Quantification de lénergie
Quantification de lénergie
Jusqu'au début du XXeme siècle la mécanique classique prévoyait un continuum de valeurs possibles entre deux niveaux d'énergie d'un atome
C'est quoi la quantification de l'énergie ?
Au niveau quantique, les particules sont des ondes et leur forme n'est pas aléatoire. Elle est déterminée par le niveau d'énergie de la particule. Ce phénomène s'appelle la quantification. Ces paliers d'énergie trahissent la structure même des atomes et permettent leur modification.Comment calculer l'énergie de l'atome ?
Les niveaux d'énergie d'un ion hydrogéno? sont similaires à ceux de l'atome d"hydrogène : on a : En = - R Z2/n2, où Z est le nombre de charges de l'élément considéré, Z-1 étant la charge de l'ion hydrogéno? correspondant.Pourquoi l'énergie d'un atome est quantifiée dans le modèle de Bohr ?
Selon le modèle de Bohr, un électron absorbe de l'énergie sous forme de photons et acc? à un niveau d'énergie supérieur si et seulement si l'énergie du photon est égale à la différence d'énergie entre l'état initial et l'état final.- On peut relier le travail de sortie, �� , et l'énergie maximale des électrons, �� M a x , étant donnée la fréquence, �� , en utilisant la formule �� = �� �� ? �� M a x , où �� est la constante de Planck.
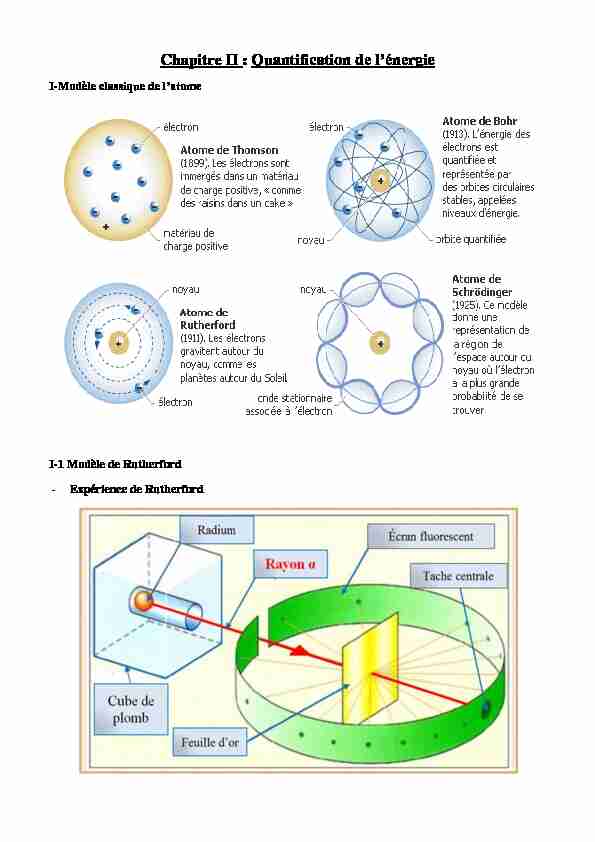
Chapitre II :
I-I-1 Modèle de Rutherford
- Expérience de RutherfordConstatations:
- lacunaire; ou les e- tournent autour comme les planètes autour du soleil. - d'attractionsélectrostatique Fa =F1dues à la différence d charges noyaux-électrons par les forces centrifuges Fc=
F2Les avantages : ce modèle ne fait appel qu
Les inconvénients :
- La théorie électromagnétique exige que l'électron rayonne des ondes électromagnétiques, donc il va
perdre de l'énergie et finirait par tomber sur le noyau.L'énergie lumineuse émise varie de façon continue. Ces deux conclusions sont en contradiction avec
les résultats expérimentaux (spectre discontinue).I-2- Modèle de Bohr 1913
I-2-1 Description (cas de l'atome d'hydrogène)
Pour remédier les contradictions précédentes, Bohr propose quatre hypothèses : selon une orbite circulaire de rayon r.déplace sur des orbites circulaires privilégiées sans émettre de l'énergie ; on les appelle
"orbites stationnaires" placées à des distances bien déterminées du noyau. il ya absorption de l'énergie Ȟ noyau ; il ya émission de l'énergie Ȟ si les électrons se rapproche du noyau¨E= Ȟ
moment cinétique) : h : constante de Planck (6,626.10-34J.s) et n : entier naturel.I-2-2 Aspect quantitatif de l'atome de Bohr
quotesdbs_dbs28.pdfusesText_34[PDF] epaisseur feuille papier 80 gr
[PDF] l'épaisseur d'une feuille de papier est 100 micromètres
[PDF] epaisseur du papier
[PDF] grammage papier bristol
[PDF] épaisseur feuille de papier en mm
[PDF] épaisseur d'une ramette de papier
[PDF] le monopole pdf
[PDF] maximisation du profit en monopole
[PDF] équilibre de marché microéconomie
[PDF] marché de concurrence pure et parfaite pdf
[PDF] quartile d'une série
[PDF] fonction affine 3eme
[PDF] calculer angle de réfraction
[PDF] indice de réfraction de l'eau salée
