 Calculer une quantité de matière
Calculer une quantité de matière
contient 12 mL d'éthanol pur. 1 Rechercher la formule chimique de l'éthanol. 2 En déduire sa masse molaire. 3 Quelle est la masse volumique de l'éthanol ? 4
 Chapitre 1 La quantité de matière la concentration molaire et le
Chapitre 1 La quantité de matière la concentration molaire et le
Va bene ! METHODE 2 : Savoir calculer la masse molaire moléculaire Détermination de la masse molaire de l'éthanol : M(C2H6O) = 2 x 120 + 6 x 1
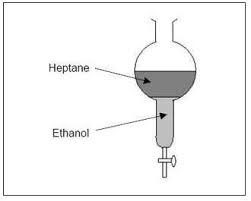 Grandeurs physiques liés à la quantité de matière Exercice 1
Grandeurs physiques liés à la quantité de matière Exercice 1
2- Calculer la densité de l'éthanol. Donnée : masse volumique d'eau : =1g.m −1. 3- On mélange
 Physique Chimie
Physique Chimie
Calculer la masse molaire moléculaire du glucose ainsi que celle de l'éthanol. 3. Calculer la quantité de matière présente dans 131 g de glucose. 4
 THÈME: CHIMIE ORGANIQUE TITRE DE LA LEÇON : LES ALCOOLS
THÈME: CHIMIE ORGANIQUE TITRE DE LA LEÇON : LES ALCOOLS
Un alcool saturé X contient en masse 2162% d'oxygène. 1.Calcule la masse molaire de X • combustibles : le méthanol et l'éthanol peuvent remplacer l'essence ...
 EXERCICES AUTOUR DES QUANTITÉS DE MATIÈRE
EXERCICES AUTOUR DES QUANTITÉS DE MATIÈRE
Calculer la masse molaire moléculaire du saccharose sachant que sa formule est C12H22O11. Quelle masse d'éthanol cela représente-t-il ? Pour calculer la masse ...
 CORRIGÉ
CORRIGÉ
26 jan. 2018 équilibre avec l'éthanol dissout dans son sang calculer le taux d'alcoolémie de ... Masse molaire de l'éthanol C. 2. H. 6. O : M = 46
 Les solutions
Les solutions
Calculer les fractions massiques et molaires d'une solution composée de 10 g d'éthanol et 70 g d'eau. L'eau H2O a une masse molaire de 18 g.mol-1 et l'éthanol
 Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
Masse molaire de l'ibuprofène : M(C13H18O2) = 206 g.mol-1. ACCÈS CORRECTION. Page Calculer l'écart relatif entre la masse théorique et la masse expérimentale.
 ⇒ ρ ρ ρ
⇒ ρ ρ ρ
La masse molaire d'un tel mélange est donc de : = (075 2) + (0
 Chapitre 1 La quantité de matière la concentration molaire et le
Chapitre 1 La quantité de matière la concentration molaire et le
METHODE 2 : Savoir calculer la masse molaire moléculaire. ? Principe Exemple : Etude d'une réaction entre le sodium et l'éthanol.
 Calculer une quantité de matière
Calculer une quantité de matière
1 Rechercher la formule chimique de l'éthanol. 2 En déduire sa masse molaire. 3 Quelle est la masse volumique de l'éthanol ? 4 Calculer la quantité de
 Grandeurs physiques liés à la quantité de matière Exercice 1
Grandeurs physiques liés à la quantité de matière Exercice 1
2- Calculer la densité de l'éthanol. Donnée : masse volumique d'eau : =1g.m ?1. 3- On mélange
 Exercice 1 : 150 mL déthanol ont une masse de 120g 1) Calculer la
Exercice 1 : 150 mL déthanol ont une masse de 120g 1) Calculer la
1) Calculer la masse volumique de l'éthanol en g.L-1. Méthode : ? Noter la formule de la masse volumique avec les unités correspondantes.
 Quantité de matière - Prophychi
Quantité de matière - Prophychi
Exprimer puis calculer la masse molaire de l'oxyde de fer. Exprimer puis calculer la Masse molaire moléculaire de l'éthanol : M éthanol = 46 g.mol-1.
 Fermentation
Fermentation
Calculer la masse molaire moléculaire du glucose ainsi que celle de l'éthanol. 3. Calculer la quantité de matière présente dans 131 g de glucose. 4. Sachant qu
 EXERCICES
EXERCICES
Correction. Masse molaire de l'éthanol. M(C2H6O) = 46 g.mol?1. On calcule la masse m du liquide connais- sant son volume V et sa masse volumique.
 Les solutions
Les solutions
Calculer les fractions massiques et molaires d'une solution composée de 10 g d'éthanol et 70 g d'eau. L'eau H2O a une masse molaire de 18 g.mol-1 et
 1ere S - programme 2011
1ere S - programme 2011
roulant au bioéthanol sachant qu'elle consomme 87 L au 100. Conclure. Données : masse volumique de l'éthanol ? = 0
 Fiche de synthèse n° 2.d Concentration et solubilité
Fiche de synthèse n° 2.d Concentration et solubilité
Calculer la masse maximale de glucose mmax que l'on peut dissoudre dans un volume V = 100 mL de solution. Données : -. Masse molaire du glucose : Mglucose
 [PDF] Chapitre 1 La quantité de matière la concentration molaire et le
[PDF] Chapitre 1 La quantité de matière la concentration molaire et le
Je vais vous apprendre à calculer la quantité de matière d'une espèce chimique à partir de sa masse puis de sa masse volumique et enfin de son volume molaire !
 [PDF] Calculer une quantité de matière
[PDF] Calculer une quantité de matière
1 Rechercher la formule chimique de l'éthanol 2 En déduire sa masse molaire 3 Quelle est la masse volumique de l'éthanol ? 4 Calculer la quantité de
 [PDF] Grandeurs physiques liés à la quantité de matière Exercice 1
[PDF] Grandeurs physiques liés à la quantité de matière Exercice 1
1- Calculer la masse d'éthanol contenu dans l'éprouvette 2- Calculer la densité de l'éthanol Donnée : masse volumique d'eau : =1g m ?1
 [PDF] Fiche de synthèse n° 2b Détermination de masses et de quantités
[PDF] Fiche de synthèse n° 2b Détermination de masses et de quantités
Exprimer puis calculer la masse d'éther diéthylique méther contenue dans la bouteille Masse molaire de l'alcool benzylique : Malcool = 108 g·mol–1
 [PDF] EXERCICES AUTOUR DES QUANTITÉS DE MATIÈRE
[PDF] EXERCICES AUTOUR DES QUANTITÉS DE MATIÈRE
Calculer la masse molaire moléculaire du saccharose sachant que sa formule est C12H22O11 2 Quelle est la quantité de matière de saccharose dissous 3
 [PDF] Chapitre 2 : La quantité de matière
[PDF] Chapitre 2 : La quantité de matière
Elle se calcule en additionnant les masses molaires des atomes qui constituent la molécule Exemple : masse molaire de l'éthanol de formule C2H6O L'éthanol est
 [PDF] Quantité de matière - Prophychi
[PDF] Quantité de matière - Prophychi
Exprimer puis calculer la masse molaire de l'oxyde de fer Quelle est la quantité de matière en éthanol présente dans 150 mL d'éthanol liquide ?
 Td corrigé 1ère S (Chimie) pdf
Td corrigé 1ère S (Chimie) pdf
Calculer la quantité de matière correspondant à 0920 g d'éthanol dont la (constituant des bougies) Formule brute H2O C6H8O6 C18H36O2 Masse molaire
 [PDF] CORRIGÉ DU SUJET DE CHIMIE
[PDF] CORRIGÉ DU SUJET DE CHIMIE
13 oct 2017 · 1) 1 Pt Justifier l'ordre de grandeur de la masse molaire du plomb par rapport à Z(Pb) Z = 82 M = 2072 g mol-1
Comment calculer la masse molaire d'éthanol ?
Pour tout résumer, la masse d'une molécule d'éthanol pourra s'écrire de la façon suivante :mEtoh = 2 mC 1mO 6mH. Nous obtenons donc, mEtoh = 2 x 12 16 6 x1 mC 1mO 6mH. mEtoh = 24 16 6. mEtoh = 46 g.Comment on calcule la masse molaire ?
La masse molaire moléculaire est égale à la somme des masses molaires atomiques des éléments chimiques constituant la molécule. L'unité est toujours le gramme par mole, notée g. mol–1. Ainsi, la masse molaire de la molécule d'eau H2O est : M(H2O) = 2 x M(H) + M(O) = 2 x 1,00 + 16,0 = 18,0 g.Comment calculer N avec V et M ?
Si on a une esp? liquide, on n'aura souvent pas la masse mais le volume. On reprend la formule : $n = \\dfrac{m}{M}$. Et puisqu'on n'a pas la masse mais le volume on va « convertir » la masse en volume en utilisant la masse volumique : $ ? =\\dfrac{m}{V}$. On obtient alors la formule : $ n =\\dfrac{ ?\\times V}{M}$.- Pour calculer la quantité de matière demandée, il faut donc utiliser la formule n = C × V, où n représente la quantité de matière d'ions argent. On notera donc n(Ag+) cette quantité.
CHAPITRE 1
DÉTERMINATION DE LA
COMPOSITION D"UN
SYSTÈME CHIMIQUE À
L"ÉTAT INITIAL
EXERCICES
Wulfran Fortin
Liste des exercices
11Masses molaires et quantités de
matièreExercice 1
Exercice 2
Exercice 3
Exercice 4
Exercice 5
2Concentr ationet quantités de ma-
tièreExercice 1
Exercice 2
Exercice 3
Exercice 4
3V olumemolaire d"un gaz
Exercice 1
Exercice 2
Exercice 3
Exercice 4
4Dosage spectro photométr ique
Exercice 1
Exercice 2
2Exercice 3
Exercice 4
Exercice 5
Exercice 6
3 ?Masses molair eset quantités de matière1 MASSES MOLAIRES ET QUANTITÉS DE MATIÈRE
Exercice ?
Énoncé
D"après Belin 2019.
Calculer la masse molaire des espèces chi-
miques ou composés ioniques suivants : 1.Le par acétamolde f ormule
C8H9NO2
2.Le diiode de f ormuleI2
3.Le carbonate de calcium de f ormule
CaCO 3 4.La vitamine C de f ormuleC6H8O6
5.Le sulf atede magnésium
heptahydraté de formule MgSO4,7H2O
6.Le sel de Mohr de f ormule
Fe(SO4)2(NH4)2,6H2O
1 MASSES MOLAIRES ET QUANTITÉS DE MATIÈRE
Correction
Pour le paracétamol
MC8H9NO2=8M(C)+9M(H)
+M(N)+2M(O) =812.0+91.0 +14.0+216.0 =151g.mol1Pour le diiode
M(I2) =2M(I)
=2126.9 =253.8g.mol1Pour le carbonate de calcium
M(CaCO3) =M(Ca)+M(C)+3M(O)
=40.1+12.0+316.0 =100.1g.mol11 MASSES MOLAIRES ET QUANTITÉS DE MATIÈRE
Pour la vitamine C
M(C6H8O6) =6M(C)+8M(H)
+6M(O) =612+81.0 +616.0=176g.mol1
Pour le sulfate de magnésium hydraté sept
fois, il faudra compter sept fois la masse mo- laire moléculaire de l"eau MMgSO4,7H2O=M(Mg)+M(S)+
4M(O)+7M(H2O)
=24.3+32.1 +416.0+7(21.0+16) =246.4g.mol1
Pour le sel de Mohr il faudra compter2fois
le groupeSO4,2fois le groupeNH4, et61 MASSES MOLAIRES ET QUANTITÉS DE MATIÈRE
fois la molécule d"eauH2O MFe(SO4)2(NH4)2,6H2O=
M(Fe)+2M(SO4)+2M(NH4)
+6M(H2O) =55.8+2(32.1+416.0)+
2(14.0+41.0)+
6(21.0+16.0) =
392g.mol1
1 MASSES MOLAIRES ET QUANTITÉS DE MATIÈRE
Exercice ?
Énoncé
D"après Belin 2019.
Une molécule d"eauH2Oa une masse
égale àmmolécule=2,991023g.
Calculer la masse molaire de l"eau de deux
manières différentes.1 MASSES MOLAIRES ET QUANTITÉS DE MATIÈRE
Correction
La première méthode est directe, on prend
une mole de molécules (soit le nombre d"Avogadro) et donc il suffit de multiplier la masse de la molécule par le nombre d"Avo- gadroM(H2O) =NAmmolécule
et doncM(H2O) =6.0221023
2,991023g
=18.0g.mol1 La deuxième façon de faire consiste à utili- ser les masses molaires atomiques de l"oxy- gène et de l"hydrogèneM(H2O) =2M(H)+M(O)
=21.0+16.0 =18.0g.mol11 MASSES MOLAIRES ET QUANTITÉS DE MATIÈRE
Exercice ?
Énoncé
D"après Belin 2019.
Recopier le tableau suivant et compléter les
valeurs manquantes.1 MASSES MOLAIRES ET QUANTITÉS DE MATIÈRE
ÉchantillonMasse
molaire (g.mol1Quantité de matière (mol)Masse (g)Saccharose C12H22O11(s)2.0102
Dioxyde
d"azoteNO2(g)1.5101Chloroforme CHCl3(g)5.0102
Table1 - Masses molaires, quantités de matière, masses1 MASSES MOLAIRES ET QUANTITÉS DE MATIÈRE
Correction
On calcule la masse molaire du saccharose
à partir de sa formule brute et des masses
molaires atomiqueM(C12H22O11(s))
=1212.0+221.0+1116.0 =342g.mol1Ensuite, connaissantnetMpour le sac-
charose, on peut calculer la massemde l"échantillon par la formule m=nM et donc n=0.02342=6.84gPour le dioxyde d"azote, on calcule sa
masse molaire moléculaireM(NO2(g)) =14.0+216.0
=46g.mol11 MASSES MOLAIRES ET QUANTITÉS DE MATIÈRE
Ensuite, connaissant la massemde
l"échantillon ainsi que la masse molaire mo- léculaireM, on applique la formule n=mM et donc la quantité de matière vaut n=0.15g46g.mol1=3.3103molEnfin, pour le Chloroforme
M(CHCl3(g)) =12.0+1.0+335.5
=119.5g.mol1 et comme m=nM on a m=5.0102119.5g.mol1=6.0g1 MASSES MOLAIRES ET QUANTITÉS DE MATIÈRE
Exercice ?
Énoncé
D"après Belin 2019.
La posologie quotidienne maximale d"aspi-
rineC9H8O4est de3.0g. a.Calculer la masse molaire de l"aspirine. b.Exprimer puis calculer la quantité de ma- tière maximale d"aspirine autorisée par jour. c.En déduire le nombre maximum de molé- cules d"aspirine pouvant être absorbées quotidiennement.1 MASSES MOLAIRES ET QUANTITÉS DE MATIÈRE
Correction
a.M(C9H8O4) =912.0+8.0+416.5
=180g.mol1 b.On utilise la formule n=mM et on obtient n=3.0180 =17mmol c.On utilise la formule N=NAn et on obtientN=6.02210230.0166
=1.001022molécules1 MASSES MOLAIRES ET QUANTITÉS DE MATIÈRE
Exercice ?
Énoncé
D"après Belin 2019.
Recopier et compléter les valeurs
manquantes du tableau pour les liquides donnés1 MASSES MOLAIRES ET QUANTITÉS DE MATIÈRE
LiquidesM
(g.mol1) (g.mol1)n (mol)V(mL)m (g)Éthanol C2H6O0.7915
Dichloro
méthane CH2Cl21.32.0
10 2 Table2 - Masses molaires, quantités de matière, masses, masses volumiques1 MASSES MOLAIRES ET QUANTITÉS DE MATIÈRE
Correction
Masse molaire de l"éthanol
M(C2H6O) =46g.mol1
On calcule la massemdu liquide connais-
sant son volumeVet sa masse volumique après avoir bien vérifié les unités des va- leurs m=V donc m=0.79g.mL115mL=11.9g On peut enfin calculer la quantité de matière nen utilisant la formule n=mM n=11.9g46g.mol1=0.26molPour le dichlorométhane
M(CH2Cl2) =85g.mol1
1 MASSES MOLAIRES ET QUANTITÉS DE MATIÈRE
Comme on connaîtnetMon peut calculer
mpar la formule m=nM donc m=2.0102mol85g.mol1=1.7g connaissant la massemet la masse volu- miqueon peut calculer le volume du li- quide par la formule V=m et doncV=1.7g1.3g.mL1
1 MASSES MOLAIRES ET QUANTITÉS DE MATIÈRE
Concentr ationet quantités de
matière2 CONCENTRATION ET QUANTITÉS DE MATIÈRE
Exercice ?
Énoncé
D"après Belin 2019.
Une solution aqueuse de volumeVsolution=
200mLcontient1.0102mol
d"hydroxyde de sodiumNaOH. a.Calculer la concentration en quantité de matièreCde la solution d"hydroxyde de so- dium. b.En déduire la concentration en masseCm de la solution.2 CONCENTRATION ET QUANTITÉS DE MATIÈRE
Correction
a.On calcule la concentration molaire à l"aide de la formule C=nV et on effectue le calcul en étant attentif aux unitésC=1.0102mol200103L=0,050mol.L1
b.On calcule la masse molaire de l"hydroxyde de sodiumM(NaOH) =23.0+16.0+1.0
=40g.mol1On peut alors calculer la masse d"hydroxyde
de sodium m=nM donc m=1.010240=0.4g2 CONCENTRATION ET QUANTITÉS DE MATIÈRE
On calcule enfin la concentration massique
C m=mV =0.4g0,200L=2.0g.L12 CONCENTRATION ET QUANTITÉS DE MATIÈRE
Exercice ?
Énoncé
D"après Belin 2019.
Dans le cas d"une déshydratation, il peut
être administré par perfusion une solution
de glucoseC6H12O6de concentration en quantité de matièreC=278mmol.L1. a.Calculer la masse molaire du glucose. b.Calculer la masse de glucose contenue dans une perfusion de500mLen combi- nant deux formules.2 CONCENTRATION ET QUANTITÉS DE MATIÈRE
Correction
a.Masse molaire du glucoseM(C6H12O6) =
=612.0+121.0+616.0 =180g.mol1 b.On calcule la quantité de matière conte- nue dans un volume de solution n=CVOn peut alors calculer la masse de glucose
m=nMEn combinant ces deux formules
m=CMV2 CONCENTRATION ET QUANTITÉS DE MATIÈRE
On effectue le calcul en étant attentif aux
unités m=CMV =278mmol.L1180g.mol1 500mL=278103mol.L1180g.mol1
0,500L
=25g.L12 CONCENTRATION ET QUANTITÉS DE MATIÈRE
Exercice ?
Énoncé
D"après Belin 2019.
Pour limiter l"apparition de crampes après
un effort sportif intense, il est possible de boire une solution de bicarbonate de sodium fabriquée par dissolution de10gde bicar- bonate de sodiumNaHCO3dans l"eau afin d"obtenir un litre de solution. a.Calculer la masse molaire du bicarbonate de sodium. b.Calculer la concentration en masse puis la concentration en quantité de matière de la solution obtenue. c.Retrouver la concentration en quantité de matière à partir des données de l"énoncé et de la masse molaire du bicarbonate de so- dium, en combinant deux formules.2 CONCENTRATION ET QUANTITÉS DE MATIÈRE
Correction
a.Masse molaireM(NaHCO3) =23.0+1.0+12+316.0
=84g.mol1 b.Concentration en masse C m=mV10g1.0L
=10g.L1Concentration en quantité de matière
C=nV mM V =mMV10g84g.mol11.0L
=0.12mol.L12 CONCENTRATION ET QUANTITÉS DE MATIÈRE
c.Voir ci dessus.2 CONCENTRATION ET QUANTITÉS DE MATIÈRE
Exercice ?
Énoncé
D"après Belin 2019.
quotesdbs_dbs15.pdfusesText_21[PDF] masse molaire methanol
[PDF] quantité de matière du saccharose
[PDF] c12h22o11 we're goin’ down
[PDF] calculer la masse molaire moléculaire
[PDF] masse d un morceau de sucre
[PDF] masse molaire fructose
[PDF] tableau d'effectif et de frequence
[PDF] calcul moyenne statistique avec intervalle
[PDF] moyenne statistique formule
[PDF] calcul perimetre cercle
[PDF] la régulation de la pression artérielle
[PDF] un tir de mine a été effectué dans une carrière correction
[PDF] corriger un tir de mine a été effectué dans une carrière
[PDF] profondeur moho sismolog
