 CODE: SVT DURÉE : 4H
CODE: SVT DURÉE : 4H
1-a-Calcul de la pression osmotique du NaCl. On a C=5mol/l. Page 8. 8. T = t+273°. T = 28+273 = 301°K. Le coefficient d'ionisation n est : NaCl. Na+ + Cl- Donc
 osmolarite.pdf
osmolarite.pdf
exemple : calcul de la pression osmotique due à une solution de. 10 mM de NaCl à 20°C. n/V = 10 mM. NaCl en solution : se dissocie en Na+ et Cl-. → i = 2.
 Solvants solutés et règles de dilution
Solvants solutés et règles de dilution
Isotonie : solutions qui ont la même pression osmotique (= concentration NaCl 09% devient NaCl 9‰. 46. Elise Rochais - IFSI 1ère année. Page 47 ...
 TP de Physiologie Animale :Hémolyse
TP de Physiologie Animale :Hémolyse
La membrane de cellule est capable de résister à cette pression osmotique exercée par la solution de NaCl à 6 ‰ . Le milieu extérieur est donc hypotonique
 Solutés de remplissage en anesthésie réanimation
Solutés de remplissage en anesthésie réanimation
• Pression osmotique exercée par une molécule-gramme d'un corps non ionisé • NaCl 9 g/L d'eau. • Masse molaire. – Cl: 355 g.mol-1. – Na: 23 g.mol-1. – NaCl ...
 Théorie et pratique des mesures de la pression osmotique par
Théorie et pratique des mesures de la pression osmotique par
unités convenables;. T : température absolue T = 273
 CORRIGE
CORRIGE
Comment une augmentation de la pression osmotique est-elle corrigée par l'hormone ADH ? Nous rappellerons les conséquences d'une ingestion de NaCl sur la
 Losmose inverse
Losmose inverse
calcul de la pression osmotique : π = R T c i où i est le nombre d'ions dissociés (deux dans le cas de NaCl) et c la concentra- tion molaire du soluté de
 DEBIT de FILTRATION GLOMERULAIRE DEBIT SANGUIN RENAL
DEBIT de FILTRATION GLOMERULAIRE DEBIT SANGUIN RENAL
23 mar. 2016 La pression oncotique est la force osmotique induite par les protéines ne passant pas la barrière de filtration et générant de ce fait un ...
 Compartiments hydriques et osmorégulation
Compartiments hydriques et osmorégulation
A = solution NaCl. B = solution NaCl + protéines. • • • •. • • • •. • • • •. A B. Pression osmotique et pression oncotique. Page 12. Transferts d 'eau. • Les
 osmolarite.pdf
osmolarite.pdf
NaCl saccharose. 453 hPa mise en évidence de la pression osmotique expériences exemple : calcul de l'osmolarité d'une solution de 10 mM de NaCl.
 Untitled
Untitled
calcul de la pression osmotique en unités internationale : Pascal (Pa) contenant 10 M de saccharose et d'une solution B contenant 10 M de NaCl.
 TD eau et régulation osmotique
TD eau et régulation osmotique
Calculer la molarité d'une solution aqueuse contenant 585 mg de NaCl par litre différence de pression osmotique entre les deux compartiments.
 Solvants solutés et règles de dilution
Solvants solutés et règles de dilution
Isotonie : solutions qui ont la même pression osmotique (= concentration en ions dissous) eau PPI dilution possible ensuite dans G5% ou NaCl 0
 (Démonstration cours )
(Démonstration cours )
de congélation est de -063°C
 a) Donner la définition de la molarité dune solution. b) Calculer la
a) Donner la définition de la molarité dune solution. b) Calculer la
exercice 4 : osmose pression osmotique. On place la solution précédente de NaCl (exercice 2 c) dans le compartiment de gauche.
 Solutés de remplissage en anesthésie réanimation
Solutés de remplissage en anesthésie réanimation
Sérum physiologique (NaCl 09%) Pression. • Pression hydrostatique. • Pression osmotique ... Calculer l'osmolarité du sérum physiologique ...
 Etude dune proteine membranaire des hematies
Etude dune proteine membranaire des hematies
même pour la solution de Glycérol d'Urée et de NaCl à 9‰. Réponse à la question I-A.2.b Bonus : calcul pression osmotique.
 Item 265 - ANOMALIES DU BILAN DE LEAU ET DU SODIUM
Item 265 - ANOMALIES DU BILAN DE LEAU ET DU SODIUM
14 set 2018 différences de pression hydrostatique et oncotique (correspondant au ... h de soluté de chlorure de sodium hypo-osmotique (NaCl à 45 ‰).
 Travail dirigé 7 : les propriétés colligatives
Travail dirigé 7 : les propriétés colligatives
14 ott 2015 Calculer la pression osmotique d'un mélange de 2 g de saccharose (Mr = 342) ... concentration d'une solution aqueuse de NaCl qui peut être ...
 [PDF] osmolaritepdf - e-fisio
[PDF] osmolaritepdf - e-fisio
10 mM NaCl membrane semi-perméable = perméable à l'eau imperméable aux solutés saccharose NaCl mise en évidence de la pression osmotique expériences
 [PDF] Théorie et pratique des mesures de la pression osmotique - Agritrop
[PDF] Théorie et pratique des mesures de la pression osmotique - Agritrop
Pour l'urée 1 osmole vaut 60 g d'urée Pour NaCl on ne pourra définir que les osmoles de Na+ et de CL- puisqu'en solution il y a dissociation de
 [PDF] TD eau et régulation osmotique
[PDF] TD eau et régulation osmotique
Calculer la molarité d'une solution aqueuse contenant 585 mg de NaCl par litre d'eau différence de pression osmotique entre les deux compartiments
 [PDF] Pression osmotique osmolalité - osmolarité - PharmaEtudes
[PDF] Pression osmotique osmolalité - osmolarité - PharmaEtudes
o Pression osmotique = pression empêchant un solvant 1 mmol de NaCL = 2 mosm = 1 mosm de Na+ et 1 mosm de Cl- o Calcul de la clairance osmolaire
 [PDF] Pression osmotique exercice pdf - Squarespace
[PDF] Pression osmotique exercice pdf - Squarespace
Son unité est l'équivalent (Eq) Calculer la concentration ionique de la solution précédente NaCl est à la concentration de 10 mM Chaque mole de NaCl porte
 [PDF] Osmose Pression osmotique
[PDF] Osmose Pression osmotique
Calcul du flux osmotique Loi de Fick Expressions de la Pression osmotique • Un seul soluté neutre NaCl g/l 100 proportion d'hématies lysées
 [PDF] Chapitre 2 - opsuniv-batna2dz
[PDF] Chapitre 2 - opsuniv-batna2dz
Calcul de la pression osmotique en unités internationale : Pascal (Pa) ? = R T ? saccharose et d'une solution B contenant 10m M de NaCl
 [PDF] TD de BIOPYSIQUE - Exercices corrigés - F2School
[PDF] TD de BIOPYSIQUE - Exercices corrigés - F2School
Les unités de calcul utilisé sont souvent dans le système MKS les Pour calculer la pression osmotique on doit déterminer la concentration
Comment calculer la pression osmotique en ATM ?
Cette pression osmotique peut être mesurée directement avec un osmomètre, ou elle peut être calculée à partir de la concentration de soluté dans la cellule (C) à partir de la relation (formule de van Hoff) : ? = RTC; où R est la constante de gaz, T est la température absolue (en degrés Kelvin) et C est la concentrationComment calculer la pression osmotique d'une solution de saccharose ?
On a donc :
1Pour le saccharose : Osm = m = 0,006*10 = 0,06 mol/L.2Pour le glucose : Osm = m = 0,011*10 = 0,11 mol/L.3Ainsi, il ne te reste plus qu'à additionner les deux pressions osmotiques de tes deux solutions pour obtenir celle du mélange :4Osm = 0,06 + 0,11 = 0,17.Comment se fait la pression osmotique ?
La pression osmotique naît de la séparation par une membrane* semi-perméable de deux compartiments de concentrations différente. L'eau migre du compartiment le moins concentré vers le plus concentré afin d'« équilibrer » le système pour avoir la même force ionique dans les deux compartiments.- Osm calculée = Natrémie x 2 + Glycémie + Urémie. Osm efficace (=tonicité) = Natrémie x 2 + Glycémie.
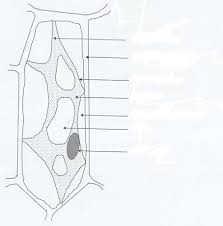
ÉÉtiennetienneRouxRouxAdaptation cardiovasculaire Adaptation cardiovasculaire ààll''ischischéémiemieINSERM U INSERM U 10341034
UFR des Sciences de la Vie Universit
UFR des Sciences de la Vie UniversitééBordeaux SegalenBordeaux Segalen contact: contact: etienne.rouxetienne.roux@u@u--bordeaux2.frbordeaux2.fr support de cours : support de cours : plateforme p plateforme péédagogiquedagogiquell''UFR des sciences de la UFR des sciences de la VieVie e e--fisio.netfisio.net plan du cours (format pdf) diaporama du cours (format ppt) rappel de calcul de base (format ppt) ll''osmolaritosmolaritéé planI .mise en évidence de la pression osmotique
II. caractéristiques physiques de l'osmolarité III. osmolarité et volume cellulaire : les cellules dans l'organismeIV. pression oncotique : les compartiments de
l'organisme I. mise en I. mise en éévidence devidence dela pression osmotiquela pression osmotique observation expérimentale définitions pression osmotique osmose osmolarité osmolarité - osmolalité mise en mise en éévidence devidence dela pression osmotiquela pression osmotique expériences eau10 mM saccharose
membrane semi-perméable = perméable à l'eau imperméable aux solutés saccharose eau10 mM saccharose
membrane semi-perméable = perméable à l'eau imperméable aux solutéspression sur le piston saccharose244 hPa
mise en mise en éévidence devidence dela pression osmotiquela pression osmotique expériences eau10 mM NaCl
membrane semi-perméable = perméable à l'eau imperméable aux solutés saccharose NaCl mise en mise en éévidence devidence dela pression osmotiquela pression osmotique expériences eau10 mM NaCl
membrane semi-perméable = perméable à l'eau imperméable aux solutéspression sur le piston NaCl saccharose453 hPa
mise en mise en éévidence devidence dela pression osmotiquela pression osmotique expériences mise en mise en éévidence devidence dela pression osmotiquela pression osmotique définition pression osmotique La pression osmotique est la pression exercée par les particules en solution, et responsable de l'osmose. osmose mouvement d'eau à travers une membrane semi-perméable, du compartiment le moins concentré en particules en solution vers le compartiment le plus en particules en solution. osmolarité L'osmolarité d'une solution est le nombre de moles de particules en solution dans 1 litre de solution.1 osmole (osm) correspond à une mole de particules.
mise en mise en éévidence devidence dela pression osmotiquela pression osmotique définition molarité et molalité La molarité est la concentration exprimée en moles par litre de solution. Une solution qui contient une mole par litre est une solution molaire. La molalité est la concentration exprimée en moles par kg d'eau. Une solution qui contient une mole par kg d'eau est une solution molale. osmolarité et osmolalité L'osmolarité d'une solution est le nombre de moles de particules en solution dans 1 litre de solution. L'osmolalité est le nombre de moles de particules en solution dans 1 kg d'eau. II. physique de lII. physique de l''osmolaritosmolaritéé osmolarité d'une solution ; coefficient osmotique exemples de calculs coefficient osmotique la loi de van't Hoff définition unités exemples osmolarité d'un mélange de solutés osmolarité efficace solutés imperméants solutés perméants dynamique de l'osmose physique dephysique dell''osmolaritosmolaritéé osmolarité L'osmolarité d'une solution est le nombre de moles de particules en solution dans 1 litre de solution.1 osmole (osm) correspond à une mole de particules.
exemple : calcul de l'osmolarité d'une solution de 10 mM de saccharose10 mM = 0,001 mol/L = 10
-3 mol/ L = 10 mol/m 3 saccharose = soluble dans l'eau en solution : ne se dissocie pas1 molécule de sacharose en solution = 1 particule en solution
10 millimoles de saccharose 10 milliosmoles de saccharose
osmolarité L'osmolarité d'une solution est le nombre de moles de particules en solution dans 1 litre de solution.1 osmole (osm) correspond à une mole de particules.
exemple : calcul de l'osmolaritéd'une solution de 10 mM de NaCl10 mM = 0,001 mol/L = 10
-3 mol/ L = 10 mol/m 3NaCl = soluble dans l'eau
en solution : se dissocie en Na et Cl1 molécule de NaCl en solution 2 particules en solution*
(*tout le NaCl ne de dissocie pas en Na et Cl10 millimoles de NaCl 20 milliosmoles de NaCl
physique dephysique dell''osmolaritosmolaritéé osmolarité l'osmolarité dépend de : concentration en soluté nombre de particules effectivement formées par la dissociation du soluté: nombre de particules formées par la dissociation d'une molécule de soluté facteur de correction : toutes les molécules de soluté ne se dissocient pas en solution coefficient osmotique physique dephysique dell''osmolaritosmolaritéé osmolarité osmolarité = (n/V).i. nnombre de moles de solutéV: volume
n/V = molarité de la solution i : nombre de particules formées par dissociation du soluté (phi) : coefficient osmotique = facteur de correction (NB: n'est pas le pourcentage de dissociation) coefficient osmotique 1 exemples : MgCl 2 : = 0, = 3NaCl : = 0, = 2
= 1 dans 2 cas i>1 (le soluté se dissocie en solution) = 1 si 100% de dissociation i=1 (le soluté ne se dissocie pas en solution) = 1 (pas de correction) physique dephysique dell''osmolaritosmolaritéé loi de van't Hoff La pression osmotique d'une solution est donnée par la loi de van't Hoff, dérivée de la loi sur les gaz parfaits. = R.T.(n/V).i.R : constante des gaz parfaits
T : température
nnombre de moles de soluté V: volume (!!! l'unité internationale de volume est le m 3 , et non le litre) i : nombre de particules formées par dissociation du soluté (phi) : coefficient osmotique = facteur de correction définition physique dephysique dell''osmolaritosmolaritéé loi de van't Hoff calcul de la pression osmotique en unités internationale : Pascal (Pa) = R.T.(n/V).i.1 atm = 101,3 kPa = 760 mmHg
R = 8,314 (UI)
T : en Kelvin (0 K = -273,15°C ; 1 K = 1°C)
nsans unité i : sans unité: sans unité V: !!! l'unité internationale de volume est le m 3 , et non le litre unités Pa osmolarité : en osm/m 3 en mosm/L physique dephysique dell''osmolaritosmolaritéé loi de van't Hoff calcul de la pression osmotique en unités internationale : Pascal (Pa) = R.T.(n/V).i.1 atm = 101,3 kPa = 760 mmHg
R = 8,314 (UI)
T : en Kelvin (0 K = -273,15°C ; 1 K = 1°C)
nsans unité i : sans unité: sans unité V: !!! l'unité internationale de volume est le m 3 , et non le litre unités kPa osmolarité : en osm/L (M) physique dephysique dell''osmolaritosmolaritéé loi de van't Hoff = R.T.(n/V).i. exemple : calcul de la pression osmotique due à une solution de10 mM de saccharose, à 20°C.
n/V = 10 mM saccharose en solution : ne se dissocie pas i = 1 = 1 = 8,314 x (20+273,15) x 10 x 1 x 1 = 24372 Pa 244 hPa exemples physique dephysique dell''osmolaritosmolaritéé loi de van't Hoff = R.T.(n/V).i. exemple : calcul de la pression osmotique due à une solution de10 mM de NaCl, à 20°C.
n/V = 10 mMNaCl en solution : se dissocie en Na
et Cl i = 2 = 0,93 = 8,314 x (20+273,15) x 10 x 2 x 0,93 = 45333 Pa 453 hPa exemples physique dephysique dell''osmolaritosmolaritéé physique dephysique dell''osmolaritosmolaritéé osmolarité d'un mélange exemple : calcul de l'osmolarité d'une solution contenant 10 mM de sacharose et 10 mM de NaCl osmolaritémolarité x(i. osmolarité d'un soluté osmolarité d'un mélange de solutés osmolarité totale osmolarité de chaque soluté osmolarité du saccharose : 10 x 1 x 1 = 10 mosm. L -1 osmolarité du NaCl : 20 x 2 x 0,93 = 18,6 mosm. L -1 osmolarité totale = 28,6 mosm. L -1 osmolarité efficace solutés imperméantsexemple : calcul de la différence de pression osmotique d'une solution A contenant 10 mM de saccharose et d'une solution B contenant 10 mM de NaCl physique dephysique dell''osmolaritosmolaritééABsaccharose
NaCl = R.T.(n/V).i. = R. T. osmolarité B = 8,314 x293,15x 18,3
= 453 hPa A = 8,314 x293,15 x 10
= 244 hPa A B = 244 - 453 = -209 hPa la différence de pression osmotique crée un mouvement d'eau de A vers B osmolarité efficace solutés imperméants physique dephysique dell''osmolaritosmolaritéé saccharoseNaCl AB A final > A initial (concentration due à la perte d'eau) le mouvement d'eau de A vers B crée, par la différence de hauteur, une pression hydrostatique qui s'oppose à l'osmose. B final < B initial (dilution due au gain en eau) h A -h B à l'équilibre, la différence de pression osmotique est égale à la différence de pression hydrostatique qui s'exerce en sens opposé osmolarité efficace solutés perméantscertains solutés traversent la membrane semi-perméable exemple : calcul de l'osmolarité et de la pression osmotique d'une solution contenant 10 mM d'urée physique dephysique dell''osmolaritosmolaritéé osmolarité : 10 x 1 x 1 = 10 mosm.L -1 osmolaritémolarité x(i. = R.T.(n/V).i.= R. T. osmolarité urée = 8,314 x 293,15 x 10 = 244 hPa osmolarité efficace exemple : calcul de la différence de pression osmotique d'une solution A contenant 10 mM de saccharose et d'une solution B contenant 10 mM d'urée physique dephysique dell''osmolaritosmolaritééABsaccharose
urée = R.T.(n/V).i. = R. T. osmolarité B = 8,314 x293,15x 10
= 244 hPa A = 8,314 x293,15 x 10
= 244 hPa A B = 244 - 244 = 0 hPa si la membrane est imperméable à l'urée, il n'y a aucun mouvement d'eau solutés perméants osmolarité efficace exemple : calcul de la différence de pression osmotique d'une solution A contenant 10 mM de saccharose et d'une solution B contenant 10 mM d'urée physique dephysique dell''osmolaritosmolaritééABsaccharose
urée = R.T.(n/V).i. = R. T. osmolarité B = 8,314 x293,15 x 5
= 122 hPa A = 8,314 x293,15 x (10 + 5)
= 244 + 122 = 366 hPa A B = 366 - 122 = 244 hPa solutés perméantssi la membrane est perméable à l'urée, les concentrations en urée s'équilibrent entre A et B (5 mM) urée osmolarité efficace exemple : calcul de la différence de pression osmotique d'une solution A contenant 10 mM de saccharose et d'une solution B contenant 10 mM d'urée physique dephysique dell''osmolaritosmolaritééABsaccharose
urée = R.T.(n/V).i. = R. T. osmolarité solutés perméants A = 8,314 x293,15 x (10 + 5)
= 144 + 122 = 366 hPa B = 8,314 x293,15 x 5
= 122 hPa A B = 366 - 122 = 144 hPa si la membrane est perméable à l'urée, la pression osmotique est due au saccharose osmolarité efficacephysique dephysique dell''osmolaritosmolaritéé solutés perméantsdans le cas d'un solution contenant des solutés perméants et non perméants, la pression osmotique à l'équilibre est due aux solutés imperméants osmolarité efficace : osmolarité des solutés non perméants NB : les flux d'eau et de particules n'étant pas instantanés, la situation d'équilibre n'est pas obtenue immédiatement variations transitoires d'osmolarité, de pression osmotique et de volume eau10 mM urée
membrane perméable à l'eau et à l'urée physique dephysique dell''osmolaritosmolaritéé augmentation transitoire de volume d'eau dans le tubeà l'équilibre, égalité des
concentrations en urée et des pressions osmotiques dynamique de l'osmose III. osmolaritIII. osmolaritééet volume cellulaire :et volume cellulaire : les cellules dans lles cellules dans l''organismeorganisme composition des milieux intérieurs liquide intersticiel milieu intracellulaire osmolarité cellulaire isosmolarité - isotonicité applications pratiques milieux intérieurs sang lymphe liquide extracellairequotesdbs_dbs16.pdfusesText_22[PDF] structure en coque architecture
[PDF] structure ? ossature
[PDF] construction de maison ? ossature de bois livre
[PDF] construction de maison ? ossature de bois
[PDF] maison ossature bois canada
[PDF] portée des solives de plancher
[PDF] coupe de mur maison ossature bois
[PDF] assemblage ossature bois
[PDF] ostinato mélodique exemple
[PDF] chanson connue avec ostinato
[PDF] ostinato musique classique
[PDF] culture en placard pdf
[PDF] rencontre définition sociologique
[PDF] qu'est ce qu'une rencontre philosophie
