 CODE: SVT DURÉE : 4H
CODE: SVT DURÉE : 4H
1-a-Calcul de la pression osmotique du NaCl. On a C=5mol/l. Page 8. 8. T = t+273°. T = 28+273 = 301°K. Le coefficient d'ionisation n est : NaCl. Na+ + Cl- Donc
 osmolarite.pdf
osmolarite.pdf
exemple : calcul de la pression osmotique due à une solution de. 10 mM de NaCl à 20°C. n/V = 10 mM. NaCl en solution : se dissocie en Na+ et Cl-. → i = 2.
 Solvants solutés et règles de dilution
Solvants solutés et règles de dilution
Isotonie : solutions qui ont la même pression osmotique (= concentration NaCl 09% devient NaCl 9‰. 46. Elise Rochais - IFSI 1ère année. Page 47 ...
 TP de Physiologie Animale :Hémolyse
TP de Physiologie Animale :Hémolyse
La membrane de cellule est capable de résister à cette pression osmotique exercée par la solution de NaCl à 6 ‰ . Le milieu extérieur est donc hypotonique
 Solutés de remplissage en anesthésie réanimation
Solutés de remplissage en anesthésie réanimation
• Pression osmotique exercée par une molécule-gramme d'un corps non ionisé • NaCl 9 g/L d'eau. • Masse molaire. – Cl: 355 g.mol-1. – Na: 23 g.mol-1. – NaCl ...
 Théorie et pratique des mesures de la pression osmotique par
Théorie et pratique des mesures de la pression osmotique par
unités convenables;. T : température absolue T = 273
 CORRIGE
CORRIGE
Comment une augmentation de la pression osmotique est-elle corrigée par l'hormone ADH ? Nous rappellerons les conséquences d'une ingestion de NaCl sur la
 Losmose inverse
Losmose inverse
calcul de la pression osmotique : π = R T c i où i est le nombre d'ions dissociés (deux dans le cas de NaCl) et c la concentra- tion molaire du soluté de
 DEBIT de FILTRATION GLOMERULAIRE DEBIT SANGUIN RENAL
DEBIT de FILTRATION GLOMERULAIRE DEBIT SANGUIN RENAL
23 mar. 2016 La pression oncotique est la force osmotique induite par les protéines ne passant pas la barrière de filtration et générant de ce fait un ...
 Compartiments hydriques et osmorégulation
Compartiments hydriques et osmorégulation
A = solution NaCl. B = solution NaCl + protéines. • • • •. • • • •. • • • •. A B. Pression osmotique et pression oncotique. Page 12. Transferts d 'eau. • Les
 osmolarite.pdf
osmolarite.pdf
NaCl saccharose. 453 hPa mise en évidence de la pression osmotique expériences exemple : calcul de l'osmolarité d'une solution de 10 mM de NaCl.
 Untitled
Untitled
calcul de la pression osmotique en unités internationale : Pascal (Pa) contenant 10 M de saccharose et d'une solution B contenant 10 M de NaCl.
 TD eau et régulation osmotique
TD eau et régulation osmotique
Calculer la molarité d'une solution aqueuse contenant 585 mg de NaCl par litre différence de pression osmotique entre les deux compartiments.
 Solvants solutés et règles de dilution
Solvants solutés et règles de dilution
Isotonie : solutions qui ont la même pression osmotique (= concentration en ions dissous) eau PPI dilution possible ensuite dans G5% ou NaCl 0
 (Démonstration cours )
(Démonstration cours )
de congélation est de -063°C
 a) Donner la définition de la molarité dune solution. b) Calculer la
a) Donner la définition de la molarité dune solution. b) Calculer la
exercice 4 : osmose pression osmotique. On place la solution précédente de NaCl (exercice 2 c) dans le compartiment de gauche.
 Solutés de remplissage en anesthésie réanimation
Solutés de remplissage en anesthésie réanimation
Sérum physiologique (NaCl 09%) Pression. • Pression hydrostatique. • Pression osmotique ... Calculer l'osmolarité du sérum physiologique ...
 Etude dune proteine membranaire des hematies
Etude dune proteine membranaire des hematies
même pour la solution de Glycérol d'Urée et de NaCl à 9‰. Réponse à la question I-A.2.b Bonus : calcul pression osmotique.
 Item 265 - ANOMALIES DU BILAN DE LEAU ET DU SODIUM
Item 265 - ANOMALIES DU BILAN DE LEAU ET DU SODIUM
14 set 2018 différences de pression hydrostatique et oncotique (correspondant au ... h de soluté de chlorure de sodium hypo-osmotique (NaCl à 45 ‰).
 Travail dirigé 7 : les propriétés colligatives
Travail dirigé 7 : les propriétés colligatives
14 ott 2015 Calculer la pression osmotique d'un mélange de 2 g de saccharose (Mr = 342) ... concentration d'une solution aqueuse de NaCl qui peut être ...
 [PDF] osmolaritepdf - e-fisio
[PDF] osmolaritepdf - e-fisio
10 mM NaCl membrane semi-perméable = perméable à l'eau imperméable aux solutés saccharose NaCl mise en évidence de la pression osmotique expériences
 [PDF] Théorie et pratique des mesures de la pression osmotique - Agritrop
[PDF] Théorie et pratique des mesures de la pression osmotique - Agritrop
Pour l'urée 1 osmole vaut 60 g d'urée Pour NaCl on ne pourra définir que les osmoles de Na+ et de CL- puisqu'en solution il y a dissociation de
 [PDF] TD eau et régulation osmotique
[PDF] TD eau et régulation osmotique
Calculer la molarité d'une solution aqueuse contenant 585 mg de NaCl par litre d'eau différence de pression osmotique entre les deux compartiments
 [PDF] Pression osmotique osmolalité - osmolarité - PharmaEtudes
[PDF] Pression osmotique osmolalité - osmolarité - PharmaEtudes
o Pression osmotique = pression empêchant un solvant 1 mmol de NaCL = 2 mosm = 1 mosm de Na+ et 1 mosm de Cl- o Calcul de la clairance osmolaire
 [PDF] Pression osmotique exercice pdf - Squarespace
[PDF] Pression osmotique exercice pdf - Squarespace
Son unité est l'équivalent (Eq) Calculer la concentration ionique de la solution précédente NaCl est à la concentration de 10 mM Chaque mole de NaCl porte
 [PDF] Osmose Pression osmotique
[PDF] Osmose Pression osmotique
Calcul du flux osmotique Loi de Fick Expressions de la Pression osmotique • Un seul soluté neutre NaCl g/l 100 proportion d'hématies lysées
 [PDF] Chapitre 2 - opsuniv-batna2dz
[PDF] Chapitre 2 - opsuniv-batna2dz
Calcul de la pression osmotique en unités internationale : Pascal (Pa) ? = R T ? saccharose et d'une solution B contenant 10m M de NaCl
 [PDF] TD de BIOPYSIQUE - Exercices corrigés - F2School
[PDF] TD de BIOPYSIQUE - Exercices corrigés - F2School
Les unités de calcul utilisé sont souvent dans le système MKS les Pour calculer la pression osmotique on doit déterminer la concentration
Comment calculer la pression osmotique en ATM ?
Cette pression osmotique peut être mesurée directement avec un osmomètre, ou elle peut être calculée à partir de la concentration de soluté dans la cellule (C) à partir de la relation (formule de van Hoff) : ? = RTC; où R est la constante de gaz, T est la température absolue (en degrés Kelvin) et C est la concentrationComment calculer la pression osmotique d'une solution de saccharose ?
On a donc :
1Pour le saccharose : Osm = m = 0,006*10 = 0,06 mol/L.2Pour le glucose : Osm = m = 0,011*10 = 0,11 mol/L.3Ainsi, il ne te reste plus qu'à additionner les deux pressions osmotiques de tes deux solutions pour obtenir celle du mélange :4Osm = 0,06 + 0,11 = 0,17.Comment se fait la pression osmotique ?
La pression osmotique naît de la séparation par une membrane* semi-perméable de deux compartiments de concentrations différente. L'eau migre du compartiment le moins concentré vers le plus concentré afin d'« équilibrer » le système pour avoir la même force ionique dans les deux compartiments.- Osm calculée = Natrémie x 2 + Glycémie + Urémie. Osm efficace (=tonicité) = Natrémie x 2 + Glycémie.
1 Elise Rochais - IFSI 1ère année
Le circuit du médicament
Le circuit du médicament = 4 étapes :
yLa prescription : médecin yLa dispensation : pharmacien yLa préparation : pharmacien/préparateur/IDE yL'administration ͗ IDE 2La préparation des médicaments
Acte de préparation et reconstitution du médicament aǀant l'administration de celui-ci au patient yReconstitution de solutions ă partir d'une poudre yCalculs de doses, choix de solvants yRègles à respecter : yRecommandations de bonne pratiquesElise Rochais - IFSI 1ère année 3
Préparation des médicaments
injectables yMédicament injectable : yDose individuelle le plus souvent adaptée au patient (poids, yDoses unitaires de médicaments standardiséesConditions indispensables :
Elise Rochais - IFSI 1ère année 4
Stérilité et apyrogénicité de la solution PlanPARTIE I : SOLVANTS ET SOLUTES
yGénéralités Ȃ définitions Ȃ rappels yLes différents solvants et solutés yLes contenantsPARTIE II : REGLES DE DILUTION - PREPARATION
5 Elise Rochais - IFSI 1ère année
SOLVANTS ET SOLUTES
PARTIE I
6 Elise Rochais - IFSI 1ère année
Définitions
ySolvant : liquide possédant la propriété de dissoudre certaines substances solution Tout liquide aqueux contenant une ou plusieurs substances médicaments ySolutés massifs : V > 100 mL plusieurs solutés dans un solvantElise Rochais - IFSI 1ère année 7
Généralités
Elise Rochais - IFSI 1ère année 8
Généralités
yIsotonie : solutions qui ont la même pression osmotique (= concentration en ions dissous) yHypotonie : solution avec une concentration en ions inférieure (au sang par exemple) yHypertonie : solution avec une concentration en ions supérieureElise Rochais - IFSI 1ère année 9
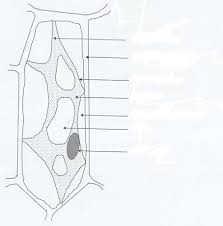
Osmose/effet osmotique
une membrane semi-perméable (laisse passer H20, pas les grosses molécules par ex)Elise Rochais - IFSI 1ère année 10
tend à égaliser les concentrations de solution au niveau cellulaireAu niveau cellulaire
Au niveau des globules rouges :
Elise Rochais - IFSI 1ère année 11
Hypotonie
les hématiesEclatement de la
cellule = hémolyseIsotonie Hypertonie
hématies la cellule se collabeConcentration en
hématies identique _ _ _Au niveau cellulaire
Au niveau des globules rouges :
Elise Rochais - IFSI 1ère année 12
Hypotonie
les hématiesEclatement de la
cellule = hémolyseIsotonie Hypertonie
hématies la cellule se collabeConcentration en
hématies identique _ _ _Généralités
yMédicament injectable se présente sous forme de : yPoudre ou lyophilisat à reconstituer y2 étapes successives : yEtape de reconstitution (si poudre ou lyophilisat) yEtape de dilution ySolvants différents, contraintes physico-chimiques différentes yEx : érythromycine lyophilisat : reconstitution uniquement avec eau PPI, dilution possible ensuite dans G5% ou NaCl 0,9%Elise Rochais - IFSI 1ère année 13
Généralités
yVoie IV yPériphérique yCentrale yVoie SC (réhydratation personne âgée,Elise Rochais - IFSI 1ère année 14
Classification des solvants et
solutés yǯ 00 yLes solutés glucosés yLes cristalloïdes yLes solutés alcalinisants yLes colloïdes yLes solutés osmotiquesElise Rochais - IFSI 1ère année 15
Eau pour préparations injectables
Eau PPI : = eau stérile, exempte de pyrogènes (= qui provoque de la fièvre) et de particules Ȉ Hypotonique-> ne pas injecter seule ! Sinon hémolyse médicaments injectables ySolvantEx : Augmentin® :
Poudre remise en solution ds eau PPI
ou dans NaCl 0,9% [Vidal]Elise Rochais - IFSI 1ère année 16
Solutés glucosés
= solutions aqueuses contenant du glucose (dextrose) (% correspond au nombre de grammes de glucose / 100 mL)3 types :
yhypotonique : G2,5% yisotonique : G5% yhypertonique : G10%, 15%, 20%, 30% et 50% Ex : Amikacine® : reconstituer le contenu du flacon avec deNaCl 0,9%, G5% ou G10%.
Elise Rochais - IFSI 1ère année 17
Solutés glucosés
Indications :
ySolutés hypotoniques (G2,5%) : yRéhydratation dans les états hyperosmolaires yPatients diabétiquesAdministration : voie IV lente
y Solutés isotoniques (G5%) : yHydratation yVéhicule pour administration de médicaments injectablesyA"""- ..." ȋδ -"- ""-±"Ȍ
Administration : voie IV
Elise Rochais - IFSI 1ère année 18
Solutés glucosés
ySolutés hypertoniques (G10%, 15%, 20%, 30% et 50%) yHypoglycémie sévère yProphylaxie et traitement de la cétose dans les dénutritions, les diarrhées ou les vomissements yPrévention des déshydratations intra et extra cellulaires yRéhydratation lorsqu'il existe une perte d'eau supérieure à la perte en chlorure de sodium et autres osmoles yVéhicule pour apport thérapeutique en période pré-opératoire, per-opératoire et post-opératoire immédiate yApport calorique glucidiqueEx : 1L de G30% apporte 1200 kcal
Administration : voie IV centrale
Elise Rochais - IFSI 1ère année 19
Solutés glucosés
yEffets indésirables : yDiurèse osmotique, polyurie yDéshydratation yHyperglycémie, hypokaliémie yThrombophlébite yContre-indications : yHypersensibilité, intolérance au glucose ySurcharge hydrique yHyperglycémie, acidose yIRC sévère (G50%) yMises en garde : yDiabète : risque de déséquilibre ySurveillance kaliémie, glycémie, glycosurieElise Rochais - IFSI 1ère année 20
Les cristalloïdes
yTraversent facilement la paroi des vaisseaux yPrincipal utilisé : sérum physiologique yChlorure de sodium, NaCl yA la concentration de 0,9% ysoit 0,9 gramme de NaCl dans 100 mL yOu 9 grammes dans 1 LElise Rochais - IFSI 1ère année 21
1 gramme (g) = 1000 milligrammes (mg)
1 Litre (L) = 1000 millilitres (mL)
Les cristalloïdes
1.Isotoniques :
yNaCl 0,9% (sérum physiologique) : yRéanimation hydroélectrolytique : apport Na et Cl yHydratation, garde veine yPerfusion IV ou administration SC yRinger = Na, K, Ca/Ringer lactate = Na, K, Ca, lactate yDéshydratation yHypovolémie (hémorragies, brûlures...) yAcidose métabolique (pour Ringer lactate)Elise Rochais - IFSI 1ère année 22
Les cristalloïdes
2.Hypertoniques :
yNaCl 7,5% : 75g de Na/L yNaCl 10% (ampoule) : 100g de Na/L yNaCl 20% (ampoule) : 200g de Na/L yCorrection des pertes hydroélectrolytiques avec apport yApport sodique (nutrition parentérale) yPerfusion IV centraleElise Rochais - IFSI 1ère année 23
Les cristalloïdes
yEffets indésirables : yHyperhydratation yContre-indications : ySolutés salés : rétention hydrosodée, insuffisance cardiaque, cirrhose hépatique décompensée, hypernatrémie, hyperchlorémie yRinger (lactate) : hyperhydratation, insuffisance cardiaque, hyperkaliémie, hypercalcémie, alcalose métabolique (Ringer lactate)Elise Rochais - IFSI 1ère année 24
Les polyioniques glucosés
2 formules :
1.Glucose + 4g Na + 2g K (/L)
yGlucidion G5%®, Polyionique G5%®, Bionolyte G5%®,Osmotan
͝ά̾Ȉ Glucidion G10%®, Polyionique
G10%®, Bionolyte G10%®
2.Glucose + 2g Na + 1,5g K + 1g de Ca (/L)
G10%®
Elise Rochais - IFSI 1ère année 25
Les polyioniques glucosés
yIndications : yApports calciques glucidiques yDésordres hydroélectrolytiques yDéshydratation toléré) yEffets indésirables : oedèmes, hyperkaliémieElise Rochais - IFSI 1ère année 26
Les solutés alcalinisants
2 types :
yIsotonique : bicarbonate de sodium 1,4% yHypertonique : ybicarbonate de sodium 4,2% (semi-molaire) ybicarbonate de sodium 8,4% (molaire)Elise Rochais - IFSI 1ère année 27
Les solutés alcalinisants
yIndications : yAcidose métabolique toxiques ex : aspirine) yHyperkaliémie menaçant le pronostic vital (Ĺ entrée intracellulaire de K) yCertaines intoxications (Antidépresseurs tricycliques, salicylés...) acido- basiquesElise Rochais - IFSI 1ère année 28
Les solutés alcalinisants
hypertoniques yEffets indésirables : yHypokaliémie yAlcalose métabolique yHypernatrémie yMises en garde : ySuivi ionogramme (K), gaz du sang, pH yNombreuses incompatibilités physico-chimiques +++Elise Rochais - IFSI 1ère année 29
Les colloïdes
= grosses molécules qui restent dans les vaisseaux pendant un certain temps et attirent l'eau des liquides interstitielsPouvoir de remplissage > cristalloïdes
yColloïdes naturels : Albumine (Médicament Dérivé du Sang) dextransElise Rochais - IFSI 1ère année 30
Les colloïdes
1.Les gélatines : Solutés constitués de molécules
protéiques (gélatines modifiées) Expansion volémique au moins égale au volume perfuséÉlimination rapide
yGélofusine 4%® (gélatine, Na) yPlasmion® (gélatine, Na, Mg, K, lactate, chlorures)Elise Rochais - IFSI 1ère année 31
Les colloïdes
yIndications : yRemplissage vasculaire yTraitement ou prophylaxie des états de chocs hypovolémiques (suite hémorragies, brûlures, grandes déshydratations) et yHypotension au cours des anesthésies yEffets indésirables : yHyperkaliémies, alcalose métabolique (Plasmion®)Elise Rochais - IFSI 1ère année 32
Les colloïdes
ǯhydroxyéthylamidons HEA (glucides naturels modifiés) Expansion volémique rapide, supérieure ou égale au volume perfuséMaintien le volume sanguin pendant 6h
yVoluven®, Restorvol 6%® = HEA + NaCl yPlasmavolume® = HEA, Na, K, Ca, Mg, acétate, chloruresElise Rochais - IFSI 1ère année 33
Les colloïdes
yIndications : remplissage vasculaire (restauration du volume sanguin circulant) yLes spécialités à base d'HEA doivent uniquement être utilisées dans le traitement de l'hypovolémie due à des pertes sanguines aiguës lorsque l'utilisation des cristalloïdes seuls est jugée insuffisante. pour détecter une éventuelle hypersensibilitéElise Rochais - IFSI 1ère année 34
Les colloïdes
yEffets indésirables : y2±...- ǯ"""-± yTroubles respiratoires, cardiovasculaires (hypotension...) y Hypernatrémie, hyperchlorémie (Hyperhes®)Elise Rochais - IFSI 1ère année 35
Les colloïdes
yContre-indications : nombreuses ! yHypersensibilité yIRC ou thérapie d'épuration extrarénale continue yTroubles de la coagulation sévères (hémophilies, maladie de Willebrand)yInsuffisance cardiaque ou hépatique sévère, troubles de la natrémie et de la chlorémie, accouchement
y Hémorragies intracrâniennes yPatients atteints de sepsis yPatients brûlés yPatients déshydratésElise Rochais - IFSI 1ère année 36
Les colloïdes
3.Les dextrans : Solutés constitués de glucose
Expansion volémique rapide, supérieure ou égale au volume perfuséNe sont plus utilisés (mauvaise tolérance)
Indication :
Hypovolémie avec hypotension liée à un état de choc traumatique (dose unique, perfusion IV rapide 2-5min)Elise Rochais - IFSI 1ère année 37
Les solutés osmotiques
yLe mannitolquotesdbs_dbs16.pdfusesText_22[PDF] structure en coque architecture
[PDF] structure ? ossature
[PDF] construction de maison ? ossature de bois livre
[PDF] construction de maison ? ossature de bois
[PDF] maison ossature bois canada
[PDF] portée des solives de plancher
[PDF] coupe de mur maison ossature bois
[PDF] assemblage ossature bois
[PDF] ostinato mélodique exemple
[PDF] chanson connue avec ostinato
[PDF] ostinato musique classique
[PDF] culture en placard pdf
[PDF] rencontre définition sociologique
[PDF] qu'est ce qu'une rencontre philosophie
