 TP- Hémi-synthèse de laspirine
TP- Hémi-synthèse de laspirine
- Déterminer le réactif limitant d'une synthèse pour calculer le rendement en produit purifié en utilisant éventuellement un tableau d'avancement. Compétences.
 AE- Synthèse de laspirine
AE- Synthèse de laspirine
La réaction est catalysée par les ions H+. Cette réaction peut être considérée comme totale. acide salicylique anhydride éthanoïque aspirine acide éthanoïque.
 LE RENDEMENT DUNE SYNTHÈSE ORGANIQUE
LE RENDEMENT DUNE SYNTHÈSE ORGANIQUE
Doc.1 : Equation chimique de la synthèse de l'aspirine. Doc.2 : Rendement d'une synthèse. Le rendement chimique rend compte de l'efficacité de la réaction
 T.P. 16 Correction. SYNTHESE DE LASPIRINE II. Synthèse de l
T.P. 16 Correction. SYNTHESE DE LASPIRINE II. Synthèse de l
Par refroidissement la solution se sature en composé à purifier mais les impuretés restent dissoutes. ?Rendement de la réaction. • Il faut déterminer la
 Benjamin Marchetti
Benjamin Marchetti
2°) Pour réaliser la synthèse de l'aspirine à partir de l'acide salicylique On appelle rendement ? d'une réaction chimique le rapport entre la quantité ...
 TS-C8-stratégie en synthèse Orga-prof
TS-C8-stratégie en synthèse Orga-prof
Synthèse de l'aspirine : On prépare l'aspirine à partir de l'acide salicylique b) Calculer la masse d'aspirine obtenue si le rendement était de 100 %.
 TS/Cours/Stratégie de synthèse. Page 1 TS Thème : AGIR l Défis du
TS/Cours/Stratégie de synthèse. Page 1 TS Thème : AGIR l Défis du
Bien entendu le rendement doit être le plus grand possible ! Exemple : Synthèse de l'aspirine : On prépare l'aspirine à partir de l'acide salicylique qui porte.
 TRAVAUX PRATIQUES DE CHIMIE ORGANIQUE
TRAVAUX PRATIQUES DE CHIMIE ORGANIQUE
Manipulation 1 : Synthèse de l'aspirine . Le rendement d'une synthèse est le rapport entre la quantité de matière de produit.
 Synthèse de laspirine.
Synthèse de laspirine.
calcul d'un rendement ;. - aspects liés à la sécurité ; On va réaliser la synthèse d'un médicament usuel l'aspirine (acide acétylsalicylique).
 T.P 19-a SYNTHESE DE LASPIRINE.
T.P 19-a SYNTHESE DE LASPIRINE.
f) Calculer la masse d'aspirine que obtient si le rendement de la préparation de l'aspirine est de 90 % . ( M(asp) = 180 g.mol-1). 2) Séparation. · Retirer l'
 SERIE D EXERCICES SUR ACIDES CARBOXYLIQUES ET DERIVES
SERIE D EXERCICES SUR ACIDES CARBOXYLIQUES ET DERIVES
On va réaliser la synthèse d’un médicament usuel l’aspirine (acide acétylsalicylique) L’aspirine est connu pour ses propriétés antalgiques antipyrétiques et anti-inflammatoires Il est aussi utilisé comme antiagrégant plaquettaire I Les techniques utilisées : Document 1 : Chauffage au bain marie Becher
 Chimie Chapitre 7 Terminale S STRATEGIE DE SYNTHESE EN
Chimie Chapitre 7 Terminale S STRATEGIE DE SYNTHESE EN
La synthèse de l’acide acétylsalicylique principe actif de l’aspirine peut être réalisée au laboratoire à partir d’acide salicylique et d’anhydride éthanoïque Comment expliquer cette réaction de synthèse au niveau microscopique ?
 L’acide acétylsalicylique : l’aspirine
L’acide acétylsalicylique : l’aspirine
1 HISTORIQUE : DU SAULE À L’ASPIRINE Avec une production annuelle de quatre-vingts milliards de com-primés l’aspirine est aujourd’hui le médicament le plus vendu dans le monde [1] Il est utilisé comme analgésique anti-inflammatoire et antipyréti-que Il est prescrit sous différentes formes : en poudre en cachets en
 TP n°16 : Synthèse de l’aspirine
TP n°16 : Synthèse de l’aspirine
b) Calculer le rendement de votre synthèse III-Identification de l’aspirine Lorsqu’un produit solide est pur sa température de fusion est constante et connue Dans le cas de l’aspirine elle est de l’ordre de 135°C Rédiger comment faire pour vérifier que vous avez bien obtenu de l’aspirine avec le banc
 Searches related to synthèse de l+aspirine rendement PDF
Searches related to synthèse de l+aspirine rendement PDF
C2 : La synthèse de médicaments Doc 4 : Protocole de la synthèse et de la séparation de l'aspirine réalisé • Dans un erlenmeyer de 250 mL bien sec introduire 50 g d'acide salicylique et 70 mL d'anhydride éthanoique • Ajouter avec précaution 5 gouttes d'acide sulfurique concentré
Comment synthétiser l’aspirine?
1-1 L’aspirine peut être synthétisée en faisant réagir l’anhydride éthanoïque et l’acide 2- hygroxybenzoïque (également appelé acide salicylique). 1-1-1Ecrire les formules semi-développées de l’anhydride éthanoïque et de l’acide salicylique. 1-1-2Ecrire l’équation bilan de la réaction de synthèse de l’aspirine.
Quelle est la composition de l’aspirine ?
En effet, l’aspirine fait partie de la famille des médicaments anti-inflammatoires non stéroïdiens (AINS). La substance active contenue dans ce médicament est l’ Acétylsalicylate de DL lysine à une dose de 1800 mg dont la quantité correspondante en acide acétylsalicylique est de 1000 mg pour un sachet-dose.
Quel est le protocole de synthèse de l’aspirine ?
Analyse d’un autre protocole de synthèse : Une autre synthèse de l’aspirine utilise également l’acide salicylique (3,0 g) mais remplace l’anhydride éthanoïque par du chlorure d’éthanoyle (85 mL). Le solvant est alors le dichlorométhane (85 mL) et la température doit être maintenue à 0°C.
Comment synthétiser l'aspirine ?
L'aspirine, ou acide acétylsalicylique, est un médicament bien connu qui est synthétisé par acétylation de l'acide salicylique. Comment réaliser la synthèse d'un solide tel que l'aspirine ? Est-il possible de synthétiser l'aspirine avec un rendement de 100 % ? Vous devez disposer d'une connexion internet pour accéder à cette ressource.
AE- Synthèse de l'aspirine
L'aspirine (ou acide acétylsalicylique) est un médicament antipyrétique, anti-inflammatoire et analgésique. Il
possède également des propriétés anti-coagulantes : c'est pourquoi l'aspirine peut-être utilisée de manière
préventive pour diminuer la formation de caillots sanguins responsables des accidents vasculaires cérébraux (AVC).Document 1 : Synthèse de l'aspirine
L'aspirine peut être obtenue par une réaction dite d'estérification entre l'acide salicylique et l'anhydride
éthanoïque. La réaction est catalysée par les ions H Cette réaction peut être considérée comme totaleacide salicylique anhydride éthanoïque aspirine acide éthanoïque
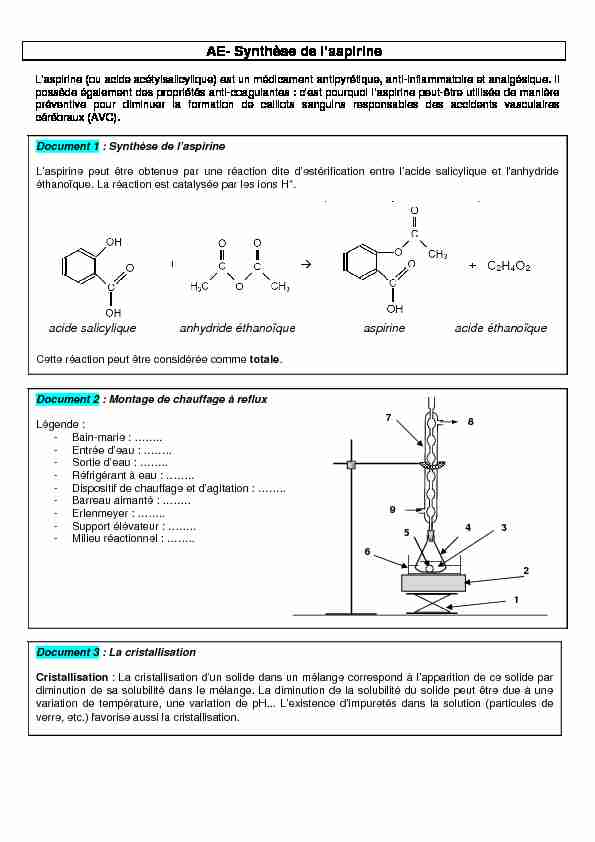
Document 2 : Montage de chauffage à reflux
Légende :
- Bain-marie : ........ - Entrée d'eau : ........ - Sortie d'eau : ........ - Réfrigérant à eau : ........ - Dispositif de chauffage et d'agitation : ........ - Barreau aimanté : ........ - Erlenmeyer : ........ - Support élévateur : ........ - Milieu réactionnel : ........ 2 9 8 6 7 4 5 3 1Document 3 : La cristallisation
Cristallisation : La cristallisation d'un solide dans un mélange correspond à l'apparition de ce solide par
diminution de sa solubilité dans le mélange. La diminution de la solubilité du solide peut être due à une
variation de température, une variation de pH... L'existence d'impuretés dans la solution (particules de
verre, etc.) favorise aussi la cristallisation ORG A Vous (voir (étap profe Doc sal Anéth
Aéth
su Doc Lors est c plus QueANISATION
allez travaétape 2)
e es 3 et 4). sseur, soit a cument 5 Nom Acide licylique nhydride hanoïqueAspirine
Acide hanoïque Acide lfurique cument 4 que l'eau c créée grâce rapide et p lques cons i - PlacerBüchne
r - Ouvrir g - Imbiber - Filtrer le - NE JAM l"équilibr de la tro N : iller par gr o et sur l"autre . Pour les au laborato5: donnée
Aspectà2
solidebl densité: liquideinc densité: solidebl liquideinc densité: liquideinc densité: : La filtra circule, une e à la tromp lus efficac e ignes à resp un morcea r. randement d"eau le p a e mélange.MAIS FERM
re de press ompe à eau oupe de 4. S e paillasse binômes d e oire. es physic25°C
anc 1,44 olore 1,08 anc olore 1,05 olore 1,83 ation Büc aspiration e à eau. C e ement un pr pecter lors d au de pap le robinet d apier filtre etER le robin
ion entre l"i ou soulev eSur une pai
sera mis e e la rangée co-chimiqRisques
chner dans la fiol ela permet roduit solide de la filtratio pier filtre d d"eau. t vérifier son net AVANT ntérieur de er le Büchne llasse sera en place le e coté cou ques SoluPeusol
l"Réagitv
avec forman tétha
Trèspeus
l'eauà20 à6Trèsso
l'éthano soitlat e solubilité entoute e à vide de filtrer e. on : dans le n " adhésio d"avoir " ca la fiole à vi er de la fiole mis en pla c e dispositif loir, la filtr a ubilité lubledans eau. violemment l'eauen tdel'acide noïque. solubledan0°C,soluble
60°C.
lubledans lquellequ e empératureédansl'eau
proportion on » au Büc asser le vid de et l"exté e PUIS ferm ce le dispos de la crista ation se ferTempér
changem T fus T fus T éb ns e e .T fus (sedécom°Cav
temp d"ébu u n T fus T éb chner avec u de » (c"est-à rieur). Pour mer le robineBüch
Trompe à
Fiole à vid
sitif permett allisation et ra soit sur raturesde mentd'état =159°C =r73°C =139°C =135°C mposeà140 vantla pérature ullition) =17°C =118°C une spatuleà-dire avant
r cela débra et.Papier f
hnerà eau
de tant la synth t de la filtra la paillasse Masse molair 138g/m
102g/m
0 180g/m 60g/m
98g/m
e en verre. t d"avoir rét ancher le tu iltre
Filtrat
hèse ation e du e re mol mol mol ol ol tabli yauPROTOCOLE :
Etape 1 : préparation du milieu réactionnel
Dans un ballon, peser 6, d'acide salicylique.
Sous la hotte, rajouter 12 mL d'anhydride éthanoïque prélevé avec une pipette graduée.
Ajouter 6 gouttes d'acide sulfurique pur.
Etape 2 : chauffage à reflux
Mettre en place le dispositif expérimental schématisé dans le document ..... Mettre en route l'agitation et la circulation d'eau.Appeler le professeur pour la vérification.
Régler la plaque chauffante à 90 °C.
Lorsque la température indiquée par la sonde thermométrique atteint environ 80 °C, maintenir le
chauffage pendant 20 min avant de passer à l'étape 3.Pendant ce temps, préparer dans un cristallisoir un bain réfrigérant (mélange d'eau et de glaçons) et
répondre aux questions.Etape 3 : cristallisation
Retirer le bain marie.
Maintenir l'agitation et la circulation d'eau dans le réfrigérant.Verser par le sommet du réfrigérant quelques gouttes d'eau distillée puis délicatement environ 50 mL
d'eau distillée.Transvaser le contenu du ballon dans un bécher de 150 mL en récupérant le barreau aimanté à l'aide
d'une " canne à pêche ». Placer le bécher dans un mélange réfrigérant (eau-glace).Attendre la cristallisation du produit brut.
Etape 4 : filtration
Mettre en place la filtration sur Büchner.
Filtrer le contenu du bécher. Ne pas hésiter si le solide est trop compact à le casser délicatement avec
une spatule." Casser le vide » en débranchant le tuyau ou en séparant l'entonnoir de filtration de la fiole et laver le
solide avec un peu d'eau distillée froide.Relancer la filtration.
" Casser le vide » PUIS fermer le robinet. A l'aide d'une spatule, récupérer le solide dans un bécher de 100 mL.Etape 5 : recristallisation+ filtration
Ajouter dans le bécher contenant le solide brut, 20 mL d'un mélange de solvants (mélange eau distillée
froide / éthanol) (mélange déjà préparé).Agiter avec un agitateur en verre.
Pour augmenter la solubilité des cristaux, chauffer le contenu du bécher sur une plaque jusqu'à ce que
tout le solide soit dissous (agiter de temps en temps). Refroidir la solution dans un mélange réfrigérant (eau +glace). Ajouter 50 mL d'eau distillée fraîche (agiter de temps en temps).Filtrer sur Büchner.
Rincer avec un peu d'eau distillée fraîche.
Récupérer les cristaux dans une coupelle préalablement pesée.Peser le solide obtenu.
QUESTIONS :
1) Compléter le document 2 en associant un numéro à chaque élément de la légende.
2) Expliquer le fonctionnement du réfrigérant à eau et préciser l'intérêt d'un chauffage à reflux pour la réaction de synthèse.
3) En supposant que l'acide salicylique est le réactif limitant, déterminer les espèces chimiques présentes
dans le milieu réactionnel à la fin de l'étape 2.4) Pourquoi rajoute-on de l'eau au sommet du réfrigérant dans l'étape 3 ?
5) Pourquoi utilise-t-on un mélange réfrigérant pour la cristallisation ?
6) Pourquoi utilise-t-on de l'eau froide pour laver le solide dans l'étape 4 ?
7) Quel est l'intérêt d'utiliser un mélange eau/éthanol lors de l'étape 5 ?
8) Question de synthèse : résumer le rôle de chaque étape du protocole par une phrase.
Pour aller plus loin (et il faudra y aller soit en classe, soit à la maison) :1) Dans la formule de l'acide salicylique, entourer et nommer les groupes caractéristiques.
2) Ecrire la formule semi-développée de l'acide éthanoïque.
3) Montrer que les quantités de matière initiales des réactifs sont n
1 = ........... pour l'acide salicylique et n 2 = ................ pour l'anhydride éthanoïque.4) Déterminer le réactif limitant.
5) En déduire la quantité de matière maximale d'aspirine (notée n
max ) pouvant être obtenue.6) En déduire la masse maximale d'aspirine (notée m
max ) correspondante.7) A partir de la masse d'aspirine réellement obtenue, déterminer le rendement de la synthèse.
Le rendement d'une synthèse est égal au rapport de la masse (ou de la quantité dematière en produit obtenue) par celle attendue. La masse attendue est déterminée à l'aide
de l'équation de la réaction et de la composition initiale du système.quotesdbs_dbs29.pdfusesText_35[PDF] la statistique définition
[PDF] définition de la population statistique
[PDF] l'importance de la statistique
[PDF] qu'est ce que les statistiques
[PDF] différence entre la statistique et les statistiques
[PDF] objectif de la statistique
[PDF] type d'action de formation (article l.6313-1 du code du travail)
[PDF] traitement comptable rachat d'actions
[PDF] typologie des actions de formation professionnelle continue
[PDF] action ordinaire vs action privilégiées
[PDF] statut juridique association ? but non lucratif
[PDF] association culturelle
[PDF] association déclarée but lucratif
[PDF] association d'utilité publique
